【www.zhangdahai.com--毕业生自我鉴定】
高 茵,李杰峰,张 宁,王华健,赵志强,郑丽丽,陆 安,田 勇,杨 威,徐丽娜
(1.河北工程大学生命科学与食品工程学院,河北 邯郸 056038 ;
2. 河北省畜牧兽医研究所,河北 保定 071001 ;
3.河北农业大学动物医学院,河北 保定 071001 ;
4. 石家庄市金元康牧药业有限公司,河北 石家庄 051130)
圆环病毒科包括猪圆环病毒1型(Porcine circovirus 1,PCV1)、猪圆环病毒2型(PCV2)和猪圆环病毒3型(PCV3),以及2019年Zhang等[1]在我国湖南表现严重临床症状的猪体内检测出的新型圆环病毒PCV4。感染PCV3的猪主要表现为猪皮炎肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)、全身器官的炎症反应等,对国内外的养猪业造成了严重的损失。目前为止,尚未有PCV3的商品化疫苗,所以商品化疫苗的研制有利于预防PCV3的感染,减少PCV3造成的损失。
PCV3属于圆环病毒科,圆环病毒属,其病毒粒子为二十面体结构。圆环病毒大小为12~27 nm,是目前为止人类所发现最小的、具有自主复制能力的、哺乳类动物DNA病毒[2]。猪圆环病毒均具有2个主要的开放式阅读框(Open reading frame,ORF),分别是ORF1和ORF2。ORF1主要编码与基因复制相关的Rep蛋白;
ORF2主要编码与免疫原性相关的结构蛋白[3,4]。
PCV3基因组全长约2 000 bp,与PCV1和PCV2的同源性较低,ORF2所编码的蛋白为衣壳蛋白(Cap protein)[5],编码Cap蛋白的基因长645 bp,共有214个氨基酸序列。本试验将PCV3cap基因克隆至原核表达载体pET-32a中,将重组质粒转化Rosetta大肠杆菌进行表达,并对诱导表达和纯化条件进行筛选,获得的PCV3-Cap蛋白可用于进一步揭示PCV3致病机理和开发PCV3亚单位疫苗。
1.1 主要试剂 TOP10甘油菌、Rosetta甘油菌、氨苄青霉素(Ampicillin,Amp)、质粒中量抽提试剂盒(通用型)、蛋白质Marker,均购自上海碧云天生物科技有限公司;
Tris-HCl、氯化钠、咪唑(Imidazole),均购自西格玛奥德里奇(上海)贸易有限公司;
异丙基硫代半乳糖苷(IPTG)、LB培养基,均购自北京索莱宝科技有限公司;
M5 BCA Protein Assay Kit,购自北京聚合美生物科技有限公司;
鼠源抗PCV3-Cap单克隆抗体、羊抗小鼠单克隆抗体,均为河北省畜牧兽医研究所兽医实验室保存。
1.2 主要仪器 Wes全自动蛋白质表达定量分析系统,美国ProteinSimple公司;
DYCZ-25D型双垂直电泳槽,北京六一生物科技有限公司;
JY300型电泳仪,北京君意东方电泳设备有限公司;
酶标分析仪,深圳市雷杜生命科学股份有限公司;
台式高速离心机,湖南赫西仪器装备有限公司;
SPX型智能生化培养箱,宁波市科技园区新江南仪器有限公司;
JW-2017HR型高速冷冻离心机,安徽嘉文仪器装备有限公司。
1.3 试验方法
1.3.1 重组质粒的获取 参照本实验室在病例中检测鉴定出的PCV3 HBBD1810毒株[6](GenBank登录号:MK105924)基因组序列信息合成cap基因,利用密码子优化网站(http://www.jcat.de)对密码子进行优化,并将其克隆至原核表达载体pET-32a中,引入酶切位点BamH Ⅰ和XhoⅠ,交由上海碧云天生物科技有限公司进行合成,构建重组原核表达载体,目的基因片段大小为642 bp。利用BamH Ⅰ和XhoⅠ对质粒进行酶切验证。
1.3.2 质粒的转化 取TOP10甘油菌冰上解冻,在TOP10感受态细胞悬液中加入10 μL 0.25 mg/mL重组质粒,冰浴30 min后迅速置于42 ℃水浴中90 s,结束后在其中加入100 μL LB培养液,于37 ℃、220 r/min培养1 h,4 000 r/min离心5 min,弃上清,沉淀重悬后将菌液涂布置含有Amp的LB培养基,倒置培养12 h。挑取单个菌落接种于含有Amp的LB培养液培养6 h。
1.3.3 表达载体的构建 取质粒转化后LB培养液培养得到的菌液,按照质粒中量抽提试剂盒(通用型)说明书提取质粒,取0.5 μL 0.25 mg/mL重组质粒导入100 μL感受态Rosetta中摇匀,使用500 μL不含抗生素LB培养液37 ℃、220 r/min培养1 h。4 000 r/min离心5 min,弃上清,沉淀重悬后将菌液均匀涂布于含有Amp的LB培养基,37 ℃倒置培养12 h。
1.3.4 蛋白的表达 接种环挑取2个菌落接种于含有Amp的LB培养基培养过夜后进行诱导表达。对照组1和对照组2使用空载Rosetta,其中对照组1不加诱导剂,对照组2添加1 mmol/L IPTG进行诱导培养;
对照组3和对照组4使用Rosetta导入空载pET-32a,其中对照组3加入1 mmol/L IPTG进行诱导培养,对照组4不加诱导剂;
试验组和对照组5使用Rosetta导入目的质粒,其中试验组加入1 mmol/L IPTG进行诱导培养,对照组5不加诱导剂。诱导培养4 h后12 000 r/min离心10 min,弃上清,进行SDS-PAGE。将验证正确的表达菌进行扩大培养,100 W冰水浴超声10 min,处理后分别取上清和沉淀进行SDS-PAGE,检查目的蛋白的存在形式。
1.3.5 最佳诱导浓度和条件的筛选 IPTG浓度梯度分别取0.2、0.4、0.6和0.8 mmol/L,每个浓度梯度分别在37 ℃下培养4、6和8 h,利用SDS-PAGE分析蛋白表达情况。
1.3.6 蛋白的纯化条件筛选 利用镍亲和凝胶(Ni-NTA resin)纯化带His标签的蛋白。选择60和300 mmol/L咪唑进行洗脱浓度筛选,分别将穿透液、洗涤液、洗脱液进行SDS-PAGE分析。
1.3.7 蛋白的透析 将纯化后所收集的目的蛋白经过6、4、3、2、1和0 mol/L梯度尿素缓冲液进行透析复性,每种梯度透析2 h。
1.3.8 蛋白的浓缩 使用ddH2O清洗浓缩管后加入超纯水3 000 r/min离心10 min,弃去上清,加入蛋白样品3 000 r/min,离心至体积为1 mL后取出,使用M5 BCA Protein Assay Kit对浓缩后蛋白进行定量分析,按照说明书绘制标准曲线,计算蛋白浓度。
1.3.9 Western blot验证 利用全自动蛋白表达分析系统,使用鼠源抗PCV3-Cap单克隆抗体、羊抗小鼠单克隆抗体,对目的蛋白进行验证。
2.1 重组质粒的获取 对构建的重组原核表达载体进行测序和双酶切验证。测序结果显示序列正确(图1)。利用BamHⅠ和XhoⅠ对提取的质粒进行双酶切,结果显示在642 bp左右出现了目的条带,进一步证实了质粒构建成功(图2)。

图1 重组质粒测序分析

图2 双酶切验证
2.2 蛋白的表达 蛋白表达SDS-PAGE结果显示,试验组可见42 kDa处有明显蛋白表达,且表达量高于未进行诱导的对照组5(图3)。将验证正确的表达菌进行扩大培养后经超声波破碎处理,分别取上清和沉淀进行SDS-PAGE,结果显示,目的蛋白条带主要以包涵体形式存在于沉淀,目的蛋白条带所在位置与预期大小42 kDa相符(图4)。

图3 蛋白诱导表达

图4 重组蛋白可溶性分析
2.3 最佳诱导浓度和条件的筛选 表达菌培养至OD600值为0.6时,分别加入0.2、0.4、0.6、0.8 和1.0 mmol/L IPTG,每个浓度梯度在37 ℃下分别培养4、6和8 h,SDS-PAGE结果显示,加入0.2 mmol/L IPTG诱导培养8 h后蛋白表达量较高(图5)。

图5 诱导表达条件优化
2.4 蛋白的纯化条件筛选 将穿透液、洗涤液、洗脱液分别进行SDS-PAGE分析,结果显示,在300 mmol/L咪唑洗脱后,菌体杂带被洗去,目的条带较为清晰(图6)。

图6 咪唑洗涤PCV3 Cap蛋白的SDS-PAGE鉴定
2.5 蛋白的透析和浓缩 重组蛋白经纯化后进行透析复性,SDS-PAGE结果显示,在42 kDa处出现预期条带(图7)。浓缩后蛋白浓度为0.5 mg/mL,蛋白总量3.5 mg,蛋白纯度>85%。
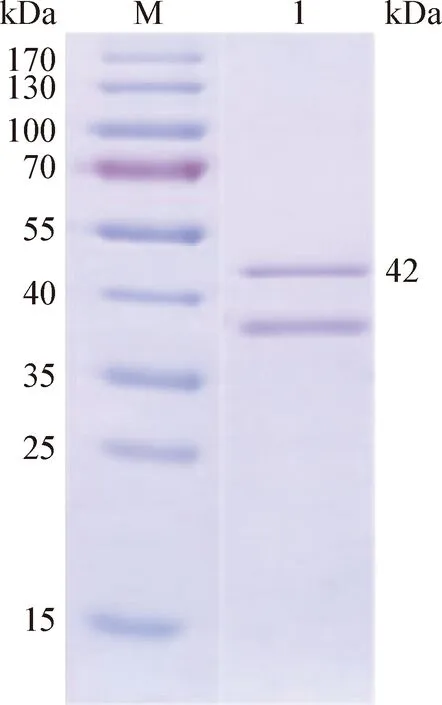
图7 蛋白透析结果
2.6 Western blot验证 Western blot结果显示,目的蛋白在42 kDa处被鼠源抗PCV3-Cap单克隆抗体识别,显示特异性条带(图8)。
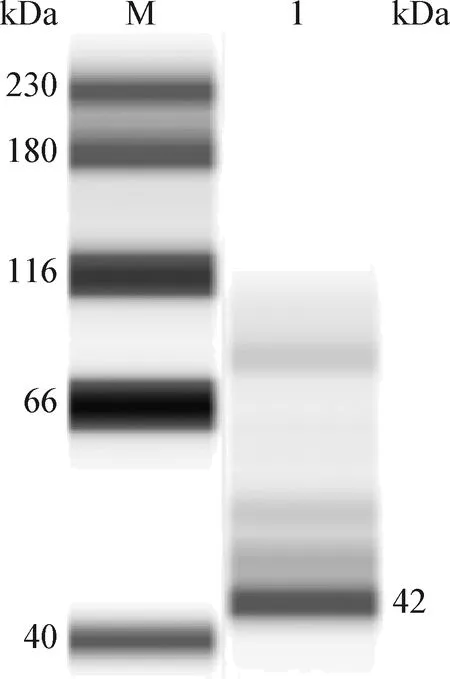
图8 Western blot结果
2016年,美国首次发现了PCV3的感染与传播[5],随后在全球范围内不断出现PCV3感染的报道[7],PCV3感染后主要导致病猪出现皮炎肾病综合征(PDNS),引起怀孕母猪流产,仔猪腹泻、呼吸困难、急性坏血性皮炎[7],且感染后全身器官出现炎性反应[8],对养猪业造成了巨大的损失。
苏战强等[9]对陕西株(GenBank登录号:KY418606.1)PCV3cap基因进行克隆,表达出35 kDa的蛋白,具有很好的免疫原性,并推测了其氨基酸残基处所存在抗原表位。湛洋等[10]对PCV2-Cap蛋白线性抗原表位与PCV3-Cap蛋白线性抗原表位进行对比,分析二者的蛋白线性抗原表位并不相同,所以市面上商品化PCV2疫苗极少能对PCV3存在交叉免疫保护作用。目前,尚无针对PCV3的商品化疫苗,猪群得不到有效的免疫保护,给我国养猪业造成了严重的经济损失。因此,为尽早研制出PCV3商品化疫苗,减少PCV3对养殖业造成的损失,还需更深入地对PCV3-Cap蛋白进行研究。
PCV3-Cap蛋白主要与免疫原性相关,本试验合成PCV3cap基因序列,导入原核表达系统并进行诱导表达,经过纯化和复性处理后获取了42 kDa的目的蛋白;
利用IPTG诱导培养,并对表达条件进行优化,结果显示,0.2 mmol/L IPTG诱导8 h时表达菌表达量有所增加。王忠田等[11]在对PCV2进行表达时发现,PCV2核定位信号中精氨酸的含量较高,并且存在较多的稀有密码子,以至于其不易在原核表达系统中表达。陈如敬等[12]将PCV3核定位信号中的大量精氨酸序列去除后获得了活性较高的目的蛋白,所以核定位信号的存在可能导致目的蛋白表达水平低,虽然本试验中的密码子均已进行优化,但并未将核定位信号敲除,所以经过诱导表达后的目的蛋白产量并没有显著升高。本试验超声波破菌处理后进行SDS-PAGE,结果显示,42 kDa的目的蛋白以包涵体的形式出现在沉淀,但除了在42 kDa处出现目的条带外,38 kDa处也出现了条带,分析其原因可能是大量精氨酸导致的蛋白表达不完全而产生的截短体。本试验蛋白质纯化结果显示,用300 mmol/L咪唑能够获得较为清晰的目的蛋白条带;
最终利用透析复性获得了42 kDa的目的蛋白,经过Western blot验证,所获取的目的蛋白能够被抗PCV3单克隆抗体识别,具有良好的反应原性,表明本试验成功构建了PCV3-Cap蛋白表达载体,成功表达PCV3-Cap蛋白。
目前,有关PCV3入侵和致病机制的研究还不够深入,对于PCV3的研究还处于初级阶段,且PCV3在细胞内无法传至第3代,使得难以获得PCV3病毒,所以PCV3-Cap蛋白的成功表达有助于PCV3的深入研究,并且为亚单位疫苗的研制以及检测试剂盒的开发提供了理论依据和前期基础。
猜你喜欢原核圆环条带加权全能量最小的圆环形变数学年刊A辑(中文版)(2022年4期)2022-02-16猪圆环病毒病的发生、诊断和防治现代畜牧科技(2021年4期)2021-07-21一例鸭圆环病毒病的诊断现代畜牧科技(2021年5期)2021-07-20华北地区地震条带的统计分析山西地震(2019年1期)2019-03-20圆环上的覆盖曲面不等式及其应用数学物理学报(2018年5期)2018-11-16基于条带模式GEOSAR-TOPS模式UAVSAR的双基成像算法系统工程与电子技术(2016年2期)2016-04-16结核分枝杆菌CFP10、ESAT6蛋白的原核表达、纯化及ELISPOT检测方法的建立与应用安徽医科大学学报(2015年9期)2015-12-16癌症标记蛋白 AGR2的原核表达及纯化动物医学进展(2015年10期)2015-12-07牛分支杆菌HBHA基因的克隆及原核表达动物医学进展(2015年10期)2015-12-07基于 Savitzky-Golay 加权拟合的红外图像非均匀性条带校正方法中国光学(2015年1期)2015-06-06本文来源:http://www.zhangdahai.com/gerenwendang/biyeshengziwojianding/2023/0918/656272.html




