【www.zhangdahai.com--其他范文】
陈艳芳, 文竹梅, 屈 峰, 刘青青, 邢先双, 罗 航, 李梦琪, 陈 杭, 刘 博,4
(1.福建农林大学林学院,福建 福州 350002;
2.曲阜市国有石门寺林场,山东 曲阜 273100;
3.山东省水文中心,山东 济南 250002;
4.曲阜师范大学,山东 曲阜 273100)
杉木(Cunninghamialanceolata)是我国南方重要的用材树种之一,具有生长快、产量高、材质好等特点,被广泛应用于生产生活各个领域[1],在我国森林资源中占有非常重要的地位.近年来,随着杉木连栽代数的不断增加,杉木林土壤理化性质逐渐恶化,地力衰退,生产力下降[2-3],严重影响了杉木林的可持续经营和发展.为此,国内外进行了大量的研究,但以往研究主要集中在土壤理化因子[4]、养分归还[5-6]、化学计量特征[7]等方面,而对土壤系统中的微生物研究相对较少.微生物在林地生态系统中发挥重要作用,对林地生产力和养分循环产生重要影响,并且微生物对环境的依赖性较强,任何细微的环境变化都会对微生物的多样性和群落结构产生较大影响[8].
丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)是一种广泛存在于陆地生态系统的共生菌,是土壤生态系统中的重要组成部分[9,10].AMF作为直接联系土壤和植物根系的一类微生物,利用根外菌丝将植物根系与土壤紧密地联系在一起,对土壤变化敏感.AMF群落结构会受到土壤理化性质的影响,如土壤全氮、有机质等能促进AMF的生长发育,土壤速效磷和无机氮能为AMF生长繁衍提供营养物质[11,12].同时AMF也是维持林地肥力和林木生产力的重要生物因子[13].
已有学者对杉木林AMF开展了研究[14-15].但在连栽杉木林经营过程中,AMF对不同连栽代数杉木林土壤质量变化的响应机制尚未明确,由此亟需进一步分析连栽代数杉木林对AMF群落分布的影响,揭示不同连栽代数杉木林AMF群落特征.鉴于此,本研究选取不同连栽代数(一、二、三、四代)的杉木林为研究对象,针对不同连栽代数杉木林,应用高通量基因测序技术对土壤AMF群落组成进行研究,探讨杉木连栽过程中AMF群落组成和多样性的变化,分析AMF群落多样性与土壤因子的关系,以期为高效培育杉木林提供依据.
1.1 研究地概况
试验地位于福建省南平市延平区王台镇溪后村安槽下(26°39′N,117°55′E).该地区为亚热带季风气候,平均海拔200 m,年均气温19.3 ℃.全年平均降雨量1 700 mm,降雨主要集中于3—8月,年均蒸发量为1 413 mm.样地土壤质地为砂质粘土或粘土.林下主要物种有Dicranopterisdichotoma、Miscanthusfloridulus、Woodwardiajaponica、Blechnumorientale、Alpiniachinensis等.
1.2 样地设置与土样采集
于2020年12月在研究区选取海拔、坡度,土壤类型及立地条件相近的一代林(G1,17年)、二代林(G2,17年)、三代林(G3,18年)和四代林(G4,15年)4个不同连栽代数的杉木林.每个样地设置3个20 m×20 m的样地,样地基本情况见表1.在每个样地内按五点取样法选取5棵长势相近的杉木,清除土壤表面凋落物,采集其0~20 cm的土壤,将同一样方内5棵杉木土壤均匀混合为一个样本,装入带有编号的自封袋中,并置于有冰袋的保温箱中保存.所采土样带回实验室后,立即过2 mm土壤筛,并分为两份,一份置于-80 ℃超低温冰箱保存备用,用于测定土壤AMF多样性;
另一份自然风干,用于测定土壤的理化性质.

表1 样地基本情况 Table 1 Basic information of the sample plots
1.3 AMF多样性测定
采用Illumina MiSeq高通量基因组测序方法测定AMF多样性.由北京奥维森基因科技有限公司进行测序,测序流程如下:采用土壤基因组DNA提取试剂盒(天根生化科技有限公司提供)提取土壤中AMF的DNA.第一轮扩增引物为AML1(5′-GCATATCAATAAGCGGAGGA-3′)和AML2(5′-GTCGTTTAAAGCCATT ACGTC-3′);
第二轮扩增引物为AMV4.5NF(5′-TTGAAAGGGAAACGATTGAAGT-3′)和AMDGR(5′-TACGTCAACATCCTTAACGAA-3′).PCR反应条件:94 ℃ 5 min,94 ℃ 5 s,58 ℃ 6 s,72 ℃ 10 s,30个循环;
72 ℃ 7 min.第二轮PCR扩增体系:94 ℃ 5 min,94 ℃ 5 s,58 ℃ 6 s,72 ℃ 10 s,30个循环;
72 ℃ 7 min;
4 ℃保存.两次扩增得到的产物均采用1.0%(质量分数)琼脂糖凝胶电泳检测,纯化后使用Miseq PE300上机测序.
1.4 土壤理化性质测定
土壤pH值采用电位法(水土比2.5∶1)测定;
土壤有机质含量采用重铬酸钾容量法(外加热)测定;
全碳和全氮含量采用德国Elementar, Vario Max元素分析仪测定;
土壤全磷含量采用钼锑抗比色法测定;
土壤速效磷含量测定采用双酸浸提法;
土壤速效钾含量采用火焰光度计法测定;
硝态氮、铵态氮含量采用全自动连续流动分析仪(AA3 SEAL Analytical,荷兰)测定.
1.5 数据处理
利用SPSS 19.0软件对所有试验数据进行统计分析,采用单因素方差分析(one-way ANOVA)和最小显著差法(LSD)进行显著性检验,显著水平为0.05.采用Canoco 4.5对AMF、多样性指数与土壤因子之间的关系进行冗余分析(redundancy analysis, RDA).最后利用Origin 9.0软件作图,图表中数据均为平均值±标准误.
2.1 不同连栽代数杉木林土壤AMF群落OTUs的组成及结构
由图1可知,抽取的序列数达到27 000条以上,且随着测序条数的增加,各处理土壤AMF稀释曲线趋于平缓.说明不同处理的土壤样本测序数据量足够大,测得的数据能反映土壤中AMF群落的真实情况,可对AMF群落组成及多样性进行分析;
但仍有少量AMF种类未被发现.本研究从不同连栽代数杉木林土壤中共得到1 314 765条有效序列.
从图2可看出不同连栽代数杉木林土壤AMF群落OTUs组成的差异及共有物种的情况.从图2可知,所有样本中共检测到1 340个OTUs,第一代(G1)、第二代(G2)、第三代(G3)和第四代(G4)分别有729、881、984和962个OTUs,分别占总OTUs数的54.40%、65.75%、73.43%和71.79%.第一代中特有的AMF群落OTUs占总OTUs序列数的2.54%,第二代中特有的AMF群落OTUs占7.54%,第三代中特有的AMF群落OTUs占8.36%,第四代中特有的AMF群落OTUs占1.87%.此外,第一代与第二代间共有OTUs数为533个(39.78%),第二代与第三代共有的OTUs数量为615个(45.90%),第三代与第四代共有的OTUs数量为779个(58.13%),4个连栽代数间共有406个OTUs,占总OTUs序列数的30.30%.

2.2 不同连栽代数杉木林土壤AMF群落的多样性
由表2可知,第二代杉木林AMF多样性指数均高于其它代数,其次为第三代.

表2 不同连栽代数杉木林土壤AMF Alpha多样性分析1) Table 2 α diversity index of soil AMF community under C.lanceolata plantations planted in different rotations
通过高通量测序,不同连栽代数杉木林土壤样本共检测1 340个AMF-OTUs.其中,相对丰度前三的属分别为Glomus、Rhizophagus和Rhizoglomus.由图3可以看出,Glomus属是杉木林各代数的优势属,第一代到第四代相对丰度分别为99.04%、98.45%、97.25%和91.21%,且随着代数的增加而减少.根孢囊霉属第一代到第四代相对丰度分别为0.66%、1.02%、2.66%和8.74%,且随着代数的增加而增加.4个代数中Rhizoglomus的相对丰度均在1%以下.
2.3 不同连栽代数杉木林土壤AMF群落的PCoA聚类分析
基于β多样性对不同连栽代数AMF进行主坐标分析(principal coordinates analysis, PCoA),探索不同连栽代数样本间AMF群落组成的相似性或差异性.由图4可知,在OTU水平上,PCoA 1轴和2轴解释方差分别为37.87%和19.69%,第二代和第一代大部分都位于主成分1的正半轴,第三代和第四代位于主成分1的负半轴;
第四代和大部分第一代位于主成分2的正半轴,第三代和大部分第二代位于主成分2的负半轴.第一代与第二代之间距离较近,表明AMF群落组成较为相似;
第三代与第四代之间距离较远,表明AMF群落组成具有较大差异.

2.4 环境因子相关性

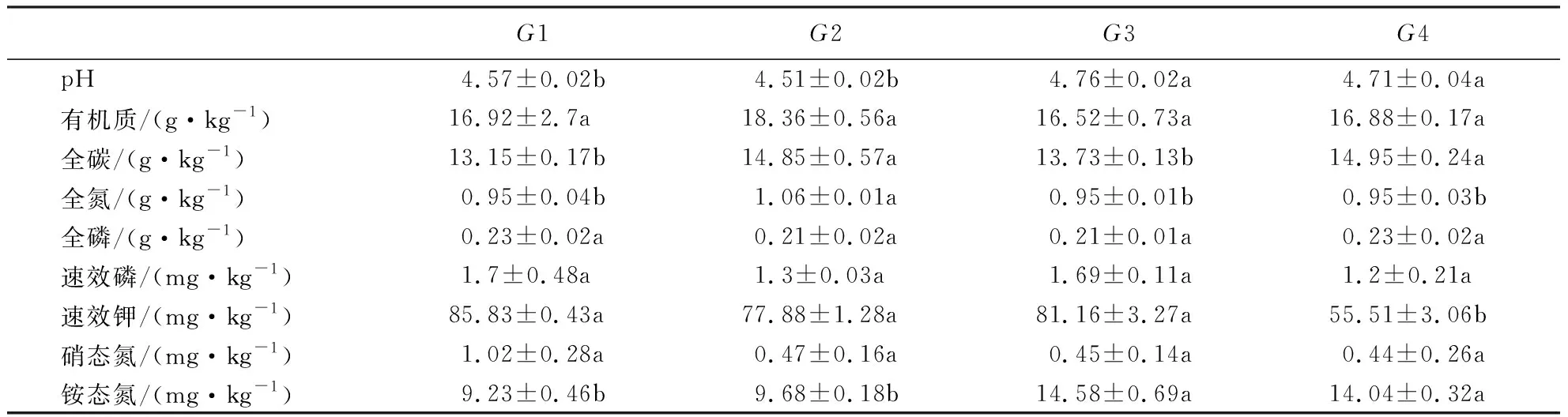
表3 不同连栽代数杉木林土壤的化学性质1) Table 3 Basic chemical characteristics of soil under C.lanceolata plantations planted in different rotations
从图5可知,速效钾、铵态氮、pH、速效磷和硝态氮与AMF群落丰度存在相关关系,其中,Glomus的物种Glomus-Gken1与速效钾含量呈极显著负相关;
铵态氮含量与Glomus-An08-GLO5呈正相关关系,与Glomus-Gken3呈负相关;
Glomus-sp.、Glomus-Gollotte04-sp.-5、Archaeospora-Li14-Arc1物种的丰度与速效磷含量呈正相关关系;
Gigaspora-Gig4与速效磷含量呈极显著正相关.

图5 基于种水平的AMF群落物种丰度(前20)与环境因子的相关性热图 Fig.5 Spearman correlation heatmap analysis of the correlation between species abundance of AMF community (top 20) at the species level and soil environmental factors
不同连栽代数杉木林土壤AMF主要属的相对丰度与土壤环境因子的冗余分析(redundancy analysis, RDA)分析结果(图6a)显示,土壤因子对AMF主要属群落组成的变异解释量超过99.7%,第一排序轴解释群落变化的98.8%,而第二排序轴解释群落变化的0.9%.对于优势属而言,Glomus属与速效钾含量呈正相关,与有机质含量呈负相关;
根孢囊霉属与铵态氮含量呈正相关,而Rhizoglomus与全氮、全碳含量呈正相关,与pH、铵态氮含量呈负相关.多样性指数与土壤环境因子的RDA分析(图6b)结果表明,第一排序轴、第二排序轴对AMF多样性指数与土壤环境因子的解释率分别为94.3%和0.2%.所有土壤因子中,铵态氮含量对AMF的Chao1指数、ACE指数影响最大,呈正相关;
而速效钾、硝态氮含量与之呈负相关.全氮含量与Simpson呈正相关,与全磷含量呈负相关.

图6 土壤AMF主要属的相对丰度与土壤环境因子的RDA分析(a)及多样性指数与土壤环境因子的RDA分析(b) Fig.6 Redundancy analysis of relative abundance of AMF main genera and soil environmental factors (a) and redundancy analysis of AMF diversity index and soil environmental factors (b)
不同连栽代数杉木林土壤AMF相对丰度前三的属分别为Glomus、Rhizophagus和Rhizoglomus,其中Glomus属是杉木林各代数的优势属,与景跃波等[14]对杉木林AMF多样性的研究结果一致.这可能是因为Glomus是AMF中最大的群体,生活范围较宽,可以在地下形成一个庞大的菌丝网络系统[16-17];
其次,Glomus属能够通过菌丝片段和菌根根段繁殖,有较强的产孢能力和侵染植物根系能力,适应能力强[18].






