【www.zhangdahai.com--其他范文】
苏燕萍,卢陈英,吕玲春,郑沈菲,王君禾,陈敏江,纪建松,
1.丽水市中心医院 放射科,浙江 丽水 323000;
2.丽水市中心医院 心内科,浙江 丽水 323000;
3.丽水市中心医院 浙江省影像诊断与介入微创研究重点实验室,浙江 丽水 323000;
4.温州医科大学 第一临床医学院(信息与工程学院),浙江 温州 325035
Takotsubo综合征(Takotsubo syndrome, TTS)是一类以可逆性室壁运动异常及急性左心功能不全为特征的综合征[1-2],最初被认为是一种良性疾病,然而最新的研究表明,TTS每年住院病死率约1.8%,长期病死率约3.5%[3],约5.9%的患者在病程中发生心脏骤停[4],约21.8%的患者在住院期间发生重大临床事件[5-6],这均表明,TTS并非是一种良性疾病,其病死率并不亚于急性心肌梗死(acute myocardial infarction, AMI)[7-8]。TTS首诊症状常表现为急性胸痛、胸闷、呼吸困难等,同时伴有肌钙蛋白(cardiac troponin, CTN)、B型脑利钠肽(brain natriuretic peptide, BNP)等心脏标志物的升高,心电图以ST段抬高常见[9],与AMI的临床表现相似,在临床征象上较难区分,尤其是左前降支梗阻型AMI(acute myocardial infarction with left anterior descending coronary artery obstruction, AMI-LAD)[1],TTS国际指南将两者作为重要鉴别诊断对象[10-11]。因此,TTS临床鉴别诊断的难度较大,左心室造影和冠脉造影仍然是确诊TTS和排除AMI-LAD的金标准[11],但该诊断方法作为有创检查,仍具备一定风险,且随诊顺应性较差。因此,如能在影像学层面建立一种特征性的TTS鉴别诊断策略,这对于临床诊疗方案的及时制定和干预具有重要意义。心脏磁共振成像(cardiac magnetic resonance, CMR),因其较高的时间、空间分辨力、良好的软组织对比度、多参数多序列后处理方式等优势,可以明确心肌水肿、纤维化,尤其是钆对比剂延迟增强序列,在TTS与AMI-LAD的精准鉴别诊断方面具备一定的优势[12]。然而,由于CMR检查时间长、需要注射对比剂等缺点,急性期伴有左心功能不全的TTS患者往往难以耐受。Native T1-mapping具有无需对比剂、成像时间短、客观真实反映心肌状态等优点,本研究笔者将重点针对Native T1在TTS和AMI-LAD的精准鉴别诊断中的价值进行探索。
1.1 一般资料 选取2018年1月至2022年2月于丽水市中心医院就诊的TTS患者13例,AMI-LAD患者26例,均行CMR检查。TTS纳入标准:①急性期超声心动图表现为心尖部运动乏力,恢复期消失,运动异常区域超出单一冠脉供血范围;
②发病前存在心理或躯体压力诱因;
③出现新的心电图异常表现;
④心肌损伤标志物升高;
⑤排除冠脉梗阻(狭窄>50%);
⑥CMR排除心肌炎等其他疾病。AMI-LAD纳入标准:①急性期超声心动图表现为节段性室壁运动异常,恢复期存在;
②出现新的心电图异常表现;
③心肌损伤标志物升高;
④左前降支冠脉梗阻(狭窄>50%);
⑤CMR延迟增强序列强化区域与梗阻冠脉供血范围一致。排除标准:①生命体征不稳定;
②不能配合CMR或存在检查禁忌证;
③既往存在心肌梗死或心肌炎等病史。本研究获丽水市中心医院伦理委员会批准[(2021)第(226)号]。
1.2 实验室检查 患者入院24 h内完成血样采集,检测肌钙蛋白I(cardiac troponin I, CTNI)、肌红蛋白(myohemoglobin, MYO)、肌酸激酶(creatine kinase, CK)、肌酸激酶同工酶(creatine kinase isoenzyme MB, CKMB)、谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspertate aminotransferase, AST)、C反应蛋白(c-reactive protein, CRP)、乳酸脱氢酶(lactic dehydrogenase,LDH)、BNP等实验室指标。
1.3 影像学检查 患者入院14 d内完成CMR检查,采用飞利浦Ingenia 3.0T磁共振仪,18通道表面相控阵线圈,MRI兼容PERU心电门控板,Medtron Injektor Accutron MR高压注射器。扫描前被检者进行呼吸训练,扫描时心率整齐、呈平静状态。所有患者扫描参数如下:①电影序列(Cine):采用真实稳态自由进动快速(B-TFE)序列进行左心室长轴(二、三、四腔心)及短轴Cine序列采集,主要参数:TR:shortest,TE:shortest,FA 45°,层厚 8 mm。②T2-STIR:在短轴及长轴四腔心上使用STIR序列采集,主要参数:TR 2倍RR间期,TE 75 ms, FA 90°,层厚8 mm。③T1-mapping:运用MOLLI序列进行Native T1-mapping采集,对比剂注射后9~12 min采集Enhanced T1-mapping,主要参数TR:shortest,TE:shortest,FOV:300 mm×300 mm,矩阵:144×142,层厚8 mm。④T2-mapping:采用多回波SE序列进行T2-mapping采集,TR为1倍的心动周期,TE使用shortest,Echoes:9,设备计算生成T2/R2 map图。⑤延迟增强序列(LGE):采用相位敏感反转恢复(PSIR)序列进行钆对比剂延迟增强磁共振序列采集,主要参数:TR shortest,TE 3 ms, FA 25°,层厚8 mm。
1.4 CMR图像处理分析 图像扫描完成后导入后处理分析软件(Circle cvi42),勾画Cine序列心内、外膜轮廓,在Short 3D及Tissue Tracking模块得到左心室各项心功能参数及心肌应变参数:EF、EDV、ESV、SV、HR、CO、CI、GSR、GSC、GSL。在T2模块勾画Native T2-mapping心内外膜轮廓得到 Native T2值;
在T1模块勾画Native T1-mapping及Enhanced T1-mapping心内外膜轮廓,标记各层面血池感兴趣区(region of interest, ROI),输入红细胞比容得到Native T1及ECV值;
软件根据美国心脏协会(American Heart Association, AHA)分段法得到各参数16节段数据。在LGE/T2-STIR序列中勾画正常心肌ROI,定义高于正常心肌平均值5个标准差的区域为强化区域,高于正常心肌平均值3个标准差的区域为水肿区域,定义强化/水肿面积大于相应节段50%为阳性节段,计算每例病例T2-STIR及LGE阳性节段数量。将每例病例根据是否水肿节段分为两组,计算水肿节段及非水肿节段Native T1、ECV、Native T2平均值。所有图像均采用双盲法处理分析,由2名经验丰富的放射科医师独立完成,参数结果取平均值。
1.5 观察指标 研究观察指标具体如下:①一般资料,如性别、年龄、BMI、临床症状、病史、吸烟史,心电图表现包括ST-T抬高、T波倒置、QTc延长、房室传导阻滞等;
②实验室检查结果、左室心功能参数、左室心肌应变参数及Native T1、ECV、Native T2。
1.6 统计学处理方法 采用SPSS25.0统计分析软件。符合正态分布的计量资料以±s表示,组间比较采用两独立样本t检验,不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Wilcoxon检验。计数资料以例数(%)表示,组间比较采用Fisher 精确概率法。将差异有统计学意义的指标纳入单因素Logistic回归分析后,利用多因素Logistic回归分析筛选独立危险因素;
采用受试者工作特征(receiver operating characteristic, ROC)曲线比较各独立危险因素及联合模型对TTS及AMI-LAD的鉴别诊断效能,计算曲线下面积(area under curve, AUC)、灵敏度、特异度。P<0.05为差异有统计学意义。
2.1 一般资料比较结果 TTS组与AMI-LAD组年龄差异无统计学意义(P>0.05)。TTS组较AMI-LAD组女性患者比例较高(P=0.012),BMI值较低(P= 0.043),见表1。2组患者心电图大多表现为ST段抬高,均存在不同程度的胸痛、胸闷、呼吸困难,部分TTS患者病程中伴发心跳骤停,差异无统计学意义(P>0.05)。实验室检查结果表明,TTS组患者CTNI、CKMB较AMI-LAD组低,但BNP、CK、LDH、CRP较AMI-LAD高(P<0.05),见表2。

表1 2组患者的基本临床资料

表2 2组患者的血液检查结果[ M(P25,P75)]
2.2 影像学参数比较结果 左室心功能结果表明,2组患者各项心功能指标差异无统计学意义(P>0.05),见表3。2组均表现为心尖部运动乏力,收缩末期呈“气球样”扩张,相应区域出现大面积水肿,TTS组无明显延迟强化,而AMI-LAD组存在与水肿区域一致的延迟强化(见图1)。CMR后处理结果表明,2组间左室心肌应变GSR、GSC、GSL及T2-STIR阳性节段差异无统计学意义(P>0.05),TTS组Native T1、Native T2高于AMI-LAD组(P<0.001),ECV、LGE阳性节段少于AMI-LAD(P<0.001),见表4。

表4 2组患者CMR后处理结果

图1 60岁女性AMI-LAD患者和61岁女性TTS患者的CMR影像

表3 2组患者的左室心功能检查结果
CMR后处理结果显示,2组组内水肿节段Native T1、ECV、Native T2值均高于非水肿节段(P<0.001),TTS组水肿节段相较于AMI-LAD组水肿节段Native T1、Native T2值高(P<0.05),ECV值低(P<0.05),TTS组非水肿节段Native T1、T2值均高于AMI-LAD组非水肿节段,而ECV值低于AMI-LAD非水肿节段(P<0.05),见表5;
AMI-LAD各值变化集中于心尖部,而TTS则表现为整体性改变(见图2、图3)。
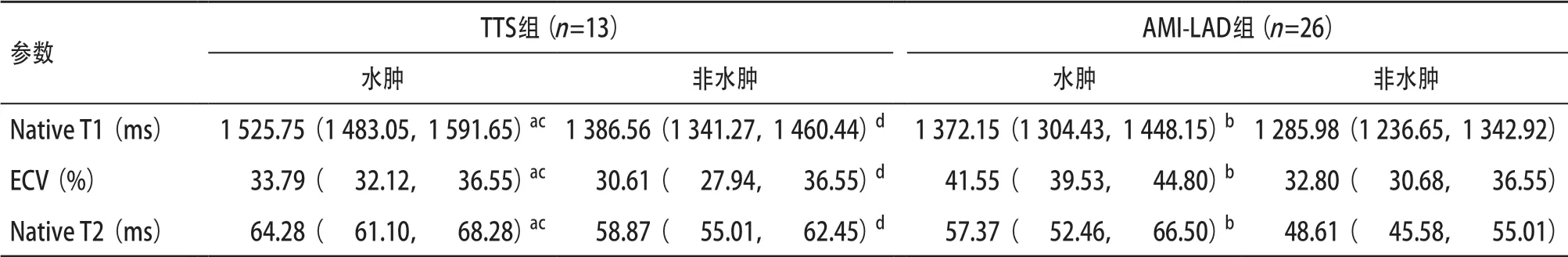
表5 2组患者水肿、非水肿节段Native T1、ECV、Native T2结果

图2 60岁女性AMI-LAD患者和61岁女性TTS患者的CMR后处理图像

图3 60岁女性AMI-LAD患者和61岁女性TTS患者的Native T1-mapping、ECV-mapping、Native T2-mapping牛眼图
2.3 鉴别诊断效能比较 经单因素Logistic回归分析后将性别、BNP、Native T1纳入多因素Logistic 回归分析,最终确认BNP、水肿节段Native T1是TTS鉴别于AMI-LAD的独立危险因素(见表6)。对BNP、水肿节段Native T1及两者联合模型绘制ROC曲线(见图4),BNP、Native T1、联合模型诊断两者的AUC分别为0.852(95%CI=0.702~0.945)、0.911(95%CI=0.776~0.978)、0.920(95%CI=0.787~0.983),灵敏度分别为84.62%、84.62%、84.62%,特异度分别为76.92%、84.62%、96.15%。

图4 BNP、Native T1及两者联合模型的ROC曲线

表6 单因素及多因素Logistic回归筛选TTS鉴别AMI-LAD的独立危险因素
TTS是一类急性心力衰竭综合征,好发于绝经后女性,拥有与AMI-LAD极其相似的临床特征,有研究报道称疑似AMI-LAD就诊的患者中,约2%被诊断为TTS,在女性患者中,该比例可能为10%[13]。近年来,随着CMR技术的发展,其在TTS诊断中的地位逐渐提高,虽然CMR延迟增强序列可以根据心肌坏死与否鉴别TTS与AMI-LAD[1],但因其检查时间过长且需要注射对比剂等限制,实际操作难度较高,急性期患者鲜少可以耐受。本研究利用无需对比剂的快速成像序列Native T1-mapping对TTS及AMI-LAD进行诊断,发现Native T1对于两者的鉴别具有较高的敏感度与特异度,对临床诊断具有重要价值。
TTS与AMI-LAD的CMR均表现为心尖部心肌收缩乏力、大面积水肿及严重的左心功能障碍。左室心肌应变根据心肌不同方向的形变呈现运动情况,可以有效识别局部异常运动[14],但无法在TTS与AMILAD之间进行有效鉴别,这与STIERMAIER等[15]的研究结果一致。TTS患者存在大面积的心肌水肿、损伤,CRP值明显高于AMI-LAD,SCALLY等[16]发现,TTS的水肿与全身性炎症显著相关。AMI-LAD心肌水肿节段与TTS虽差异无统计学意义,但CRP却明显低于TTS,说明AMI-LAD的心肌水肿并非由炎症引起,而是由于心肌缺血,正因如此,损伤心肌较为局限,这可能也是AMI-LAD患者BNP值比TTS患者低的原因。此外,TTS与AMI-LAD最大的区别是,AMI-LAD存在大面积心肌组织坏死,而TTS无心肌坏死,两者的CTNI水平、心肌延迟强化差异及ECV值的不同全面展现了这一点[17],ECV在TTS水肿节段的中位数为33.79%(40%>损伤>30%),而在AMI-LAD水肿节段的中位数为41.55%(纤维化>40%),明显高于TTS组。
心肌含水量的增加可以延长T1、T2弛豫时间,这使得Native T1、T2具备量化心肌水肿的能力[18]。TTS患者不论是心肌整体Native T1、T2,还是水肿节段NativeT1、T2均高于AMI-LAD患者,提示TTS心肌水肿程度更高。此外,在T2-STIR显示无水肿的节段,TTS患者Native T1、T2值也高于AMI-LAD患者,说明Native T1、T2发现心肌损伤的能力比T2-STIR更强。Native T1对细胞内外游离水含量的变化十分敏感,在急性炎症、血管扩张和充血期间[19],可以更加敏锐地检测到微小损伤,有效替代Native T2的功能[20],展现了其在心肌损伤领域的诊断潜力。
本研究也存在一定的缺陷。首先,由于TTS发病率低,本研究纳入的患者人群较小。在后续研究中,笔者将进一步收集相关患者,进一步扩充样本量,在条件允许的情况下,开展多中心研究。另外,本研究只关注了AMI与TTS的鉴别诊断,对于其他类型的AMI没有研究,需要进一步探索,全面了解 Native T1在心肌损伤中的诊断价值。
综上所述,BNP、水肿节段Native T1以及两者联合模型的AUC分别为0.852、0.911、0.920, Native T1可以有效鉴别TTS与AMI-LAD,联合BNP可提高鉴别诊断效能。Native T1值具有客观、精准、成像时间短、无需对比剂等优点,在TTS与AMI-LAD的鉴别中代替钆对比剂延迟增强扫描的作用,缩短检查时间,使之为更多急性期TTS患者所耐受,为肾功能不全患者提供更多选择,争取黄金治疗时间,提高患者预后。此外,Native T1对于T2-STIR无法识别的细微损伤也有良好的识别能力,这提示我们,这项技术可能可以应用于更早期心肌损伤的识别、诊断之中,有望于成为诊断心肌损伤的可靠方法。
猜你喜欢 节段水肿心肌 脊柱骨折患者应用短节段椎弓根钉棒固定手术的应用效果观察中国典型病例大全(2022年12期)2022-05-13超声诊断心肌淀粉样变性伴心力衰竭1例中国典型病例大全(2022年10期)2022-05-10心脏超声在诊断冠心病节段性室壁运动异常中的价值中国典型病例大全(2022年9期)2022-04-19腰椎融合手术后邻近节段退变的研究进展健康体检与管理(2021年6期)2021-11-17心肌桥是什么病?保健与生活(2021年11期)2021-06-10造成颈椎及腰椎融合术后邻近节段退行性变的因素中国典型病例大全(2021年15期)2021-01-10水肿是怎么回事,该怎样消除水肿呢?人人健康(2020年4期)2020-05-25从水肿捕捉疾病的蛛丝马迹养生保健指南(2019年9期)2019-12-17查出“心肌桥”怎么办家庭医药(2019年8期)2019-08-27做个瘦子 送走水肿肌Coco薇(2016年8期)2016-10-09本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0424/588900.html




