【www.zhangdahai.com--其他范文】
曙阿克·哈尔恒,谢姗珊,邵昌明,夏武雪,曾斌芳
(新疆医科大学中医学院,乌鲁木齐 830017)
慢性萎缩性胃炎(Chronic atrophic gastritis,CAG)是胃黏膜反复损伤后,发生炎性浸润、腺体萎缩、胃黏膜层变薄[1-2],常伴有肠上皮化生、异型增生等[3-5]为特征的消化系统疾病,临床主要表现为胃脘部疼痛、胀满、不思饮食等。胃内菌群稳态是维持胃肠道健康的关键条件,在CAG 患者体内胃菌群多呈紊乱状态,导致胃内菌群中拟杆菌、普雷沃氏菌等有益菌丰度降低,而放线菌、假单胞菌等致病菌丰度升高,使胃内菌群的多样性呈降低趋势[6]。CAG 诊断金标准为胃黏膜组织病理学结果[7-8]。CAG 患者5 年胃癌的年发病率为0.1%[9-10],早期诊治CAG 有助于阻断其向胃癌进展[11]。目前,西医药物治疗CAG 方法局限,效果不理想,而中医药治疗CAG 具有多靶点、多途径综合治疗的特点,临床疗效明显[12-13]。本研究采用养阴活胃合剂治疗CAG,以养阴生津、健脾活血祛瘀为法,探究养阴活胃合剂治疗CAG 的作用机制及与胃内菌群的关联,为临床科学应用养阴活胃合剂提供实验依据。
1.1 实验动物SPF级雄性SD大鼠60只,购自新疆医科大学动物实验中心(动物许可证号:SCXK(新)2018-0002),体重180~230 g,相对湿度55%~60%,室温18~22℃,昼夜明暗交替12 h,自由饮水进食。
1.2 药品、试剂与仪器养阴活胃合剂(免煎颗粒剂):新疆医科大学第一附属医院中药房供应,维酶素片购自湖北绿金子药业有限责任公司(批号140501),单功能烷化剂甲基硝基亚硝基(N-methyl-N"-nitro-N-nitrosoguanidine,MNNG)购自日本TCI 公司(批号M0527),盐酸雷尼替丁胶囊购自云鹏医药集团有限公司(批号E210303),无水乙醇购自天津北联有限公司购置(批号20200320),氯化钠AR 分析纯购自国药集团化学试剂有限公司购置(批号20191206)。组织包埋机、石蜡切片机购自美国Leica公司;
全自动酶标仪购自瑞士Tecan 公司;
通用型EP 管(0.6 mL、1.5 mL)购自美国Axygenl 公司;
冻存管(5 mL)购自江苏海门(批号DCG002)。
1.3 分组及制备CAG 大鼠模型取SPF级雄性SD大鼠60只适应性饲养7 d后,按随机数字表法分为空白组(10 只)、CAG 造模组(50 只)。空白组正常饲养,CAG 造模组采用以MNNG 为主的五因素复合造模法建立慢性萎缩性胃炎(Chronic atrophic gastritis,CAG)大鼠模型,持续造模10 周。依据胃黏膜病理结果确定模型复制成功后,将CAG 造模组大鼠随机分为模型组、养阴活胃合剂低(0.25 mL/100 g)、中(0.5 mL/100 g)、高(1 mL/100 g)剂量组与维酶素组(维酶素,0.5 mL/100 g),每组10 只。持续8 周干预,于第18 周于胃窦进行组织取材。
1.4 检测指标
1.4.1 一般状态 每周观察记录空白组、模型组、养阴活胃合剂低、中、高剂量组与维酶素组大鼠干预前后的精神、毛色、饮食饮水量、体重变化等情况。
1.4.2 胃黏膜组织病理变化 将各组大鼠胃窦组织置于4%多聚甲醛液,固定24 h,72 h后进行组织梯度乙醇脱水→石蜡包埋→切片→烤片→苏木素+伊红HE染色→光学显微镜下拍照(×100)观察胃黏膜病理。
1.4.3 胃内菌群组成及物种差异性的检测 采用SDS方法提取基因组DNA,进行PCR 扩增,将PCR 扩增产物进行混样和纯化,进行Qubit 定量和文库检测合格后,使用NovaSeq 6000 进行上机测序,对拼接数据进行质控,最后采用Flash软件将有overlap的reads对进行拼接,检测各组胃内菌群组成及差异性。
1.5 统计学处理采用SPSS 26. 0 软件对数据资料进行统计学分析。符合正态分布且方差齐的组间差异性分析采用单因素方差分析;
不符合正态分布或方差不齐的组间差异性分析采用Mann-WhitneyU检验,以P<0.05为差异有统计学意义。
2.1 各组大鼠一般情况比较干预8 周后,与空白组大鼠比较,模型组大鼠精神萎靡迟钝,出现皮毛脱落,饮水量增多,体重下降;
与模型组大鼠比较,养阴活胃合剂低、中、高剂量组大鼠精神状态佳,活动增加,毛色恢复柔顺,饮食饮水恢复正常,体重明显上升。
2.2 各组大鼠胃黏膜大体形态观察与空白组大鼠比较,模型组大鼠胃黏膜色泽呈灰白色,胃窦部褶皱减少,胃壁变薄,有明显的出血点;
与模型组大鼠比较,养阴活胃合剂低、中、高剂量组干预后大鼠胃黏膜色泽明显基本恢复正常,褶皱开始增多,胃壁厚度增加;
其中养阴活胃合剂中、高剂量组胃黏膜损伤改善效果更为明显。见图1。

图1 第18周各组大鼠胃黏膜形态观察比较
2.3 各组大鼠胃黏膜HE 染色病理结果与空白组大鼠比较,模型组大鼠胃窦组织细胞排列疏松紊乱,固有层腺体均有萎缩,黏膜层变薄可见充血,胃黏膜腺体存在肠化现象。与模型组大鼠比较,养阴活胃合剂低、中、高剂量组大鼠胃窦组织细胞排列恢复整齐,固有层腺体萎缩减轻,未见肠化生。见图2。

图2 各组大鼠胃黏膜HE染色病理图(×100)
2.4 各组大鼠胃内群落的组成及物种差异比较
2.4.1 各组大鼠胃内门(Phylum)水平物种丰度差异比较 与空白组比较,模型组有益菌拟杆菌门丰度显著降低,致病菌放线菌门丰度显著升高,差异有统计学意义(P<0.05)。与模型组比较,养阴活胃合剂中、高剂量组有益菌拟杆菌门丰度显著升高,致病菌放线菌门丰度显著降低,差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠胃内门水平物种丰度差异比较(±s,n=10)

表1 各组大鼠胃内门水平物种丰度差异比较(±s,n=10)
注:与空白组比较,*P<0.05;
与模型组比较,#P<0.05。
组别空白组模型组养阴活胃合剂低剂量组养阴活胃合剂中剂量组养阴活胃合剂高剂量组维酶素组变形菌门0.281±0.241 0.135±0.061 0.107±0.034 0.172±0.120 0.202±0.073 0.146±0.068厚壁菌门0.371±0.151 0.498±0.057 0.570±0.045 0.537±0.117 0.474±0.054 0.449±0.086拟杆菌门0.126±0.114 0.081±0.048*0.068±0.070 0.113±0.085#0.138±0.106#0.161±0.138放线菌门0.094±0.059 0.162±0.093*0.197±0.053 0.090±0.057#0.068±0.015#0.081±0.057
2.4.2 各组大鼠胃内纲(Class)水平物种丰度差异比较 与空白组比较,模型组致病菌梭状芽胞杆菌纲丰度显著升高,有益菌拟杆菌纲丰度显著降低,差异有统计学意义(P<0.05)。与模型组比较,养阴活胃合剂高剂量组有益菌拟杆菌纲丰度显著升高,差异有统计学意义(P<0.05)。见表2。
表2 各组大鼠胃内纲水平物种丰度差异比较(±s,n=10)
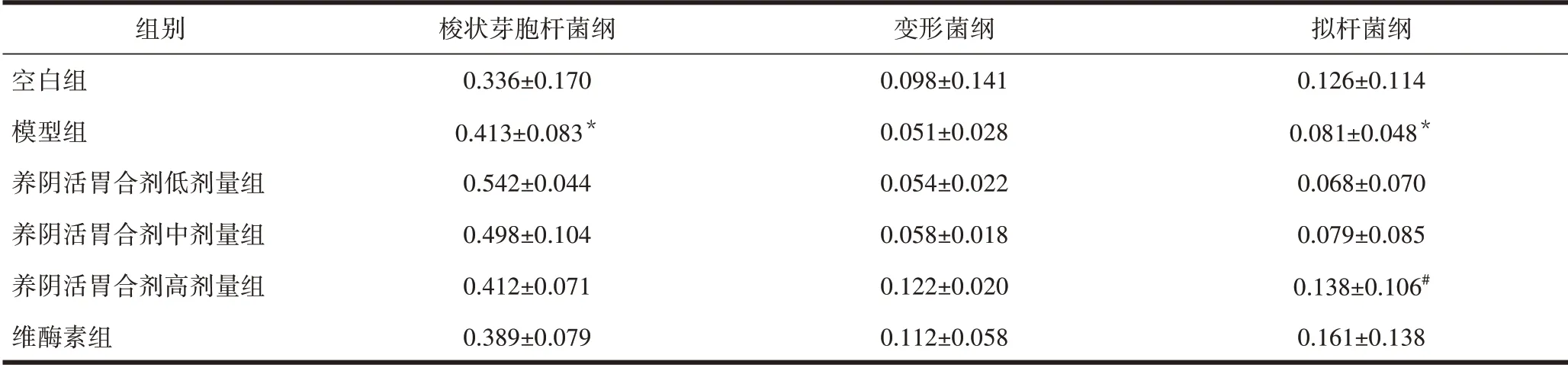
表2 各组大鼠胃内纲水平物种丰度差异比较(±s,n=10)
注:与空白组比较,*P<0.05;
与模型组比较,#P<0.05。
组别空白组模型组养阴活胃合剂低剂量组养阴活胃合剂中剂量组养阴活胃合剂高剂量组维酶素组梭状芽胞杆菌纲0.336±0.170 0.413±0.083*0.542±0.044 0.498±0.104 0.412±0.071 0.389±0.079变形菌纲0.098±0.141 0.051±0.028 0.054±0.022 0.058±0.018 0.122±0.020 0.112±0.058拟杆菌纲0.126±0.114 0.081±0.048*0.068±0.070 0.079±0.085 0.138±0.106#0.161±0.138
2.4.3 各组大鼠胃内目(Order)水平物种丰度差异比较 与空白组比较,模型组有益菌拟杆菌目丰度显著降低,差异有统计学意义(P<0.05)。与模型组比较,养阴活胃合剂低、中、高剂量组有益菌振螺目丰度显著升高,养阴活胃合剂中、高剂量组有益菌拟杆菌目丰度显著升高,差异有统计学意义(P<0.05)。见表3。
表3 各组大鼠胃内目水平物种丰度差异比较(±s,n=10)
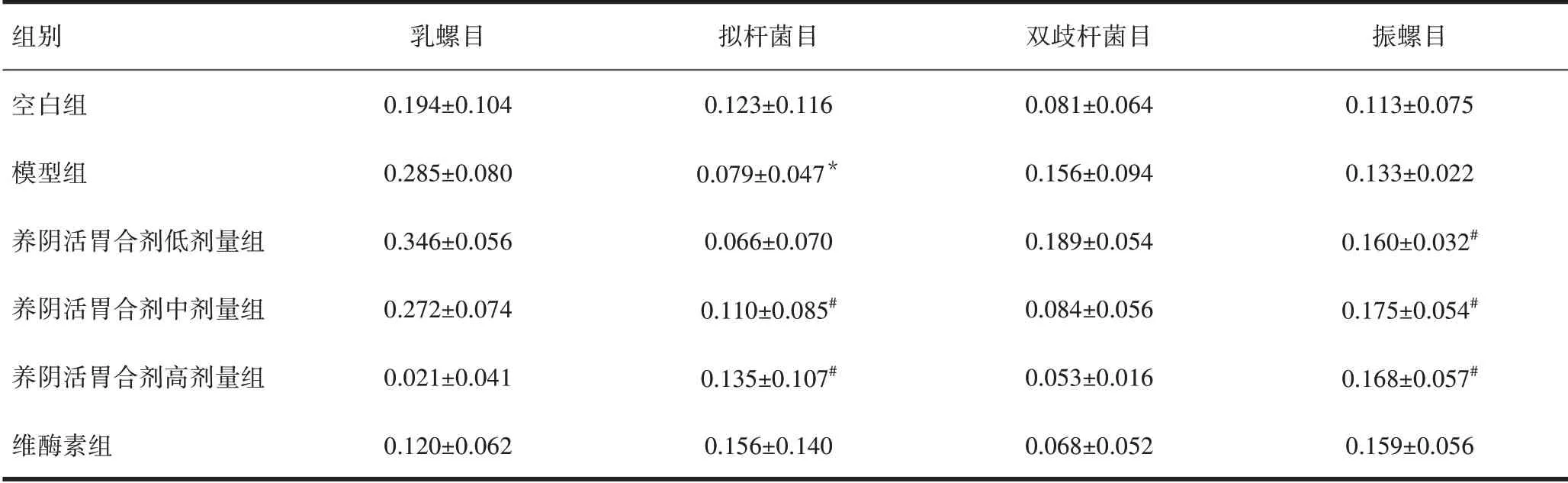
表3 各组大鼠胃内目水平物种丰度差异比较(±s,n=10)
注:与空白组比较,*P<0.05;
与模型组比较,#P<0.05。
组别空白组模型组养阴活胃合剂低剂量组养阴活胃合剂中剂量组养阴活胃合剂高剂量组维酶素组乳螺目0.194±0.104 0.285±0.080 0.346±0.056 0.272±0.074 0.021±0.041 0.120±0.062拟杆菌目0.123±0.116 0.079±0.047*0.066±0.070 0.110±0.085#0.135±0.107#0.156±0.140双歧杆菌目0.081±0.064 0.156±0.094 0.189±0.054 0.084±0.056 0.053±0.016 0.068±0.052振螺目0.113±0.075 0.133±0.022 0.160±0.032#0.175±0.054#0.168±0.057#0.159±0.056
2.4.4 各组大鼠胃内科(Family)水平物种丰度差异比较 与空白组大鼠比较,模型组有益菌瘤胃菌科丰度显著升高,差异有统计学意义(P<0.05)。与模型组比较,养阴活胃合剂低、高剂量组有益菌瘤胃菌科丰度显著升高,且低、中剂量组致病菌假单胞菌科丰度显著降低,差异有统计学意义(P<0.05)。见表4。
表4 各组大鼠胃内科水平物种丰度差异比较(±s,n=10)

表4 各组大鼠胃内科水平物种丰度差异比较(±s,n=10)
注:与空白组比较,*P<0.05;
与模型组比较,#P<0.05。
组别空白组模型组养阴活胃合剂低剂量组养阴活胃合剂中剂量组养阴活胃合剂高剂量组维酶素组毛螺菌科0.194±0.104 0.285±0.080 0.346±0.056 0.272±0.074 0.021±0.041 0.120±0.062普雷沃氏菌科0.057±0.055 0.048±0.042 0.041±0.053 0.048±0.037 0.088±0.090 0.091±0.104双歧杆菌科0.081±0.064 0.156±0.094 0.019±0.054 0.083±0.056 0.053±0.016 0.068±0.052瘤胃菌科0.070±0.044 0.099±0.020*0.125±0.025#0.099±0.027 0.120±0.052#0.110±0.042假单胞菌科0.052±0.074 0.030±0.019 0.028±0.015#0.027±0.010#0.065±0.013 0.062±0.036
2.4.5 各组大鼠胃内属(Genus)水平物种丰度差异比较 与空白组比较,模型组有益菌普雷沃氏菌属、拟杆菌属等丰度均显著降低,差异有统计学意义(P<0.05)。与模型组比较,养阴活胃合剂高剂量组有益菌普氏粪杆菌属丰度显著升高;
中、高剂量组有益菌拟杆菌属丰度显著升高,差异有统计学意义(P<0.05)。与模型组比较,养阴活胃合剂低、中剂量组致病菌假单胞菌属丰度显著降低。见表5。
表5 各组大鼠胃内属水平物种丰度差异比较(±s,n=10)

表5 各组大鼠胃内属水平物种丰度差异比较(±s,n=10)
注:与空白组比较,*P<0.05;
与模型组比较,#P<0.05。
组别空白组模型组养阴活胃合剂低剂量组养阴活胃合剂中剂量组养阴活胃合剂高剂量组维酶素组普雷沃氏菌属0.055±0.056 0.047±0.043*0.040±0.053 0.046±0.037 0.086±0.090 0.088±0.103双歧杆菌属0.081±0.064 0.156±0.095 0.190±0.054 0.083±0.056 0.053±0.016 0.068±0.052假单胞菌属0.053±0.074 0.030±0.019 0.028±0.015#0.027±0.010#0.065±0.013 0.062±0.036普氏粪杆菌属0.035±0.026 0.048±0.014 0.063±0.026 0.052±0.019 0.077±0.047#0.069±0.037拟杆菌属0.036±0.054 0.019±0.013*0.017±0.026 0.028±0.017#0.029±0.019#0.032±0.027布劳特氏菌属0.047±0.030 0.076±0.031 0.096±0.020 0.057±0.031 0.043±0.007 0.042±0.022
2.4.6 LEfSe 多级物种差异判别分析 与空白组比较,模型组富集了丹毒丝菌属等致病菌;
与模型组比较,养阴活胃合剂低剂量组富集毛螺菌科、双歧杆菌目等有益菌;
养阴活胃合剂高剂量组富集肠杆菌目等有益菌;
其中养阴活胃合剂中剂量组无丰度优势物种,故此组缺失。见图3。

图3 LEfSe多级物种差异图
胃内菌群与CAG 的发生、发展关系密切[14]。胃内菌群中有益菌群是维持胃内环境正常的重要因素[15]。CAG 患者与健康人群胃内微生物菌群的组成和分布特征存在差异,CAG 的发病会引起变形菌等致病菌的丰度升高,而普雷沃氏菌等有益菌的丰度降低,导致胃内菌群稳态遭到破坏[16-17]。
中医学中CAG 属于“痞满”“胃脘痛”“呃逆”等范畴。病因多由于饮食、情志、外邪等因素影响脾胃纳运功能[18],病机主要是由于“虚”和“瘀”交叉影响[19]。养阴活胃合剂是继承整理第五批国家名老中医专家曾斌芳教授的经验方,组方思想来源于张锡纯所著《医学衷中参西录》中记载的“鸡胵茅根汤”[20-21];
精选芦根、鸡内金、莪术、茯苓、白术、牡丹皮、乌贼骨、旋覆花、炙远志、砂仁、炙甘草等药材组成[22-23]。
本课题组前期基础研究证实养阴活胃合剂促进胃黏膜细胞修复及保护胃黏膜,在临床上该组方不仅改善临床症状、还可以逆转胃黏膜病理状态、减轻炎症反应[24-25]。本研究结果发现胃内菌群稳态失调时会引起CAG 的发生、发展,与空白组比较,模型组变形菌、放线菌等致病菌丰度升高;
与模型组比较,养阴活胃合剂低、中、高剂量干预后,降低了致病菌丰度如放线菌等,升高了有益菌丰度如振螺菌等,调节了有益菌与致病菌丰度水平,并维持了胃内微生物菌群稳态,促进了胃肠道正常生理功能的恢复。
综上所述,养阴活胃合剂治疗CAG 的作用机制与其调节胃内微生物菌群稳态有关。但本研究只检测了丰度排名前十的胃内菌群,未检测其余对CAG有影响的其他菌群,今后的研究,应开展大样本、多菌群的检测,以期为中医药治疗CAG 提供更多依据与思路。
猜你喜欢 合剂有益菌杆菌 胸痹合剂治疗冠心病心绞痛的临床研究医学概论(2022年3期)2022-04-24rpoB、gyrA、cheA基因在芽孢杆菌鉴定上的应用浙江农业学报(2022年1期)2022-02-18转基因植物历史悠久大自然探索(2020年1期)2020-02-16如何保护肠道有益菌?食品与健康(2019年2期)2019-02-15中小型养殖场畜禽粪便处理技术湖北畜牧兽医(2017年9期)2017-09-21阴道乳杆菌主要种群异同与健康上海预防医学(2017年8期)2017-09-06畜牧业中4种常用有益菌浓度与吸光度的关系江苏农业科学(2016年7期)2016-10-20果树使用石硫合剂须“四当”果农之友(2014年2期)2014-10-21改善水体和生物肠道菌群结构的菌剂及其在罗非鱼养殖中的应用江苏农业科学(2014年4期)2014-07-11果树使用石硫合剂小技法农家科技(2011年3期)2011-06-13本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0426/589531.html




