【www.zhangdahai.com--其他范文】
黄 爽,陈 琛,黄 波
(贵州省遵义市第一人民医院 遵义医科大学第三附属医院儿童重症医学科,贵州 遵义 563000)
儿童肥胖是目前面临的最为严峻的全球性健康问题之一,其主要特征为脂肪量增加、脂质代谢失调和肠道菌群失衡。儿童肥胖往往会持续到成年期,是患高血压、高血脂、哮喘、2型糖尿病和心血管疾病等的主要危险因素[1-2]。因此,减少儿童肥胖是一个重要的公共健康目标,然而现有的抗肥胖药物疗效有限,并伴有严重的不良反应,不建议儿童服用。导致儿童肥胖的因素很多,不同类型的肥胖,其致病因素也有所不同。高脂肪饮食是导致儿童营养性肥胖的重要因素之一,同时肠道菌群在高脂肪饮食诱导的肥胖和代谢疾病中起着重要作用,肠道微生物组成可能随着肥胖的发展而改变[3]。研究[4]显示:高脂肪饮食可改变拟杆菌门和厚壁菌门的比例,导致肥胖和其他代谢紊乱的发生。中药对肠道菌群失衡和脂质代谢紊乱具有良好的调控作用[5]。柠檬苦素广泛存在于柑橘类水果中,是一种三萜苷元衍生物,具有多种药理学功效,包括抗癌、抗炎、抗菌和抗病毒等活性。此外,柠檬苦素还有降血脂和抗糖尿病的功效[6]。研究[7]显示:口服柠檬苦素后小鼠肠道拟杆菌门和变形杆菌门的相对丰度明显增加,而双歧杆菌属的相对丰度明显降低,肠道菌群结构明显改善。但柠檬苦素对营养性肥胖幼鼠脂质代谢及肠道菌群的调控作用目前尚不清楚。本研究通过构建高脂饮食诱导的营养性肥胖幼鼠模型,探讨柠檬苦素对营养性肥胖大鼠脂质代谢和肠道菌群的影响,以期为缓解高脂饮食引起的营养性肥胖提供新的潜在治疗药物。
1.1 实验动物、主要试剂和仪器 SD大鼠85只,雄性,3周龄(刚断乳),体质量45~55 g,由遵义医科大学动物实验中心提供,动物生产许可证号:SCXK(黔)2021-0002。大鼠饲养在SPF级动物实验室内(温度22℃~24℃,相对湿度55%~60%,12 h光照-黑暗循环),可自由饮水和进食。柠檬苦素(纯度>90%)购于美国Merck公司,普通饲料和高脂饲料均购自广东省医学实验动物中心,QlAamp DNA Stool Mini Kit和SYBR Green PCR Kit均购自德国Qiagen公司,TaKaRa Ex Taq购自日本TaKaRa Bio公司,MiSeq试剂盒购自美国Illumina公司。AU5800全自动生化分析仪购自美国Beckman公司,RM2235手动旋转式切片机购自德国Leica公司,BX53生物显微镜购自日本Olympus公司,NanoDrop 2000紫外可见分光光度计购自美国Thermo公司。
1.2 实验动物模型制备和动物分组 85只3周龄SD大鼠随机分为普通饲料组(15只)和高脂饲料组(70只),其中普通饲料组幼鼠给予普通饲料喂养(玉米28.0%、酵母1.8%、面粉15.0%、油脂1.2%、麸皮16.0%、石粉1.0%、豆粕11.0%、碳酸氢钙1.2%、鱼粉12.0%、复合维生素2.0%、苜蓿10.0%和微量元素0.8%),高脂饲料组幼鼠给予高脂饲料喂养(普通饲料51.9%、猪油15.0%、胆盐0.2%、蔗糖20.0%、碳酸氢钙1.0%、酪蛋白10.0%、石粉0.5%、胆固醇1.2%和盐0.2%),自由饮水,持续喂养4周。4周后以超出普通饲料组大鼠体质量20%作为营养性肥胖大鼠造模成功标准[8],共筛选出营养性肥胖大鼠46只,随机选取造模成功的大鼠40只分为模型组和低、中及高剂量柠檬苦素组,每组10只,从普通饲料组随机选取10只大鼠作为对照组。低、中和高剂量柠檬苦素组大鼠分别给予12.5、25.0和50.0 mg·kg-1柠檬苦素灌胃,其他组大鼠均给予等量媒介(1.0%吐温+0.5%CMC-Na的水溶液)灌胃,每日1次,连续灌胃4周。给药全程,对照组大鼠给予普通饲料喂养,其他组大鼠继续给予高脂饲料喂养。实验结束后,大鼠禁食12 h,收集每只大鼠新鲜粪便于2 mL无菌试管中,-80℃保存,用于后续实验分析。各组大鼠腹主动脉采血,取血后乙醚麻醉处死大鼠并解剖取材。
1.3 测量各组大鼠体质量、计算李氏(Lee’s)指数和脂肪系数 给药前后称量并记录各组大鼠体质量。处死大鼠后测量各组大鼠从鼻至肛门的长度,即为体长,然后打开大鼠腹腔,取体内脂肪(肾周、附睾旁和肠系膜周围脂肪)称质量,根据参考文献[9]中的方法计算Lee’s指数和脂肪系数。
1.4 各组大鼠血脂水平检测 大鼠血液样本4℃、3 000 g离心15 min,收集血清。采用AU5800全自动生化分析仪检测大鼠血清中总胆固醇(total cholesterol,TC)、甘油三酯 (triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)水平。
1.5 HE染色观察各组大鼠肝组织病理形态表现 取大鼠肝脏组织用生理盐水冲洗干净,10%甲醛固定24 h,石蜡包埋,采用手动旋转切片机将组织切成4 μm厚的薄片,分别使用苏木精和伊红染色,光学显微镜下观察各组大鼠肝组织病理形态表现和脂肪沉积情况。
1.6 采用16S rRNA测序技术检测各组大鼠粪便中肠道菌群结构 取适量大鼠粪便,采用QlAamp DNA Stool Mini Kit从各组大鼠粪便中提取DNA,采用紫外可见分光光度计测定DNA的浓度并纯化,1%琼脂糖凝胶电泳检测DNA质量。利用TaKaRa Ex Taq对16S rRNA基因的V3-V4高变区进行PCR扩增。引物序列:正向引物5′-ACTCCTACGGGAGGCAGAC-3′, 反 向 引 物 5′-GGACTACTAGGGTATCTAAT-3′;
PCR 反应体系 (50 μL):TaKaRa Ex Taq 1 μL, 10×Ex Taq buffer 5 μL,MgCl24 μL,dNTP 4 μL,DNA模板 2 μL,正向引物 (10 μmol·L-1) 和反 向 引 物 (10 μmol·L-1) 各2 μL,H2O 30 μL。PCR反应程序 :95 ℃ 预 变 性3 min;
95℃变性30 s,55℃退火30 s,72℃延伸45 s,27个循环;
72℃延伸10 min。扩增后的PCR产物经2%琼脂糖凝胶电泳检测,切胶回收目的片段。回收产物采用SYBR Green PCR Kit通过实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法进行定量分析,采用MiSeq试剂盒制备含有每个样品2 μL的混合物,生成混合库,送至北京诺禾致源有限公司进行MiSeq PE300双端测序。按照97%的相似性阈值将序列划分为不同的操作分类单元(operational taxonomic units,OTUs),选取OTUs的代表性序列,采用Qiime vl.8.0软件进行OTU聚类和物种注释,比较各组大鼠肠道菌群的物种多样性和物种相对丰度。
1.7 统计学分析 采用SPSS 22.0统计软件进行统计学分析。各组大鼠体质量、Lee’s指数、脂肪系数、血脂水平和肠道菌群相对丰度均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准为α=0.05。
2.1 各组大鼠体质量 药物干预前,与对照组比较,模型组及低、中和高剂量柠檬苦素组大鼠体质量明显增加(P<0.05);
与模型组比较,低、中和高剂量柠檬苦素组大鼠体质量差异均无统计学意义(P>0.05)。药物干预后,与对照组比较,模型组大鼠体质量明显增加(P<0.05);
与模型组比较,中和高剂量柠檬苦素组大鼠体质量均明显降低(P<0.05),而低剂量柠檬苦素组大鼠体质量差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠体质量Tab.1 Body weights of rats in various groups(n=10,±s,m/g)
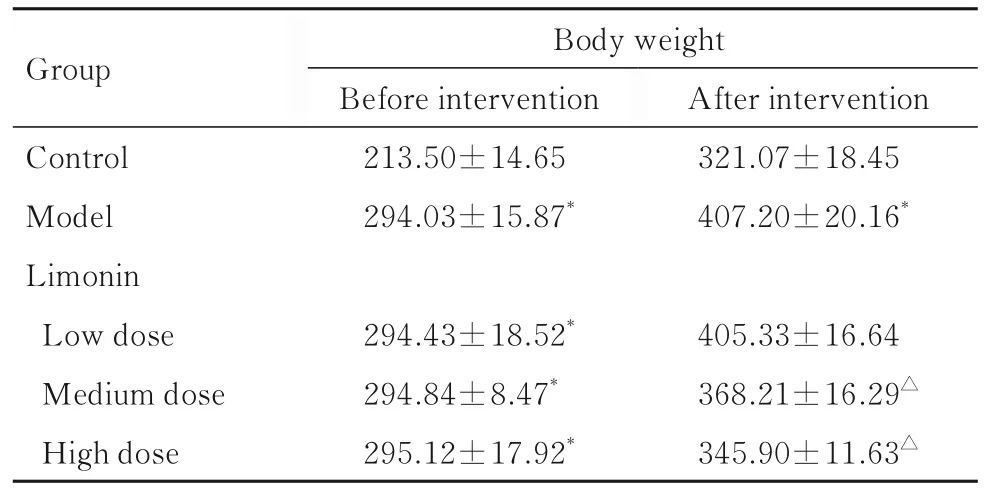
表1 各组大鼠体质量Tab.1 Body weights of rats in various groups(n=10,±s,m/g)
*P<0.05 vs control group;
△P<0.05 vs model group.
Group Control Model Limonin Low dose Medium dose High dose Body weight Before intervention 213.50±14.65 294.03±15.87*After intervention 321.07±18.45 407.20±20.16*405.33±16.64 368.21±16.29△345.90±11.63△294.43±18.52*294.84±8.47*295.12±17.92*
2.2 各组大鼠Lee’s指数和脂肪系数 与对照组比较,模型组大鼠Lee’s指数和脂肪系数均明显升高(P<0.05);
与模型组比较,中和高剂量柠檬苦素组大鼠Lee’s指数和脂肪系数均明显降低(P<0.05),而低剂量柠檬苦素组大鼠Lee’s指数和脂肪系数差异均无统计学意义(P>0.05)。见表2。
表2 各组大鼠Lee’s指数和脂肪系数Tab.2 Lee’s indexes and adipose coefficients of rats in various groups (n=10,±s)
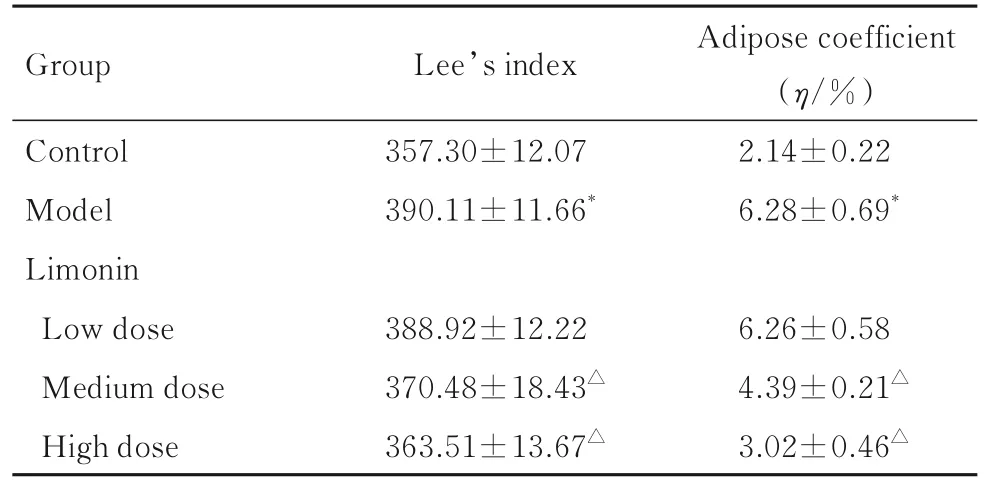
表2 各组大鼠Lee’s指数和脂肪系数Tab.2 Lee’s indexes and adipose coefficients of rats in various groups (n=10,±s)
*P<0.05 vs control group;
△P<0.05 vs model group.
Group Lee’s index Control Model Limonin Low dose Medium dose High dose 357.30±12.07 390.11±11.66*Adipose coefficient(η/%)2.14±0.22 6.28±0.69*6.26±0.58 4.39±0.21△3.02±0.46△388.92±12.22 370.48±18.43△363.51±13.67△
2.3 各组大鼠血清中TC、TG、LDL-C和HDL-C水平 与对照组比较,模型组大鼠血清中TC、TG和 LDL-C水平均明显升高 (P<0.05),HDL-C水平明显降低(P<0.05);
与模型组比较,中和高剂量柠檬苦素组大鼠血清中TC、TG和LDL-C水平均明显降低(P<0.05),HDL-C水平明显升高(P<0.05),低剂量柠檬苦素组大鼠血清中TC、TG、LDL-C和HDL-C水平差异均无统计学意义(P>0.05)。见表3。
表3 各组大鼠血清中TC、TG、LDL-C和HDL-C水平Tab.3 Levels of TC,TG,LDL-C and HDL-C in serum of rats in various groups[n=10,±s,cB/(mmol·L-1)]

表3 各组大鼠血清中TC、TG、LDL-C和HDL-C水平Tab.3 Levels of TC,TG,LDL-C and HDL-C in serum of rats in various groups[n=10,±s,cB/(mmol·L-1)]
*P<0.05 vs control group;
△P<0.05 vs model group.
Group Control Model Limonin Low dose Medium dose High dose TC 1.32±0.11 2.78±0.16*TG 0.48±0.05 1.22±0.07*LDL-C 0.37±0.03 0.91±0.06*HDL-C 0.61±0.07 0.23±0.03*0.24±0.03 0.40±005△0.56±0.04△2.76±0.11 1.83±0.10△1.55±0.14△1.23±0.06 0.74±0.05△0.53±0.09△0.90±0.08 0.62±0.07△0.44±0.05△
2.4 各组大鼠肝组织病理形态表现 与对照组比较,模型组和低剂量柠檬苦素组大鼠肝细胞大小不匀,排列不规整,细胞内可见大小不等的脂肪变性空泡;
与模型组比较,中和高剂量柠檬苦素组大鼠肝细胞排列较规整,脂肪变性明显减轻。见图1。

图1 各组大鼠肝组织病理形态表现(HE,×400)Fig.1 Pathomorphology of liver tissue of rats in various groups(HE,×400)
2.5 各组大鼠粪便中肠道菌群门水平相对丰度 门水平上,大鼠肠道菌群中主要包含厚壁菌门(Firmicutes)、拟杆菌门 (Bacteroidetes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)等。与对照组比较,模型组大鼠粪便中厚壁菌门相对丰度明显升高(P<0.05),拟杆菌门相对丰度明显降低(P<0.05);
与模型组比较,中和高剂量柠檬苦素组大鼠粪便中厚壁菌门相对丰度明显降低(P<0.05),拟杆菌门相对丰度明显升高(P<0.05),低剂量柠檬苦素组大鼠粪便中肠道菌群门水平上相 对丰度差异无统计学意义(P>0.05)。见图2。
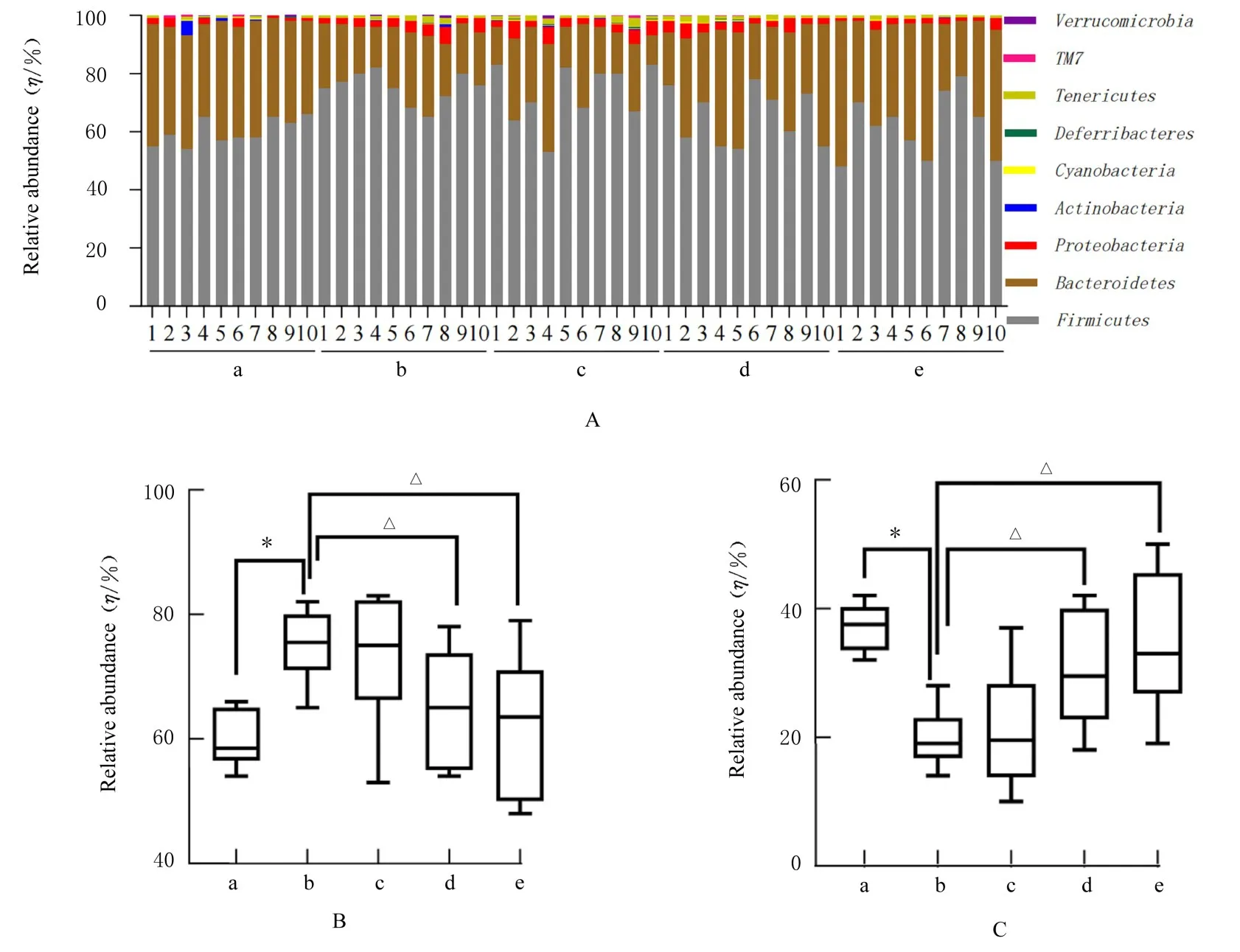
图2 各组大鼠肠道菌群门水平的结构Fig.2 Structures of intestinal microbiota of rats in various groups at phylum level
2.6 各组大鼠粪便中肠道菌群属水平相对丰度 属水平上,大鼠肠道菌群中主要包含乳杆菌属(Lactobacillus)、颤螺旋菌属(Oscillospira)、瘤胃球菌属(Ruminococcus)、Odoribacter、拟杆菌属(Bacteroides)和普氏菌属(Prevotella)等。与对照组比较,模型组大鼠粪便中颤螺旋菌属相对丰度明显升高(P<0.05),乳杆菌属相对丰度明显降低(P<0.05)。与模型组比较,中和高剂量柠檬苦素组大鼠粪便中颤螺旋菌属相对丰度明显降低(P<0.05),乳杆菌属相对丰度明显升高(P<0.05),低剂量柠檬苦素组大鼠粪便肠道菌群属水平上相对丰度差异无统计学意义(P>0.05)。见图3。
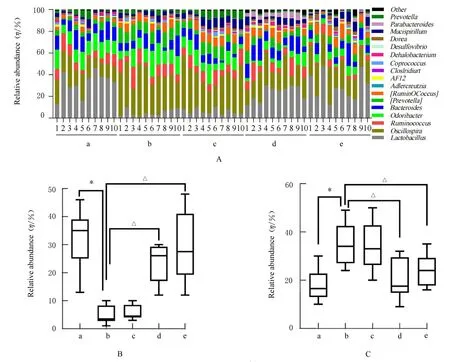
图3 各组大鼠肠道菌群属水平的结构Fig.3 Structures of gut microbiota of rats in various groups at genus level
儿童肥胖是一种由能量不平衡引起的慢性代谢紊乱,可导致体内脂肪堆积现象的发生。儿童肥胖的表现是体质量与身高之间的平衡被破坏,该损害是由遗传因素、饮食习惯、体育活动和激素水平改变等引起的[10-11]。研究[12]表明:高脂饮食是导致儿童肥胖的重要因素之一,过多的能量摄入会导致儿童肝脏受损,体内脂质代谢失调,脂肪堆积,从而引起肥胖,严重威胁儿童的身体健康[13-14]。因此,控制和预防儿童肥胖是一个值得广泛关注的重要公共健康问题。目前,减肥药对控制体质量有一定的效果,但其对身体也会产生明显的不良反应,且有体质量反弹的风险[15]。因此,迫切需要寻找预防儿童肥胖的有效药物。
柠檬苦素是一种天然的四环三萜类化合物,其通常来源于芸香科和楝科植物,可从多种中药和水果中分离得到,柠檬苦素在柑橘类水果中含量很高[16]。柠檬苦素具有广泛的药理学作用,包括抗癌、抗炎、镇痛、抗菌、抗病毒、抗氧化、保护肝脏和降低血脂等[17-18]。本研究通过高脂饮食建立营养性肥胖大鼠模型,结果显示:模型组大鼠体质量、Lee’s指数和脂肪系数均明显升高,血清中TC、TG和LDL-C水平均明显升高,HDL-C水平明显降低,肝脏中有脂肪堆积和脂肪变性,表明营养性肥胖大鼠模型构建成功;
柠檬苦素干预后大鼠体质量、Lee’s指数和脂肪系数均明显降低,血清中血脂水平失调和肝脏中脂肪堆积情况均明显改善,说明柠檬苦素可调节营养性肥胖大鼠体内脂质代谢,改善肥胖。
肠道菌群在肠道中对物质分解、吸收和营养物质转化起着重要的生理作用。研究[19]表明:肥胖等代谢性疾病与肠道菌群失衡有明显相关性。FAVA等[20]研究发现:高脂饮食可导致人体内肠道菌群结构发生改变,一些正常优势菌群减少甚至消失。某些细菌类群与脂质代谢有关,其修饰可能影响宿主的脂质代谢和信号分子的表达[21]。有研究[22]显示:拟杆菌门和厚壁菌门的比例通常与肥胖有关,拟杆菌门/厚壁菌门比率的下降与高脂饮食诱导的肥胖小鼠肠道菌群失调有关。此外,双歧杆菌和乳酸杆菌等肠道益生菌相对丰度的下降可能与小鼠体内糖脂代谢水平的变化有关[23]。因此,在肥胖和肥胖相关疾病的治疗中,肠道微生物群是一个潜在的营养和药理靶点。然而,柠檬苦素对营养性肥胖大鼠体内肠道菌群结构的调控作用尚不清楚。16S rRNA测序是检测肠道菌群结构常用的方法,采用针对相邻保守区域的引物来扩增16S rRNA基因高度可变的区域,然后通过MiSeq测序和Qiime分析来比较各组大鼠粪便中肠道菌群结构。本研究采用16S rRNA测序法探讨柠檬苦素对营养性肥胖大鼠肠道菌群的影响,结果显示:在门水平上,高脂饮食可提高厚壁菌门相对丰度,降低拟杆菌门相对丰度。为进一步探讨各样本间的差异,本研究对大鼠肠道菌群进行属级分析,在属水平上,高脂饮食可提高颤螺旋菌属相对丰度,降低乳杆菌属相对丰度,而柠檬苦素干预后大鼠肠道菌群结构趋于正常水平。因此,柠檬苦素对大鼠肠道菌群失调有明显的改善作用。
综上所述,柠檬苦素干预可调节高脂饮食诱导的营养性肥胖大鼠脂质代谢紊乱和肠道菌群失调,降低大鼠体质量、血脂水平和脂肪堆积,从而改善大鼠肥胖。本研究为柠檬苦素作为一种生物活性成分在改善儿童肥胖中的应用提供了理论依据。
猜你喜欢 高脂菌群柠檬 从畜禽粪便菌群入手 降低抗生素残留造成环境风险今日农业(2022年14期)2022-09-15发酵桂闽引象草替代部分日粮对鸡肠道菌群的影响中国饲料(2022年5期)2022-04-26小柠檬小学生优秀作文(低年级)(2021年10期)2021-11-24旧柠檬扬子江(2020年4期)2020-08-04自制柠檬汽水家教世界·创新阅读(2020年3期)2020-04-29吃高脂鱼类可防癌家庭科学·新健康(2019年7期)2019-08-21忠实的柠檬青少年日记·小学生版(2017年7期)2018-03-07细菌群落的“资源共享”百科知识(2017年10期)2017-05-19出生环境影响肠道菌群百科知识(2017年3期)2017-03-17鱼油可减轻高脂饮食的危害中国新闻周刊(2016年33期)2016-10-27本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0427/590173.html




