【www.zhangdahai.com--其他范文】
吴文洁,刘陈,刘黎明,戴玉豪,符国成,龚小兵,陈海刚*,李韶菁*
1.安徽中医药大学,安徽 合肥 230000;
2.中国中医科学院 中药研究所,北京 100010;
3.华润三九(郴州)制药有限公司,湖南 郴州 423000
复方感冒灵颗粒(compound Ganmaoling granules,CGG)是由中药(traditional Chinese medicine,TCM)和化学药(chemical medicine,CM)配伍组成的复方制剂,其中中药部分有山银花、五指柑、野菊花、三叉苦、南板蓝根、岗梅6 味中药;
化学药部分则有马来酸氯苯那敏、咖啡因、对乙酰氨基酚3 种[1]。该复方制剂具有辛凉解表、清热解毒的功能,用于风热感冒及温病之发热、微恶风寒、头身痛、口干而渴、鼻塞涕浊、咽喉红肿疼痛、咳嗽、痰黄黏稠。其临床用于治疗感冒引起的头痛、发热、鼻塞、流涕、咽痛等上呼吸道感染疾病。
本课题组基于网络药理学对体内暴露的中药成分进行分析,构建了CGG 成分-靶点-通路-功效的关联网络,发现其中药成分核心靶点对应的功效为解热、抗炎与抗病毒。为进一步验证其功效,本课题组对CGG 进行与流行性感冒相关的体内外抑菌、抗病毒、解热、抗炎等实验研究,评价并比较CGG 全方、CM 组、TCM 组的药效作用,为CGG 治疗感冒的临床用药提供参考。
1.1 试药
马来酸氯苯那敏(批号:C015-190414,纯度:99%)、咖啡因(批号:1012004405,纯度:98%)、对乙酰氨基酚(批号:202007119A,纯度:99%)均购自中国食品药品鉴定研究院;
药材山银花(批号:20201001,产地湖南)、野菊花(批号:20201001,产地安徽)、岗梅(批号:20201002,产地广东)、三叉苦(批号:20201002,产地广西)、五指柑(批号:20201002,产地广西)、南板蓝根(批号:20201002,产地广西)经中国中医科学院中药研究所李韶菁研究员鉴定,均符合《中华人民共和国药典》2020 年版项下规定;
CGG 流膏(批号:Z2012122)和CGG 成品(批号:2105062N)均由华润三九(郴州)制药有限公司提供;
磷酸奥司他韦胶囊(批号:M1046,上海罗氏制药有限公司);
盐酸莫西沙星片(批号:BJ51319,拜耳医药保健有限公司);
阿司匹林维生素C 泡腾片(批号:BT11AV21,拜耳医药保健有限公司启动分公司);
布洛芬颗粒(批号:2003611,哈药集团世一堂制药厂);
营养琼脂培养基(批号:20190418)、营养肉汤培养基(批号:20190516)均购自北京奥博星生物技术有限责任公司;
高活性干酵母(批号:20190102,安琪酵母股份有限公司);
巴豆油(批号:C10936730,上海麦克林生化科技有限公司);
无水乙醇(批号:20181210)、乙醚(AR,纯度≥99.5%,批号:20181009)均购于国药集团化学试剂有限公司;
无菌水(批号:R1600,北京索莱宝科技有限公司);
Watsons纯净水(批号:20200102,广州市屈臣氏有限责任公司);
RNAeasy™病毒RNA抽提试剂盒(批号:113020210318,上海碧云天生物技术有限公司)。
1.2 实验动物
无特定病原体(SPF)级ICR 小鼠380 只,体质量13~15、14~16、18~20 g,雌雄各半;
SPF 级SD大鼠60只,体质量180~200 g,雌雄各半;
均由北京维通利华实验动物技术有限公司提供,动物生产许可证号:SCXK(京)2016-0006;
实验动物的使用在中国中医科学院中药研究所动物中心[实验动物使用许可证号:SYXK(京)2015-0041]进行。抗病毒、抑菌实验动物饲养于ABSL-2 级生物安全室,其他实验动物饲养于屏障环境。实验方案实施前获得中国中医科学院中药研究所实验动物管理和使用委员会的审核与批准,批准号:2021B193。
1.3 菌株
甲型流感病毒鼠肺适应株FM1,购自中国预防医学科学院病毒学研究所,本实验室传代后保存于-80℃冰箱备用。金黄色葡萄球菌标准株26112-9、肺炎链球菌标准株31001-9a1、乙型溶血性链球菌标准株CMCC(B)32210-5a2-238 购自中国食品药品检定研究院中国医学细菌保藏管理中心。
1.4 仪器
-80 ℃超低温冰箱(中国海尔集团公司);
XSP-9CA型显微镜(上海光学仪器一厂);
7 X1型实验室用打孔器(长征化学试剂公司);
AL104 型万分之一电子天平[梅特勒-托利多科技(中国)有限公司];
MC-347型电子体温计(欧姆龙健康医疗中国有限公司);
JC-WGZ-2XJ(P)型细菌浊度计(青岛聚创时代环保技术有限公司);
ABI 7500型实时荧光定量聚合酶链式反应(PCR)仪(赛默飞世尔科技中国有限公司);
HT190R 型离心机(湖南湘仪实验室仪器开发有限公司)。
2.1 剂量设计
CGG 的临床用量为一次14 g(含原药材25 g;
含对乙酰氨基酚168 mg、咖啡因12 mg、马来酸氯苯那敏2.68 mg),一日3 次,即日用量为42 g。CM药部分为对乙酰氨基酚-咖啡因-马来酸氯苯那敏(168∶12∶2.68)比例纯水混合均匀。TCM 部分称取金银花74 g、五指柑296 g、野菊花221 g、三叉苦371 g、南板蓝根221 g、岗梅596 g,加水煎煮2次,第1 次加药材4 倍量的纯净水,煎煮2 h,第2次加药材3 倍量的纯净水,煎煮1.5 h,合并煎液,滤过,滤液浓缩至适量,加乙醇至体积分数为60%~65%,搅匀,静置,滤过,滤液浓缩成稠膏,后期按照实验动物等效剂量以纯水稀释灌胃。
按实验动物与人体表面积比等效剂量折算,小鼠等效剂量的2 倍折合为CGG 10.92 g·kg-1(以临床用量一次14 g 计)、TCM 19.50 g·kg-1(以原药材25 g 计)、CM(对乙酰氨基酚、咖啡因、马来酸氯苯那敏分别为131.04、9.36、2.09 mg·kg-1);
大鼠等效剂量的2 倍折合为CGG 7.56 g·kg-1(以临床用量一次14 g 计)、TCM 13.50 g·kg-1(以原药材25 g计)、CM(对乙酰氨基酚、咖啡因、马来酸氯苯那敏分别为90.72、6.48、1.45 mg·kg-1)。体外实验以无菌水配制成质量浓度为1000 mg·mL-1的CGG、CM、TCM 组药样,隔水煮10 min 灭菌,上清液经0.22µm过滤器滤过。
磷酸奥司他韦胶囊成人每次75 mg,每日2 次,连续服用5 d,按实验动物与人体表面积比进行折算,小鼠临床等效剂量的2 倍为39 mg·kg-1。盐酸莫西沙星片临床日用量为0.5 g,按实验动物与人体表面积比等效剂量折算,小鼠等效剂量的2 倍为0.104 g·kg-1。阿司匹林维生素C 泡腾片临床日用量不超过1.6 g,按实验动物与人体表面积比等效剂量折算,大鼠等效剂量为的2倍折合为0.144 g·kg-1。布洛芬颗粒临床日用量不超过0.8 g,按实验动物与人体表面积比等效剂量折算,小鼠等效剂量的2 倍为0.21 g·kg-1。
2.2 流感病毒实验
2.2.1 对流感病毒致小鼠病毒性肺炎的影响 取健康SPF 级ICR 小鼠60 只,体质量13~15 g,随机分为对照组、模型组、CGG 组、CM 组、TCM 组、阳性药磷酸奥司他韦胶囊组,每组10 只,雌雄各半。除对照组外,其余各组小鼠以乙醚吸入轻度麻醉,用流感病毒鼠肺适应株FM1 溶液(0.05 mL/只)滴鼻感染小鼠,制备小鼠流感病毒性肺炎模型。感染当天开始各组分别灌胃给药,对照组和模型组灌胃给予同体积的纯净水(按体质量计20 mL·kg-1),每天1 次,连续给药5 d。第6 天称小鼠体质量后,乙醚吸入麻醉,解剖,摘取肺称质量,置于无菌无RNA 酶的离心管中,冻存于液氮中。分别按公式(1)和(2)计算肺指数和肺指数抑制率,结果采用组间比较t检验进行统计学处理。

基于美国国家生物技术信息中心(NCBI)和PrimerBank 数据库获得流感病毒H1N1 基因序列的上下游引物分别是5′-GACCAATCCTGTCAC CTCTGAC-3′和5′-GGGCATTTGGACAAACGTCT ACG-3′。称取同质量的不同组肺组织后,使用RNAeasy™病毒RNA 抽提试剂盒提取肺组织样品中病毒RNA,采用反转录-聚合酶链反应(RT-PCR)方法扩增,检测各组提取的病毒RNA 扩增后的病毒载量,即每微升互补脱氧核糖核酸(cDNA)的拷贝数。
2.2.2 对流感病毒感染致小鼠死亡的影响 取健康SPF级ICR小鼠170只,雌雄各半,体质量13~15 g,随机分为对照组(20 只)、模型组、CGG 组、CM组、TCM 组、阳性药磷酸奥司他韦胶囊组,每组30只,雌雄各半。除对照组外,其余各组小鼠以乙醚吸入轻度麻醉,用流感病毒鼠肺适应株FM1 溶液(0.05 mL/只)滴鼻感染小鼠,对照组滴鼻0.9%氯化钠溶液。感染当天开始灌胃给药,对照组和模型组灌胃给予同体积纯净水(20 mL·kg-1),每天1次,连续5 d。观察14 d内小鼠死亡情况,记录小鼠存活时间,按公式(3)~(5)计算小鼠存活时间延长率、死亡率及死亡抑制率。小鼠存活时间以t检验进行组间比较,死亡率以χ2检验进行组间比较。

2.3 抑菌实验
2.3.1 体内抑菌实验 取健康SPF 级ICR 小鼠100只,体质量14~16 g,随机分为模型组、CGG组、CM组、TCM组、阳性药盐酸莫西沙星片(104 mg·kg-1)组,每组20 只,雌雄各半。将增菌18 h 的金黄色葡萄球菌临床分离株,比浊至1.2×109个/mL,再以5%的酵母稀释100 倍。感染前2 d 各组分别灌胃给予相应药物,模型组灌胃给予相同体积的纯净水(按体质量计20 mL·kg-1),每天1 次,连续5 d。给药第3 天腹腔注射金黄色葡萄球菌(0.5 mL/只)造模。于感染24 h 起至感染后72 h 观察记录动物死亡情况,并按公式(5)计算死亡抑制率,以χ2检验进行统计学处理。
2.3.2 体外抑菌和杀菌实验 实验前1 d 将金黄色葡萄球菌、肺炎链球菌、乙型溶血性链球菌分别接种于肉汤培养基中增菌培养16 h 过夜。实验时在96孔细胞培养板中,先加肉汤培养基100 μL/孔。于各板第1行分别加CGG、CM、TCM组药样100 μL/孔,混匀,每孔分别吸取100 μL 下移第2 行,同样混匀下移,如此反复,稀释至5个质量浓度,分别为500、250、125、62.5、31.25 mg·mL-1。平行做阳性对照药盐酸莫西沙星片(质量浓度为4 mg·mL-1)及不加菌的药样对照及培养基对照。将过夜增菌后的各细菌比浊至麦氏1号管(3.0×108个/mL),稀释100倍后,分别吸取10 μL 加入培养基对照组、CGG 组、CM组、TCM 组、阳性药盐酸莫西沙星组。向各板中补加肉汤100 μL/孔。将各板置于37 ℃培养24 h 后,观察每组金黄色葡萄球菌、肺炎链球菌、乙型溶血性链球菌生长状况,无细菌生长的药物最低浓度管,即为最低抑菌浓度(MIC)。从MIC 孔中分别吸取5 μL 转种于琼脂培养板中,置于37 ℃培养24 h 后,镜下观察有无细菌生长,以培养皿中计数少于5 个菌落作为最低杀菌浓度(MBC)。
2.4 解热实验
选取健康SPF 级SD 大鼠60 只,雄性,体质量180~200 g,进行适应性饲养,实验前3 d,每天测动物肛温1次。实验前禁食16 h,实验当日晨测动物肛温2次为基础肛温。用15%酵母溶液背部皮下注射致热(0.02 mL·g-1)。4 h 后测肛温,升高0.8 ℃以上者用于实验,随机分为模型组、CGG 组、CM 组、TCM 组和阳性药阿司匹林维生素C 泡腾片组,每组12 只。各组分别灌胃给药,模型组灌胃给予相同体积的纯净水(10 mL·kg-1)。给药后1、2、3、4 h 各测肛温1次,以不同时间所测肛温与基础肛温之差值作为体温变化的指标,以t检验进行统计学处理。
2.5 抗炎实验
取健康SPF 级ICR 小鼠50 只,体质量18~20 g,按体质量随机分组,分别为模型组、CGG 组、CM组、TCM组和阳性药布洛芬颗粒组,每组10只,雌雄各半。各组分别灌胃给予相应药物,模型组灌胃给予相同体积的纯净水(20 mL·kg-1),CGG、CM、TCM 组每天给药1次,连续给药7 d,阳性药布洛芬颗粒在第6、7天各给药1次。末次药后30 min,每只以2%巴豆油70 μL涂于右耳前后两面,左耳作对照,致炎后4 h 将小鼠脱颈处死,沿耳廓基线剪下两耳,用打耳器(8 mm)在同一部位分别冲下耳片,电子天平称质量,计算左右耳片的质量差(即耳肿胀值),以t检验进行组间比较,并按公式(6)计算抑制率。

2.6 统计学方法
采用SPSS 17.0 软件进行统计学分析,实验数据以(±s)表示,以t检验或者χ2检验进行组间比较,P<0.05表示差异有统计学意义。
3.1 流感病毒抑制实验
3.1.1 对体质量和肺指数的影响 由表1 可知,小鼠感染流感病毒后,模型组小鼠体质量明显低于对照组(P<0.01),肺指数值明显高于对照组(P<0.01),表明造模成功。
表1 CGG对小鼠流感病毒性肺炎的影响(±s, n=10)

表1 CGG对小鼠流感病毒性肺炎的影响(±s, n=10)
注:与对照组比较,**P<0.01;
与模型组比较,#P<0.05,##P<0.01;
与CGG比较,$P<0.05;
CM组剂量为对乙酰氨基酚、咖啡因、马来酸氯苯那敏各131.04、9.36、2.09 mg·kg-1;
表2~5同。
CGG、TCM 和磷酸奥司他韦胶囊组小鼠体质量较模型组明显提高(P<0.01);
CGG、CM 和TCM组小鼠肺指数值较模型组明显降低(P<0.05),与模型组相比差异有统计学意义,表明CGG、CM 和TCM 对流感病毒引起的小鼠病毒性肺炎具有抑制作用;
且CGG 效果优于CM、TCM,提示中药和化学药发挥了协同作用。
3.1.2 对病毒载量的影响 小鼠感染流感病毒后,模型组肺组织中病毒载量明显高于对照组(P<0.01),CGG、TCM、CM 组和磷酸奥司他韦胶囊组可明显降低肺组织中病毒载量(P<0.05),与模型组比较差异有统计学意义。结果见表2。
表2 CGG对小鼠病毒性肺炎病毒载量的影响(±s, n=10)

表2 CGG对小鼠病毒性肺炎病毒载量的影响(±s, n=10)
3.1.3 对流感病毒感染致小鼠死亡的影响 小鼠感染流感病毒后,模型组的存活天数平均值为8.0±1.0,CGG、TCM 和磷酸奥司他韦胶囊组小鼠存活时间较模型组明显延长,与模型组比差异有统计学意义(P<0.05);
CGG 组小鼠存活时间长于TCM 组,差异有统计学意义(P<0.05)。结果见表3。
表3 CGG对病毒感染致小鼠存活时间的影响(±s)

表3 CGG对病毒感染致小鼠存活时间的影响(±s)
模型组小鼠死亡率达到100%,CGG 和磷酸奥司他韦胶囊组对流感病毒感染致小鼠死亡率较模型组明显降低,与模型组相比差异有统计学意义(P<0.05)。结果见表4。

表4 CGG对病毒感染致小鼠死亡率的影响
3.2 抑菌实验
3.2.1 体内抑菌实验 腹腔注射金黄色葡萄球菌后,模型组小鼠死亡率可达100%,CGG、CM 组小鼠死亡率低于模型组,但与模型组相比差异无统计学意义。结果见表5。
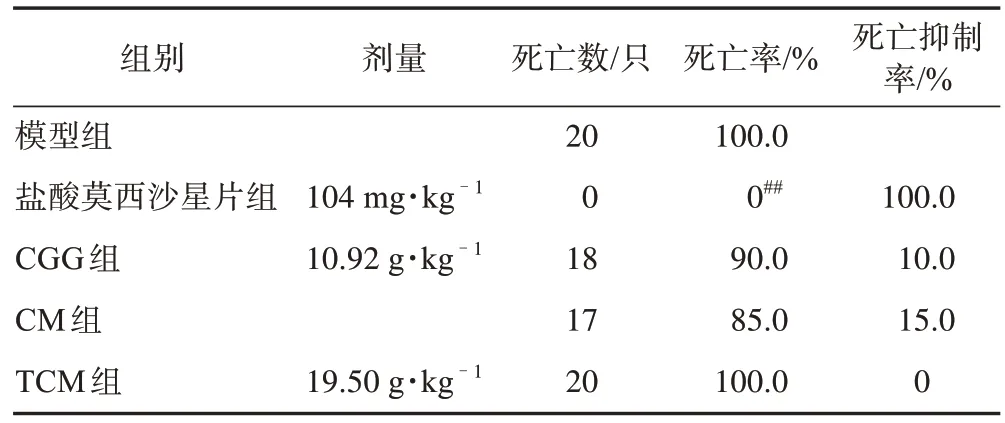
表5 CGG对细菌感染小鼠死亡的保护作用(n=20)
3.2.2 体外抑菌和杀菌实验 肉眼观察阳性药盐酸莫西沙星片组(质量浓度为4 mg·mL-1)中金黄色葡萄球菌、肺炎链球菌、乙型链球菌均无生长,说明其有抑菌和杀灭菌作用。CGG、TCM 对金黄色葡萄球菌、肺炎链球菌、乙型溶血性链球菌标准株均显示出抑制和杀灭作用。结果见表6。

表6 CGG的抑菌实验结果mg·mL-1
3.3 解热实验
CGG 和CM 组在给药后1、2 h 可显著抑制酵母致大鼠发热反应,与模型组相比差异有统计学意义(P<0.01),表明CGG 和CM 具有解热作用。结果见表7~8。
表7 CGG对酵母致大鼠发热的影响(±s, n=12)

表7 CGG对酵母致大鼠发热的影响(±s, n=12)
注:与对照组比较,**P<0.01;
与模型组比较,#P<0.05,##P<0.01;
与CGG比较,$P<0.05;
CM组剂量为对乙酰氨基酚、咖啡因、马来酸氯苯那敏各90.72、6.48、1.45 mg·kg-1;
表8~9同。
3.4 抗炎实验
CGG、CM、TCM 组的耳肿胀值明显低于模型组,与模型组相比差异有统计学意义(P<0.05);
表明CGG、CM、TCM均具有抗炎作用。结果见表9。
表9 CGG对巴豆油致小鼠耳肿胀的影响(±s, n=10)

表9 CGG对巴豆油致小鼠耳肿胀的影响(±s, n=10)
现代医学认为感冒为多种病原体引发的急性上呼吸道感染,可引发鼻、咽、喉、扁桃体等黏膜充血水肿,上皮细胞破坏、浆液、黏液及脓液渗出产生鼻塞、咳嗽等上呼吸道炎性症状,并有头痛、恶寒发热等全身症状[2-3]。中医认为感冒多见肺热亢盛,可出现肺失宣肃,甚至肺气郁闭的病理变化,疾病发展至后期又可出现肺之气阴耗伤或痰瘀阻滞肺络。中医治疗具有辨证论治的理念与方法:邪犯肺卫时,主以疏表透邪,并注意配合清宣肺热;
肺热亢盛时,主以清宣肺热;
肺气郁闭较甚者,则主宣肺、泻肺[4]。
CGG 是由中药和化学药配伍组成的复方制剂,其中对乙酰氨基酚作为最常用的解热镇痛药之一,对发热、咽痛、全身酸痛等效果明显,且安全性高;
马来酸氯苯那敏为第一代抗组胺药,有抗过敏、抗胆碱能作用,能有效缓解咳嗽、喷嚏、流涕等症状;
咖啡因既能加强解热镇痛药的疗效,又能缓解抗组胺药所引起的嗜睡作用[5]。山银花具有清热解毒、凉散风热的功效[6];
五指柑具有解表清热、利湿除痰、止咳平喘等功效[7];
野菊花具疏散风热、消肿解毒的功效[8];
三叉苦可用于治疗热病高热不退、咽喉肿痛等[9];
南板蓝根可用于温疫时毒、发热咽痛等病症[10];
岗梅有清热解毒、生津活血的功效,主治热病、燥渴、咳血、喉痛等症[11]。上述多种成分协同起效,共同作用于机体,具有抗感冒作用。
通常流感病毒感染机体后,机体生存状态降低,体质量下降,并可引起肺部水肿、炎性渗出、充血等病理改变,这些病理改变均可使肺部质量增加,从而导致肺指数值增高,故通常以肺指数值大小来表示肺部病变的严重程度[12]。研究中发现小鼠感染流感病毒后,CGG 给药组体质量较模型组明显提高,给药组肺组织中病毒载量较模型组明显降低;
CGG、CM、TCM 组小鼠的肺指数抑制率分别为19.68%、8.30%、8.54%;
各组存活时间较模型组明显延长,其延长率分别为29.6%、5.4%、12.9%;
病毒感染致小鼠死亡抑制率分别为26.7%、0、10.0%。表明CGG 对流感病毒引起的小鼠病毒性肺炎具有抑制作用,且CGG 效果优于TCM、CM,提示TCM和CM发挥了协同作用。
表8 CGG给药后不同时间对酵母致大鼠发热的影响(±s, n=12)
感冒还会引起的细菌性呼吸道感染,如金黄色葡萄球菌、肺炎链球菌、乙型链球菌[13-14]的感染,在体内抑菌实验中,腹腔注射金黄色葡萄球菌后,给药组小鼠死亡率低于模型组,CGG、CM、TCM 对小鼠的死亡抑制率分别10.0%、15.0%、0,但与模型组相比差异无统计学意义。体外抑菌和杀菌实验中,CGG 和TCM 对金黄色葡萄球菌、肺炎链球菌、乙型溶血性链球菌标准株均显示出抑制和杀灭作用。此外,发热是感冒就诊最常见的主诉症状之一,解热实验中发现CGG、CM组可在给药后1、2 h可显著抑制酵母致大鼠发热反应,表明CGG 和CM 具有解热作用。抗炎实验中给药组耳肿胀值明显低于模型组,CGG、CM、TCM 组抑制率分别为31.7%、22.6%、26.8%,表明CGG、CM、TCM均具有抗炎作用。
综上所述,CGG、CM 和TCM 均具有抗流感病毒作用和抗炎作用;
CGG、TCM 对金黄色葡萄球菌等显示出抑制和杀灭作用;
CGG、CM 具有解热作用。CGG 效果优于TCM、CM,提示TCM 和CM 发挥了协同作用。CGG 具有抗病毒、抑菌、解热、抗炎等功效,可用于治疗感冒引起的头痛、发热、鼻塞、流涕、咽痛等上呼吸道感染症状,本研究为临床上应用CGG治疗感冒提供参考。





