【www.zhangdahai.com--其他范文】
黄越,方崇锴,聂多锐,蓝清霞,李跃军,黄学武
(1.广州中医药大学 第一临床医学院,广东 广州 510405;
2.湖南中医药大学 研究生院,湖南 长沙 410000;
3.湖南中医药高等专科学校第一附属医院,湖南 株洲 412000;
4.广州中医药大学第一附属医院,广东 广州 510405)
胃恶性肿瘤(gastric cancer,GC)是世界上最常见的恶性肿瘤之一,其5年生存率极低,仅为29%[1]。胃癌患者一经发现,很多已到晚期,失去了最佳手术时机。胃癌患者在化疗的过程中,生活质量降低,而且长期使用化疗药会让肿瘤患者产生很多不良反应,比如有一些会出现骨髓抑制的现象,多次化疗可能会产生耐药性,最后疗效无法提升甚至疗效不佳[2]。中医药治疗讲究整体观念和辨证论治,中药可增强机体免疫功能,能缓解药物的诸多不良反应,达到减毒增效的目的,有助于化疗的顺利进行,在防治肿瘤过程中具有不可替代的作用。
黄芪含皂苷、黄芪多糖、黄酮类等主要成分,在药理学上具有治疗应激氧化及恶性肿瘤、免疫调节保护等多种作用[3]。莪术具有破血消积、行气止痛的作用,现代药理研究发现其主要成分有挥发油、姜黄素类、多糖类等,能够抗肿瘤、抗血小板聚集、调节胃肠平滑肌等[4]。补气健脾,活血化瘀是中医常用的抗肿瘤治疗法则。黄芪配莪术是国医大师朱良春教授治疗胃病最为常用的药物组合[5],黄芪能补五脏之虚,莪术善于行气、破瘀、消积。莪术与黄芪同用,可奏益气化瘀之功。两药相伍,行中有补,补中有行,相得益彰。黄芪和莪术配伍,也是临床常用的抗肿瘤组合[6]。研究发现,黄芪能够通过增强胃黏膜防御因子而起到保护胃黏膜、预防胃癌前病变的重要作用[7]。莪术通过影响细胞周期、抑制某些通路和多种蛋白质的差异表达,从而抑制胃癌细胞的增殖[8]。黄芪和莪术均有抗癌的作用,但两者配伍治疗胃癌的具体作用机制未见明确阐述。
中药治疗疾病的过程中具有作用靶点多、成分多、途径多等特点,现代药理学等研究表明,黄芪和莪术的有效成分可通过多靶点、多途径治疗相关疾病[3-4,9]。而网络药理学是在系统生物学理论的基础上,形成复杂的生物网络模型,体现药物、活性成分、靶点、通路、疾病间相互作用的整体性与系统性,从而对药物治疗疾病的药理学机制进行预测[10-11]。本文运用网络药理学和分子对接的方法,筛选黄芪和莪术的主要活性成分,研究其治疗胃恶性肿瘤的作用机制,为后续的相关研究提供思路。
1.1 活性成分的前期准备
本研究在中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)(http://tcmspw.com/tcmsp.php)检索,检索内容为“黄芪”“莪术”。
药物口服生物利用度(oral bioavailability,OB)和类药性(drug-likeness,DL)是代表药代动力学的重要参数。本研究设定OB≥30%,DL≥0.18来筛选活性成分。
1.2 黄芪-莪术药对活性成分治疗胃癌作用靶点的获取与收集
通过TCMSP平台查询黄芪-莪术有效成分的靶点信息,把靶点分别输入Uniprot数据库(https://www.uniprot.org/),定义种源为人,检索目标蛋白的基因名称。与胃癌有关的靶点的获得,通过GeneCards数据库(https://www.genecards.org/)检索“gastric cancer”。将“药物-活性成分” “活性成分-靶点”相互关系整理成Microsoft Excel文件导入Cytoscape3.7.0,绘制药物-活性成分-靶点网络图,从中分析参数,选出两者的核心作用成分。取两药共同靶点和疾病靶点的交叉部分,描绘黄芪-莪术和胃癌靶点的交集图。
1.3 绘制蛋白质-蛋白质相互作用图
把黄芪-莪术治疗胃癌的预测作用靶点在STRING数据库(https://string-db.org/)Version 10.5中进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)分析,并使用 Cytoscape 3.7.0软件绘制PPI图。
1.4 分子对接的准备过程
首先在PPI图中选择度值(degree)前5的靶点作为核心受体蛋白。目标蛋白选自RCSB蛋白数据库(https://www.rcsb.org/),使用Pymol软件对受体蛋白进行去水和去原配体,运行AutoDock Vina软件对受体蛋白加极性氢。从ZINC数据库(http://zinc.docking.org/)查询黄芪-莪术药对关键成分的结构,并保存为mol格式。将活性成分和靶蛋白均转换成pdbqt格式文件。目标蛋白与配体对接结果以最低结合能为依据,使用Pymol软件进行观察和作图。结合相关文献,具体原理是对接大分子(蛋白质)和小分子(配体),两者结合程度的大小通过能量的高低来表现,通常认为能量越低,蛋白质与小分子化合物结合的构象越稳定[12]。
1.5 基因本体生物过程及京都基因与基因组百科全书通路富集分析
将预测的靶基因上传至Omicshare平台(http://www.omicshare.com),限定物种为“human”,基因本体(gene ontology,GO)分析从生物过程方向进行,通路分析选择京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG),并将其可视化,绘制多靶点、多通路、多作用网络图。
2.1 黄芪-莪术药对活性成分的筛选
以OB≥30%,DL≥0.18为条件进行筛选,最终在TCMSP数据库搜集到20个黄芪活性成分,4个莪术活性成分,根据相关文献[3-4,9],将莪术醇、β-榄香烯、黄芪多糖等已研究出具有抗癌功效的活性成分纳入,共26个活性成分,详见OSID附表1,表1为最有代表性的10种活性成分。

表1 黄芪-莪术药对的活性成分
2.2 药物-活性成分-靶点网络的绘制
通过TCMSP平台搜索得出黄芪的活性成分莎醇-2′,5′-二-O-葡萄糖苷、二氢异黄酮和莪术的活性成分温金素、双去甲氧基姜黄素无对应靶点信息,故予剔除。整理从Uniprot数据库中搜集的预测靶点信息,共有601个活性成分靶点,其中黄芪554个,莪术47个,去除重叠部分,得到291个靶点。运用Cytoscape 3.7.0软件,将数据导入,绘制黄芪-莪术药物-活性成分-靶点网络图(图1)。根据参数度值的高低及相关文献检索莪术醇、β-榄香烯的抗肿瘤机制[8],得出作用于胃癌靶点的核心活性成分有槲皮素、山奈酚、7,2′-二羟基-3′,4′-二甲氧基异黄烷、莪术醇、β-榄香烯。

图1 黄芪-莪术药物-活性成分-靶点网络Fig.1 Drug-active-ingredient target network of Astragali Radix-Curcumae Rhizoma
2.3 黄芪-莪术治疗胃癌的靶点预测
运用GeneCards数据库,得到499个与胃癌相关的靶点,取黄芪-莪术共同作用靶点和胃癌靶点的交集,得到黄芪-莪术治疗胃癌的潜在靶点,共74个(详见OSID附表2)。构建药对与疾病的靶点维恩图见图2。整理基因对应的主要的Uniprot ID,见表2。
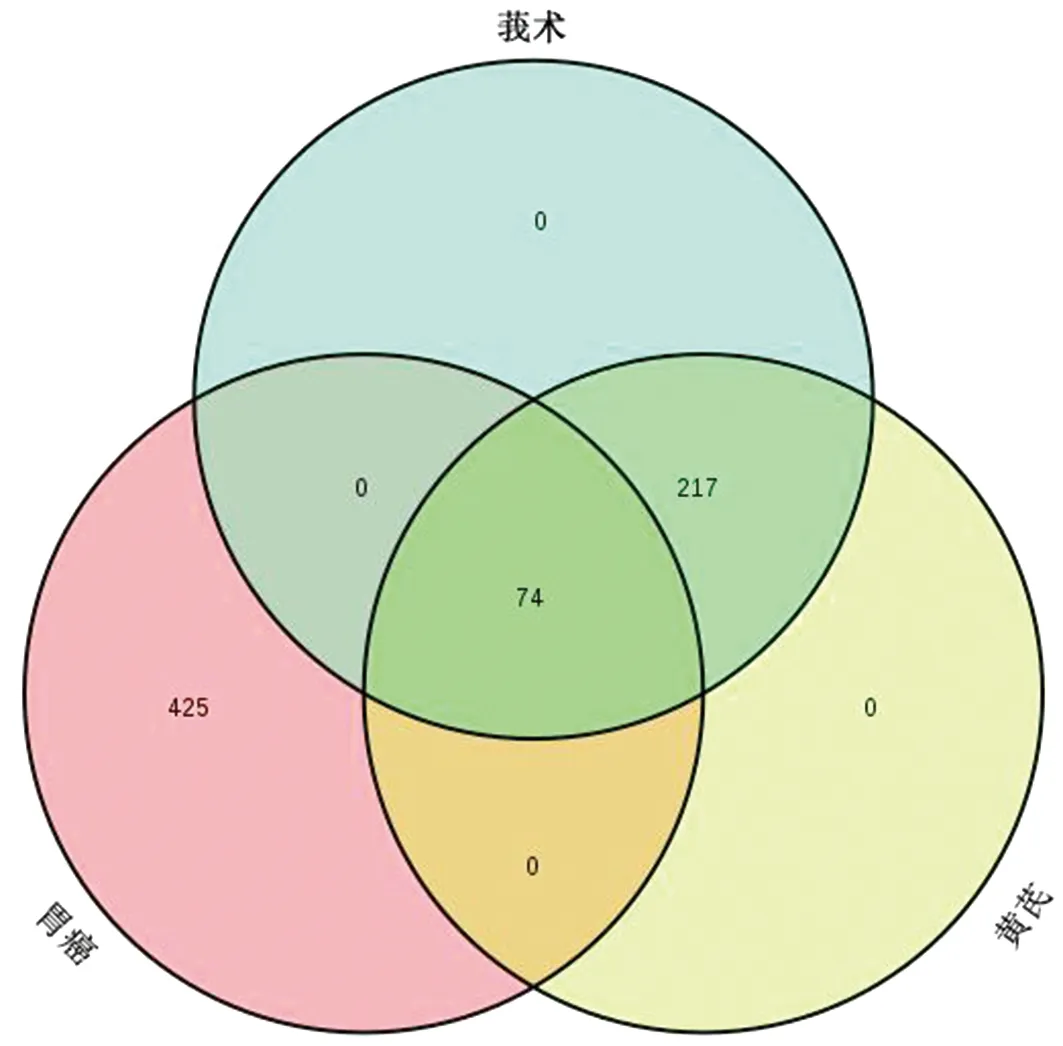
图2 黄芪-莪术和胃癌靶点的维恩图Fig.2 Venn diagram of the targets of gastric cancer and Astragali Radix-Curcumae Rhizoma

表2 靶点信息表
2.4 PPI图的分析结果
通过1.3方法得到PPI图(图3)。如图3所示,根据度值的大小,排名前五的分别是TP53、MYC、CASP3、AKT1、JUN这5个靶点蛋白,为黄芪-莪术治疗胃癌的主要作用靶点。

图3 黄芪-莪术药对潜在靶点的PPI网络Fig.3 Protein-protein interaction network of Astragali Radix-Curcumae Rhizoma
2.5 分子对接分析
通过1.4方法进行分子对接,得到活性化合物与靶蛋白对接的结合自由能结果,主要结果见表3(详细数据见OSID附表3)。活性化合物与靶蛋白的结合能如果是负值,表示两者具有结合能力。结合活性度越高,负值的绝对值就越高,即结合能力越好。根据表3的结果,得出图4(a)~(f),即TP53与槲皮素的对接、MYC与槲皮素的对接、CASP3与槲皮素和莪术醇的对接、AKT1与槲皮素的对接、JUN与山奈酚的对接为靶蛋白与活性化合物结合最好的组合,这说明黄芪-莪术药对的活性成分对主要核心靶点蛋白有调控作用。

表3 核心靶点蛋白与活性化合物的对接结果

图4 核心靶点蛋白与活性化合物的最佳对接结果 Fig.4 Docking results of target proteins with active compounds showing the best binding
2.6 GO生物过程及KEGG通路富集分析结果
通过1.5方法进行GO及KEGG通路富集分析,结果如图5~6所示。GO生物功能富集分析(图5)结果显示,关键靶点对凋亡信号通路、酶结合、蛋白结合、信号受体结合、RNA聚合酶II转录调控复合物等起作用。从KEGG通路富集分析中,结合相关文献检索,发现靶点主要富集在癌症, 癌症中的蛋白聚糖、PI3K-Akt、MAPK、Rap1、TNF、FoxO等信号通路上[13],进一步获得如图6所示的KEGG通路富集分析。

图5 GO生物功能富集分析Fig.5 Gene ontology pathway enrichment analysis

图6 KEGG通路富集分析Fig.6 Kyoto encyclopedia of genes and genomes pathway enrichment analysis
2.7 疾病-药物-活性成分-靶点-通路网络图的构建与分析
为了使黄芪-莪术治疗胃恶性肿瘤的机制更加直观可视化,通过Cytoscape 3.7.0软件,把以上得到的治疗胃恶性肿瘤的关键活性成分、靶点和相关的信号通路进行整理,构建多靶点、多通路、多作用网络图(图7)。图中共有节点102个,边线516条。绿色三角形代表胃癌,蓝色圆形代表黄芪、莪术,橙色V形代表药物活性成分,黄色正方形节点代表潜在靶点,淡橙色菱形节点代表黄芪-莪术治疗胃癌可能参与的主要信号通路。这一网络图充分体现了中药治疗疾病具有多成分、多靶点、多通路的特点。

注:绿色三角形代表胃癌,蓝色圆形代表黄芪、莪术,橙色V形代表药物活性成分,黄色正方形节点代表潜在靶点,淡橙色菱形节点代表黄芪-莪术治疗胃癌可能参与的主要信号通路。图7 黄芪-莪术药对多靶点、多通路、多作用网络Fig.7 Multitarget, multichannel, and multifunction network of Astragali Radix-Curcumae Rhizoma
中医认为肿瘤的形成与气滞、痰湿、瘀血、毒邪等有关,常用中医治疗法则有扶正培本、清热解毒、活血化瘀、除痰散结等,黄芪健脾补气,而莪术活血化瘀,所以两者常配伍使用以益气活血,是临床常用抗肿瘤组合[6]。槲皮素、山奈酚、7,2′-二羟基-3′,4′-二甲氧基异黄烷属于黄芪中的黄酮类活性成分,研究发现,槲皮素能抑制胃癌细胞的增殖和侵袭,在联合槲皮素化疗的研究中,发现通过抑制c-Jun的表达可增强5-氟尿嘧啶对胃癌细胞的凋亡[14]。Zhang等[15]研究得出,山柰酚对人胃癌细胞的增殖起抑制作用并且能提高胃癌细胞的自噬能力,其促进人胃癌SNU-216细胞中的miR-181a水平高表达,导致MAPK/ERK和PI3K通路的表达受阻。7,2′-二羟基-3′,4′-二甲氧基异黄烷文献研究较少,但本文发现其是治疗胃癌的核心活性成分之一,值得后续深入研究。黄芪多糖是黄芪中的主要活性成分,研究发现其能够促进Bax高表达,使Bcl-2低表达,从而抑制胃癌细胞的增殖及直接杀伤人胃癌细胞中的MKN45细胞,还能通过影响端粒酶活性而抑制肿瘤增长[16]。莪术醇通过阻碍信号通路和抑制细胞周期而发挥抗肿瘤作用,其阻碍JAK2/STAT3、NF-κB及JAK3/STAT5等信号通路的表达,促进p38 MAPK信号通路高表达,影响胃癌细胞增殖的速度,促进肿瘤细胞更多的凋亡[8]。研究发现β-榄香烯能引起人胃癌细胞多种蛋白质差异表达而发挥抗癌机制,又通过促进Bcl-2家族的促细胞凋亡成员类BCL-2蛋白12 和人胃癌细胞BCL-2相关转录因子(BTF)的高表达,加速肿瘤细胞凋亡速度[8]。
本文通过对PPI网络图的分析,得出TP53、MYC、CASP3、AKT1、JUN为黄芪-莪术治疗胃癌的主要作用靶点。其中TP53与槲皮素、MYC与槲皮素、CASP3与槲皮素和莪术醇、AKT1与槲皮素、JUN与山奈酚的对接为靶蛋白与活性化合物对接最好的组合,说明黄芪-莪术药对的活性成分能对主要作用靶点发挥调控作用,但后续仍需进一步的生物实验验证。Jiang等[17]证明了TP53突变本身可以导致胃癌和其他癌症类型的免疫活性下降。MYC是较早发现的一组癌基因,包括C-myc、N-myc及L-myc,胃癌淋巴结转移和浆膜浸润的速度和程度,在某种程度上与C-myc蛋白的表达有很大关系[18]。有研究表明,CASP3通过影响胃黏膜和胃肿瘤细胞的凋亡程序而对胃癌的预后判断起相关作用[19]。AKT1在胃癌组织中出现高表达状态,相关研究发现其参与胃癌的发生、发展及浸润的过程,因此,对于AKT1的进一步研究有利于找到胃癌治疗的靶点[20]。JUN能影响细胞分化及其凋亡过程,c-JUN通过磷酸化水平的调节,干扰耐药细胞周期的凋亡及分化,进而对抗化疗药的多重耐药,这就为胃癌化疗药耐药机制方面的研究提供了有效借鉴[21]。
对KEGG通路进行分析,发现PI3K-AKT、MAPK、P53等信号通路在黄芪-莪术治疗胃恶性肿瘤中发挥抗肿瘤作用,其通过多种信号表达,进而影响肿瘤细胞的凋亡、增殖等。如MAPK在人体细胞中担任传递信号的重要角色,其使核转录因子磷酸化,从而发挥抑制细胞凋亡、增殖、分化的作用,发挥抗炎、抗应激、加强免疫调节的作用[22]。作为PI3K信号通路中的核心分子,PI3Ks发挥调控人体细胞分化、增殖的作用。PI3Ks正常以非激活状态在人体中,如果发生突变,PI3Ks大量被激活,进而使PI3K-AKT信号通路高表达,最终会造成人体细胞新陈代谢发生异常,久之引发恶性肿瘤病变[23]。研究发现,Hp感染是胃恶性肿瘤发生的高危因素,而携带TNF-β基因+252位点A等位基因与Hp感染有相关联系,因此须提高患非贲门型胃癌的警惕性[24]。
中医药抗癌注重整体观念,顺应了肿瘤综合治疗的发展趋势。本研究应用网络药理学及分子对接的方法,探讨黄芪-莪术药对治疗胃癌的分子作用机制,黄芪-莪术药对治疗胃癌的机制体现了中药治疗多靶点、多通路、多作用的特点,为治疗胃癌的临床研究提供了更多思路和方法。
猜你喜欢 莪术槲皮素黄芪 莪术治疗卵巢癌研究进展中国老年学杂志(2022年22期)2022-11-21“补气之王”黄芪,你吃对了吗?今日农业(2022年13期)2022-09-15含有槲皮素的食物摄入水平与肥胖的关系调查研究农产品加工(2021年19期)2021-11-15Instructions for AuthorsDigital Chinese Medicine(2020年4期)2020-12-11温莪术引种贵州的表现与规范化种植要点农技服务(2020年7期)2020-07-21异槲皮素的制备及研究进展天然产物研究与开发(2020年4期)2020-06-02槲皮素金属配合物合成及药理作用研究现状北方药学(2020年12期)2020-04-30黄芪是个宝海峡姐妹(2019年3期)2019-06-18纳米槲皮素对MCF-7和MCF/ADR细胞耐药性影响研究绿色科技(2018年22期)2019-01-15探讨莪术的栽培技术中国绿色画报(2018年4期)2018-08-09本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0606/608083.html




