【www.zhangdahai.com--其他范文】
孙永红,别俊,何群育,郭奇遇
(南充市中心医院,四川 南充 637000 1 肿瘤科;
2 口腔科)
食管癌侵袭性强,男性的估计发病率是女性的3倍,总体5年生存率仅为20%左右[1]。因此,仍需要探索有效筛查、诊断和治疗食管癌的新方法。长链非编码RNA(LncRNA)是一种单链不具有编码蛋白质功能的RNA,其长度在200~100 000 nt之间[2],如ELFN1-AS1、FAM83A-AS1等均可促进食管癌的进展[3-4]。转录因子7样蛋白2(TCF7L2)是Wnt信号通路的关键分子,并可以调控β连环蛋白1(CTNNB1)的转录[5],研究已经发现TCF7L2-SATB1通路与食管癌病人不良预后有关[6-7]。环氧化酶-2(COX-2)是一种蛋白酶,研究表明约有82%的食管癌组织表达COX-2,并且参与食管癌的起源和发展[8]。前期研究发现的一种新型的LncRNA TMEM9B-AS1,主要在结肠和肾脏表达[9]。但是,其对食管癌的影响和作用机制尚不清楚,目前仍无相关报道。因此,本研究旨在探讨TMEM9B-AS1在体外对食管癌细胞侵袭和增殖能力的影响,以及介导TCF7L2-SATB1途径对食管癌细胞COX-2和CTNNB1蛋白表达的影响。
1.1 实验材料
人食管癌细胞KYSE510(ATCC®CRL-9609)以及96孔和24孔组织培养板(康宁公司,美国),DMEM培养液(Gibco公司,美国)。TMEM9B-AS1过表达、沉默质粒以及相应的阴性对照(NC)(吉玛公司,中国),Lipofectamine®2000(Invitrogen公司,美国)。Trizol试剂(Aidlab公司,中国),RNAspin Mini试剂盒(GE Healthcare,美国),BestarTMqPCR试剂盒(DBI Bioscience公司,德国),PCR仪(ABI7900,ABI公司,美国)。一抗以及山羊抗免疫球蛋白G(IgG)二抗(1∶1 000稀释,#ab6721,美国Abcam公司),PVDF膜(Bio-Rad公司,美国),ECL 显色试剂盒(Thermo Fisher公司,美国),Matrigel胶和Transwell装置(Corning公司,美国)。光学显微镜(Carl Zeiss公司,德国)。
1.2 实验方法
1.2.1细胞培养、分组和转染 将KYSE510细胞培养在DMEM完全培养液中,内含有体积分数0.10牛血清、0.1 g/L链霉素和100 kU/ L青霉素。细胞在含体积分数0.05 CO2、37 ℃和95%湿度下培养。将KYSE510分为对照组(A组)、TMEM9B-AS1组(B组)和siTMEM9B-AS1组(C组),分别转染NC质粒、TMEM9B-AS1质粒以及siTMEM9B-AS1质粒。按试剂盒说明书利用Lipofectamine®2000进行转染,转染条件为7 ℃和体积分数0.05 CO2,48 h后收集细胞进行后续研究,分别进行定量逆转录聚合酶链式反应(RT-qPCR)检测、细胞计数(CCK-8)检测、转移小室(Transwell)实验及蛋白质印迹(Western blot)实验。
1.2.2RT-qPCR检测TMEM9B-AS1、TCF7L2、SATB1、COX-2和CTNNB1的mRNA表达 使用RNeasy Mini试剂盒提取细胞总RNA,然后将其逆转转录为cDNA。使用BestarTMqPCR预混液进行qPCR实验,条件如下:95 ℃、2 min, 94 ℃、20 s,58 ℃、 20 s,72 ℃、20 s,40个循环,最后在72 ℃下延伸4 min。使用Agilent Stratagene Mx 3000P序列检测系统进行RT-qPCR分析。通过比较循环阈值并以GAPDH作为内参对照,计算TMEM9B-AS1、TCF7L2、SATB1、COX-2以及CTNNB1的mRNA相对表达水平。
1.2.3CCK-8检测细胞增殖活力 将100 μL的细胞悬浮液添加到96孔板中,孵育48 h和72 h后,将体积为10 μL的CCK-8溶液添加到每个孔中并孵育2 h。用酶标仪检测450 nm波长处每个孔的光密度(OD)值。
1.2.4Transwell检测细胞侵袭能力 将基质胶Matrigel(1∶8稀释)加入24 孔板-Transwell 装置的上室,并在 37 ℃ 下孵育 30 min。
将 600 μL 完全培养液填充到装置的下室。将细胞(密度为5×107/L)在无血清培养液中于37 ℃培养 24 h进行饥饿处理。消化后,向上室中加入 100 μL 细胞溶液(密度为5×108/L)。培养24 h后,洗去未侵入的细胞。渗入下室的细胞用体积分数0.95乙醇固定,1 g/L结晶紫室温染色20 min。随机取5个400倍视野进行细胞计数。
1.2.5Western blot检测TCF7L2、SATB1、COX-2和CTNNB1蛋白的表达 细胞裂解后通过离心(4 ℃,12 000 r/min,5 min)收集总蛋白。采用SDS-PAGE分离每个样品中等量(50 μg)的蛋白质,并将其转移到PVDF膜上。室温下将膜浸入50 g/L脱脂牛奶中2 h,封闭非特异性抗原。随后,将膜与一抗在4 ℃下孵育过夜,然后将膜与相应的辣根过氧化物酶偶联的二抗在室温下孵育1 h。使用化学发光试剂显像,采用Quantum One软件分析条带灰度值并计算TCF7L2、SATB1、COX-2和CTNNB1蛋白相对于GAPDH的表达量。
1.3 统计学处理
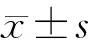
2.1 各组食管癌细胞TMEM9B-AS1的表达
对照组、TMEM9B-AS1组和siTMEM9B-AS1组食管癌细胞TMEM9B-AS1的表达水平分别为1.00±0.08、4.27±0.45和0.32±0.03,差异具有统计学意义(F=38.035,P<0.001)。提示转染实验成功。
2.2 TMEM9B-AS1对食管癌细胞增殖活力影响
结果表明,各组食管癌细胞不同时间的增殖活力比较,差异有统计学意义(F48 h=7.391,F72 h=19.190,P<0.05)。析因设计的方差分析结果显示,不同时间和不同组别对食管癌细胞增殖活力均有影响,且二者存在交互效应,差异均具有统计学意义(F时间=4.347,F组别=18.681,F时间×组别=6.528,P<0.001)。两两比较的结果显示,TMEM9B-AS1组的细胞增殖活力显著高于对照组(P<0.05),而siTMEM9B-AS1组细胞增殖活力则显著低于对照组(P<0.05)。见表1。

表1 TMEM9B-AS1对食管癌细胞的增殖活力影响
2.3 TMEM9B-AS1对食管癌细胞侵袭能力影响
对照组、TMEM9B-AS1组和siTMEM9B-AS1组癌细胞的浸入数分别为186.45±8.75、314.79±15.42和96.21±7.38,差异有显著性(F=30.268,P<0.001)。与对照组比较,TMEM9B-AS1组细胞的侵袭能力显著升高,而siTMEM9B-AS1组则显著降低(P<0.05)。见图1。

A:对照组;
B:TMEM9B-AS1组;
C:siTMEM9B-AS1组。
2.4 TMEM9B-AS1对食管癌细胞TCF7L2以及SATB1表达影响
对照组、TMEM9B-AS1组和siTMEM9B-AS1组食管癌细胞TCF7L2、SATB1的mRNA和蛋白表达比较,差异均有统计学意义(FmRNA=42.658、49.318,F蛋白=35.154、37.489,P<0.001)。与对照组比较,TMEM9B-AS1组细胞TCF7L2、SATB1的mRNA和蛋白表达水平显著升高(P<0.05),siTMEM9B-AS1组则显著降低(P<0.05)。见图2和表2。
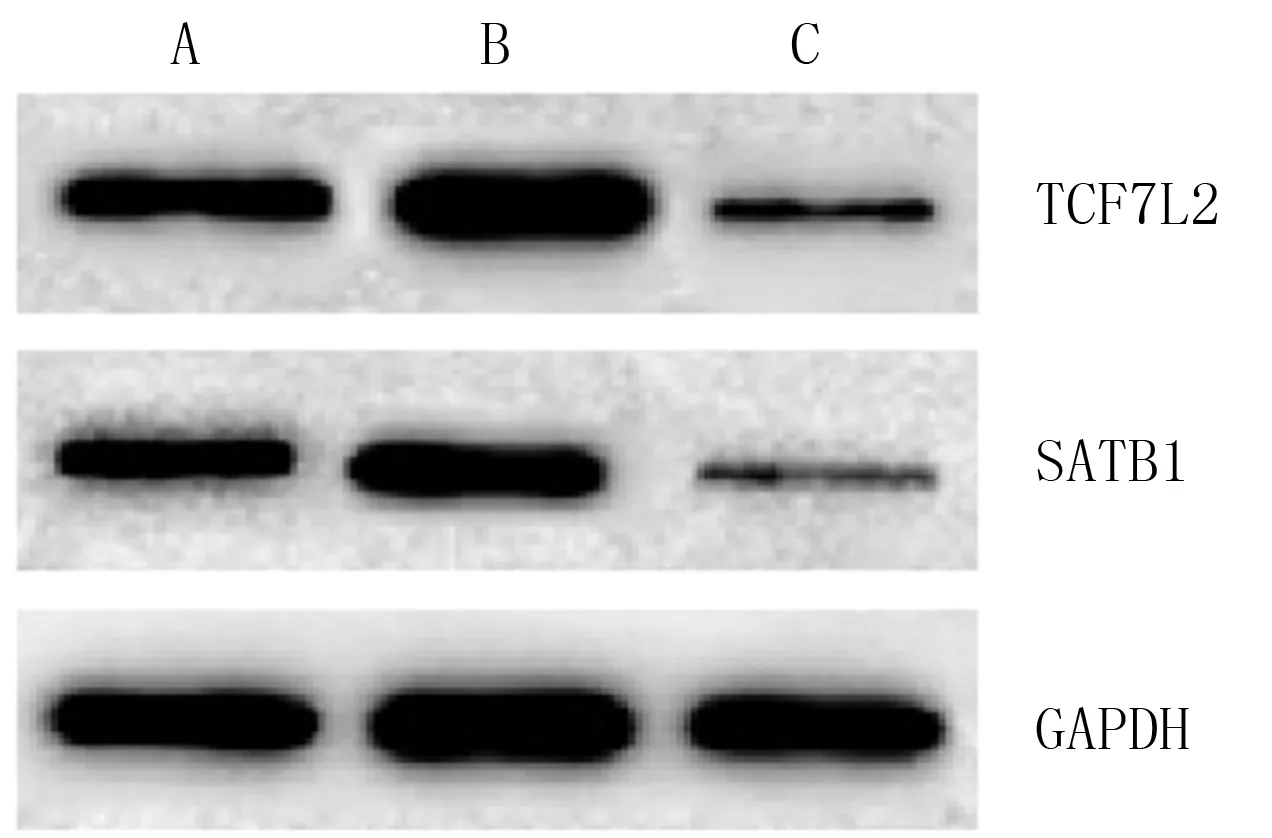
A:对照组,B:TMEM9B-AS1组,C:siTMEM9B-AS1组。

表2 TMEM9B-AS1对食管癌细胞TCF7L2-SATB1途径影响
2.5 TMEM9B-AS1对食管癌细胞CTNNB1和COX-2表达影响
对照组、TMEM9B-AS1组和siTMEM9B-AS1组食管癌细胞CTNNB1、COX-2的mRNA和蛋白表达比较,差异均有统计学意义(FmRNA=54.309、56.084,F蛋白=36.448、42.738,P<0.001)。与对照组比较,TMEM9B-AS1组细胞CTNNB1、COX-2的mRNA和蛋白表达水平显著升高(P<0.05),而siTMEM9B-AS1组则显著降低(P<0.05)。见图3和表3。

A:对照组,B:TMEM9B-AS1组,C:siTMEM9B-AS1组。

表3 TMEM9B-AS1对食管癌细胞中CTNNB1、COX-2的mRNA和蛋白表达影响
食管癌发病率逐年升高,但是目前尚无治疗食管癌的有效手段[10-11]。由于食管癌细胞早期可侵入黏膜下层或者转移至远处器官,许多病人在术后短时间内就会出现肿瘤局部复发或远处转移[12-13]。由于食管癌病人术后生存率低、预期生存期短、预后差[14],因此,探究食管癌发病机制具有重大意义。
LncRNA是近年来的研究热点,参与肿瘤的发生和进展。LncRNA具有许多生物学功能,首先,作为转录因子的组成部分,可以通过调控原癌基因和抑癌基因的转录参与食管癌细胞的增殖和转移[15-17]。在转录后水平上,LncRNA可以通过调节mRNA的剪切水平调控基因的表达,如LncRNA DGCR5通过SRSF1介导的Mcl-1选择性剪接参与食管鳞状细胞癌的发生[18]。此外,LncRNA也可通过竞争性内源RNA形式调控微小RNA,最终调控mRNA表达,如LINC00460通过靶向miR-1224-5p促进食管癌转移潜能和上皮间质转化[19]。本研究主要分析新LncRNA TMEM9B-AS1在食管癌发生和发展中的作用。编码LncRNA TMEM9B-AS1的基因位于11号染色体(NC_000011.10),转录本为389个碱基,表达于多种组织和器官,以结肠和肾脏为主。本研究利用质粒转染的方式分别构建了TMEM9B-AS1沉默和过表达的细胞模型,结果显示,在TMEM9B-AS1的水平升高后,食管癌细胞增殖和侵袭能力显著升高;
而TMEM9B-AS1的水平降低后,细胞食管癌增殖和侵袭能力显著降低。本文体外水平研究显示TMEM9B-AS1具有促进食管癌细胞增殖和迁移的作用,说明其可能参与食管癌的发生和发展。
为进一步分析TMEM9B-AS1在食管癌发生和发展中的作用机制,我们检测了TCF7L2-CTNNB1途径以及COX-2和SATB1蛋白的表达。TCF7L2蛋白参与Wnt信号通路,并通过序列特异性方式与其启动子结合来调节下游MYC基因的表达,其可调控CTNNB1的转录激活[5,20-21]。BAHRAMIAN等[22]收集肿瘤组织和邻近组织研究发现,TCF7L2在食管癌和胃癌中显著表达,可能在功能上参与癌症细胞的增殖、凋亡和血管生成通路。TCF7L2在食管鳞状细胞癌细胞中通过ERK1/2依赖性途径调控促癌基因转录,参与食管癌的发生和发展[23-24]。以上研究表明TCF7L2过表达可能对食管癌的发生具有促进作用。而CTNNB1基因是编码β-catenin蛋白的基因,其是促进食管癌细胞增殖、转移的重要细胞内信号通路,抑制该通路也是治疗食管癌的重要思路[25-27]。在哺乳动物中,TCF7L2可以和β-catenin通过DNA结合位点进行结合,共同控制和调控Wnt信号通路。此外,SATB1是一种核基质附着区结合蛋白,参与调控染色质的合成,在哺乳动物细胞中,SATB1直接与β-catenin相互作用,并通过与其启动子结合来调节Wnt靶标的表达[28-30]。并通过调控全局染色质调节众多基因的表达,研究已经显示SATB1通过上调FN1和PDGFRB在食管癌中发挥原癌基因的作用[31]。同时,COX-2蛋白对食管癌也具有促进作用,研究显示miR-128的甲基化沉默通过提高COX-2的表达促进食管癌的发展[32]。以上4种分子TCF7L2-SATB1途径,COX-2和CTNNB1均对食管癌细胞增殖、迁移以及发生发展具有促进作用。本研究结果显示,在食管癌细胞内过表达TMEM9B-AS1,可以明显促进食管癌细胞中TCF7L2、SATB1、COX-2和CTNNB1的mRNA和蛋白表达,而抑制TMEM9B-AS1在食管癌细胞内过表达则可以促进上述指标的mRNA和蛋白表达水平。Wnt/β-catenin信号通路在各种类型的癌症中通过调节COX-2基因的表达来影响疾病的发展[33]。因此,COX-2是Wnt/β-catenin信号通路下游的分子。
本文研究结果表明,TMEM9B-AS1很可能是通过TCF7L2-SATB1途径来抑制或者促进下游分子COX2的表达以及减少CTNNB1与TCF7L2的结合,从而影响食管癌细胞的增殖和侵袭能力,参与食管癌的发生和发展。CARROSSINI等[34]研究结果显示,COX-2表达和食管癌病人异位脂肪量呈显著正相关,并在腺癌中检测到共定位,但在食管鳞状细胞癌中未检测到。CONG等[35]在食管鳞状细胞癌中检测到48.3%的SATB1表达量,而正常组织只有7.8%,但分析结果显示SATB1表达与临床病理学特征没有显著相关性。但SATB1高表达病人的生存期明显短于SATB1低表达者,因此,高SATB1表达是食管鳞状细胞癌病人的独立预后因素,并且可作为其靶向治疗的潜在分子。后续临床研究应关注到COX-2和SATB1表达在两种类型癌症中的差别。
综上所述,上调TMEM9B-AS1表达可以通过TCF7L2-SATB1途径,提高COX-2和CTNNB1的表达,并增强食管癌细胞增殖和侵袭的能力。但目前研究仅仅在体外细胞水平验证了TMEM9B-AS1在食管癌中的作用,仍缺乏组织水平和动物模型的体内验证,尤其是在转基因工具鼠中的验证效果更有说服力。其次,食管癌呈现出两种主要的组织学亚型(腺癌和鳞状细胞癌),两种亚型在病理学和分子机制方面均存在很大差异,因此应研究分子以及信号通路在不同类型食管癌中的表达差异。再者关于4种分子TCF7L2、SATB1、COX-2和CTNNB1在食管癌细胞里互相作用机制仍未探究,因此未来研究应重点关注和解决TMEM9B-AS1在食管癌机制和治疗中的临床意义,其促癌的作用仍需要进行体内研究,调控TCF7L2-SATB1途径的分子机制也需要进一步研究和探索。
猜你喜欢 鳞状食管癌通路 关于子宫颈鳞状上皮细胞异常ICD-10编码的建议临床医药实践(2022年7期)2022-07-08端粒酶相关蛋白1在宫颈鳞状上皮病变中的表达*重庆医学(2022年12期)2022-07-05改变趁热吃 预防食管癌科教新报(2022年10期)2022-03-27得了食管癌能维持多长时间家庭医药(2022年3期)2022-03-24小檗碱治疗非酒精性脂肪肝病相关通路的研究进展现代临床医学(2021年4期)2021-07-31Wnt/β-catenin信号转导通路在瘢痕疙瘩形成中的作用机制研究云南医药(2021年3期)2021-07-21食管癌患者两种固定装置摆位误差及计划靶区外扩值探讨现代仪器与医疗(2021年2期)2021-07-21白芍总苷调控Sirt1/Foxo1通路对慢性心力衰竭大鼠的保护作用研究天津医科大学学报(2021年1期)2021-01-26口腔鳞状细胞癌中PD-L1的表达与P16、HPV感染以及淋巴结转移关系分析实验与检验医学(2020年2期)2020-04-25胸腹腔镜联合食管癌手术的配合腹腔镜外科杂志(2016年9期)2016-06-01本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0607/608418.html




