【www.zhangdahai.com--其他范文】
万 超, 邓婷榕, 胡 莉, 伍炳华, 袁 媛
(福建农林大学园艺学院,福建 福州 350002)
茉莉[Jasminumsambac(L). Ait]为木犀科素馨属常绿灌木,是一种著名的香料植物,在香精提取[1]、花茶窨制[2]、食品和药品开发[3-4]等方面有着广泛的应用,具有重大的经济价值.常见的茉莉花栽培品种有单瓣茉莉、双瓣茉莉、多瓣茉莉3种类型,其中,双瓣茉莉因其产量高、香气浓郁而成为目前大面积栽培的主要品种[5].前人对双瓣茉莉的香气成分进行了大量研究,发现萜类物质是双瓣茉莉的主要香气成分[6-8],因此,研究萜类物质的合成和调控对于茉莉花的香气、品质及分子育种等方面至关重要.
茉莉花萜类合成途径中的一些结构基因及其启动子已经得到克隆和分离[9-12],这些基因的启动子区域含有光响应、激素响应、生物钟等顺式作用元件,表明基因的表达很可能是受诸多因素调控的.转录因子是调控基因表达最重要的环节之一[13],其中,MYB类转录因子家族是植物转录因子中数量最多的家族之一,在许多物种中能参与植物香气的调控.如:矮牵牛中MYB转录因子PhODO1(ODORANT1)可以直接作用于5-烯醇丙酮酰莽草酸3-磷酸合酶(PhEPSPS)基因,调控香气合成,同时,PhODO1还可以与PhEOBⅠ(EMISSION OF BENZENOIDSⅠ)、PhEOBⅡ(EMISSION OF BENZENOIDSⅡ)协同调控苯丙烷类香气代谢[14-16],另一个MYB转录因子PhMYB4可以通过抑制肉桂酸4-羟化酶(PhC4H1、PhC4H2)基因转录水平从而调控花香的释放[17];
简伟[18]通过表达番茄SlMYB75基因,发现果实中的醛类、苯丙烷类和萜类等芳香挥发物显著增加;
Reddy et al[19]发现薄荷腺毛特异性R2R3-MYB会与香叶基焦磷酸合成酶(GPPS)的顺式元件结合并抑制其表达,在RNAi植株中单萜的释放量更多,表明其负调控萜类的合成.
基于茉莉植株的花、叶转录组,本试验从花中克隆出一个MYB转录因子JsMYB108,其表达模式与茉莉香气释放规律一致且与萜烯合成酶基因JsTPS2表达特征同步,同时,JsMYB108转录因子能显著提高植株茎段愈伤组织中JsTPS2基因的表达水平[20],推测JsMYB108能参与萜烯香气调控,但其调控机理却并不明确.为深入理解JsMYB108调控茉莉香气的分子机理,本试验将JsMYB108基因进行原核表达,摸索并优化了JsMYB108基因在大肠杆菌中的表达条件,在此基础上,对JsMYB108重组蛋白进行纯化分离和检测.本试验结果可为将来研究JsMYB108蛋白与JsTPS2基因的互作及筛选JsMYB108互作蛋白提供参考.
1.1 植物材料
以双瓣茉莉3年生植株为材料.取当天夜间21:00开放的花朵,用剪刀剪下后用锡箔纸包好投入液氮中速冻,置冰箱(-80 ℃)保存备用.
1.2 原核表达载体的构建
以茉莉花瓣为材料,参照EasyPure®Plant RNA Kit试剂盒(北京全式金生物技术有限公司)说明书的步骤提取RNA.按照One-Step gDNA Removal and cDNA Synthesis SuperMix(北京全式金生物技术有限公司)说明书的步骤进行第一链cDNA的合成.以cDNA为模板,设计含有BamHⅠ和SalⅠ酶切位点的特异性引物JsMYB108-F(5′-gagagaGGATCCATGGAGCATCATGTTAAAGGAGATGG-3′,下划线为BamHⅠ酶切位点)、JsMYB108-R(5′-gagagaGTCGACCTACTGTTGTAGGAAATTCCACATG-3′,下划线为SalⅠ酶切位点)扩增JsMYB108的编码序列.扩增体系:1 μL上游引物、1 μL下游引物、12.5 μL FastPfu PCR Super Mix(北京全式金生物技术有限公司)、8.5 μL H2O、2 μL cDNA.PCR扩增程序:95 ℃ 5 min;
95 ℃ 30 s,63 ℃ 30 s,72 ℃ 1 min,35个循环;
72 ℃ 10 min.
使用BamHⅠ和SalⅠ同时酶切pGEX-4T-1载体和JsMYB108扩增产物.酶切体系:1 μLBamHⅠ、1 μLSalⅠ、200 ng PCR产物或1 μg pGEX-4T-1载体、2 μL快切酶缓冲液,用无菌水补足至10 μL.于37 ℃酶切2 h后回收目的基因片段和酶切后的原核表达载体,使用T4连接酶于16 ℃连接过夜.连接体系:1.5 μL载体酶切产物、3.5 μL目的基因酶切产物、1 μL T4连接酶、1 μL连接酶缓冲液、3 μL无菌水.取5 μL连接产物转化大肠杆菌DH5α感受态,涂布于含50 mg·L-1氨苄的LB平板上,37 ℃下过夜培养后,挑取单克隆进行PCR鉴定,将阳性菌液送至福州铂尚生物技术有限公司测序.
1.3 重组蛋白的诱导表达
1.3.1 不同IPTG浓度下的诱导表达 测序正确的重组质粒通过热激法转化大肠杆菌BL21(DE3)感受态后,涂布于含50 mg·L-1氨苄的LB平板上,于37 ℃过夜培养.从平板上挑取单克隆至5 mL含氨苄的LB液体培养基中,于37 ℃、200 r·min-1过夜培养.
取1 mL过夜培养的大肠杆菌菌液,加入到50 mL含氨苄的LB液体培养基中,于37 ℃、200 r·min-1培养至D600 nm约为0.5时,加入不同浓度(0.1、0.2、0.5、1.0 mmol·L-1)的异丙基-β-D-硫代半乳糖苷(IPTG),以不加IPTG的菌液为对照.各浓度IPTG诱导的菌液均为5 mL,于37 ℃诱导培养4 h.
1.3.2 不同温度下的诱导表达 将菌液培养至D600 nm约为0.5时,于0.1 mmol·L-1IPTG、不同温度(37、28、20 ℃)下进行诱导,诱导结束后收集菌体.其中,37、28 ℃诱导4 h,20 ℃诱导过夜.
1.4 SDS-PAGE检测
于10 000 r·min-1离心1 min后收集诱导后的菌液,用200 μL PBS缓冲液(含8 g·L-1NaCl、0.2 g·L-1KCl、0.24 g·L-1KH2PO4、1.44 g·L-1Na2HPO4)重悬菌体.取50 μL悬菌液加入10 μL 6×Protein loading buffer(北京全式金生物技术有限公司),混匀,沸水浴10 min,于12 000 r·min-1离心5 min.取10 μL上清点样至10% SDS-PAGE胶(参照北京索莱宝科技有限公司SDS-PAGE试剂盒说明书的步骤制备)上,用InstaBlue protein stain solution(美国APE BIO公司)染色,用凝胶成像分析仪(美国BIO RAD公司)观察结果.
1.5 重组蛋白可溶性的检测
确定JsMYB108可成功诱导表达后,摸索诱导表达可溶性蛋白的条件.设置诱导温度为37、28、20 ℃,其中,37、28 ℃诱导4 h,20 ℃诱导过夜.诱导表达结束后用2 mL PBS缓冲液重悬菌体,取50 μL悬菌液加入10 μL 6×Protein loading buffer,剩余菌液使用冰浴超声破碎2 min后于12 000 r·min-1离心5 min.取50 μL上清加入10 μL 6×Protein loading buffer,沉淀用1.95 mL PBS重悬后取50 μL加入10 μL 6×Protein loading buffer.将以上样品沸水浴10 min,于12 000 r·min-1离心5 min,采用SDS-PAGE检测蛋白的可溶性.
1.6 JsMYB108蛋白的大量诱导及纯化
1.6.1 诱导 基于上述诱导温度的选择,取5 mL过夜培养的菌液加入到500 mL含50 mg·L-1氨苄的LB液体培养基中,于37 ℃摇床培养至D600 nm约为0.5后,加入500 mmol·L-1IPTG至终浓度为0.1 mmol·L-1,于20 ℃过夜诱导后收集全部菌体.使用30 mL Binding buffer(含1×PBS、1% Triton X-100)重悬菌体,加入100 mmol·L-1苯甲基磺酰氟(PMSF)至终浓度为1 mmol·L-1,冰浴超声破碎10 min(功率50%,每超声10 s休息10 s).超声结束后于4 ℃、12 000 r·min-1离心30 min.
1.6.2 纯化 将离心后的蛋白上清加入到GST预装亲和树脂层析柱(上海生工生物工程股份有限公司)中,控制流速为0.5~1 mL·min-1,收集流出液;
待上清全部过柱后,用5 mL Binding buffer(含1×PBS、1% Triton X-100)清洗层析柱,收集流出液;
用Elute buffer(含50 mmol·L-1Tris、5 mmol·L-1GSH)配制浓度分别为10、20、30 mmol·L-1的还原型谷胱甘肽(GSH)溶液,用于洗脱的每个GSH体积为5 mL,收集洗脱液,用于SDS-PAGE检测.
1.7 重组蛋白的Western blotting检测
取50 μL纯化后的重组蛋白加入10 μL 6×Protein loading buffer,沸水浴10 min;
于12 000 r·min-1离心5min,取10 μL上清点样至10% SDS-PAGE胶上.电泳结束后将凝胶用Trans blot SD半干转膜仪(美国BIO RAD公司)转移至NC膜(美国Ge. Healthcare公司)上,用5%脱脂牛奶室温封闭3 h;
使用GST单克隆抗体(北京全式金生物技术有限公司)于4 ℃孵育过夜,用PBST(含1×PBS、1‰ Tween 20)洗膜30 min;
使用HRP标记的GST抗体于室温下孵育1 h,用PBST(含1×PBS、1‰ Tween 20)洗膜30 min.洗膜结束后于膜上滴加2 mL eECL显色液(北京康为世纪生物科技有限公司),用凝胶成像分析仪观察结果.
2.1 pGEX-4T-1-JsMYB108原核表达载体的构建
以茉莉花cDNA为模板,JsMYB108-F和JsMYB108-R为引物,扩增获得长约900 bp的特异性条带(图1A),与预期大小相符,测序长度为864 bp,与JsMYB108编码序列相符.回收扩增产物进行双酶切,酶切后进行回收,结果(图1B)显示回收成功.

A:JsMYB108基因编码序列的扩增;
B:JsMYB108基因酶切回收后的产物(M:DL2000 Marker).
连接产物转化大肠杆菌后,取单克隆使用载体上的测序引物(F:5′-GGGCTGGCAAGCCACGTTTGGT-3′,R:5′-CCGGGAGCTGCATGTGTCAGAGG-3′)进行PCR鉴定,获得约1 100 bp的片段(图2),测序显示序列正确,表明pGEX-4T-1-JsMYB108重组质粒构建成功.

M:DL2000 Marker;
1~5:阳性条带.
2.2 重组蛋白的诱导表达
2.2.1 IPTG浓度对蛋白诱导表达的影响 将转化了pGEX-4T-1-JsMYB108质粒的大肠杆菌于37 ℃、不同浓度(0.1、0.2、0.5、1.0 mmol·L-1)IPTG下诱导4 h.结果(图3)显示:与对照相比,4个浓度IPTG诱导后的菌液均在55 ku附近出现一条差异条带(59 ku),与预期的重组蛋白大小相符,表明JsMYB108能在大肠杆菌中成功表达;
4个浓度IPTG诱导下的蛋白表达量无显著差异,说明IPTG浓度对蛋白表达无显著影响.

M:蛋白分子质量标准; 1:未诱导的菌体蛋白;
2、3、4、5分别为0.1、0.2、0.5、1.0 mmol·L-1 IPTG诱导下的菌体蛋白.
2.2.2 温度对蛋白诱导表达的影响 设定IPTG浓度为0.1 mmol·L-1,分别于37、28、20 ℃下进行诱导,其中,37、28 ℃诱导4 h,20 ℃诱导过夜.SDS-PAGE检测结果(图4)显示:37、28、20 ℃下JsMYB108重组蛋白均能成功表达,表明37、28、20 ℃这3种温度均可诱导重组蛋白表达,且表达量无显著差异(图4).
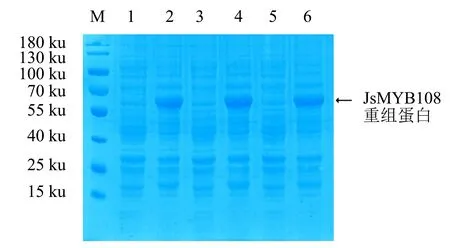
M:蛋白分子质量标准;
1、3、5:未诱导的菌体蛋白;
2、4、6分别为在28、37、20 ℃下用0.1 mmol·L-1 IPTG诱导的菌体蛋白.
2.3 重组蛋白的可溶性检测
分别于37、28、20 ℃诱导JsMYB108表达,将诱导表达所得的菌液超声破碎后分别取上清和沉淀进行SDS-PAGE检测,发现37 ℃诱导下的重组蛋白主要存在于沉淀中,28 ℃诱导下的重组蛋白在上清中的含量较少(图5A).20 ℃诱导下,重组蛋白在上清中的含量比37、28 ℃更高(图5B),表明20 ℃适合后续大量诱导和纯化.
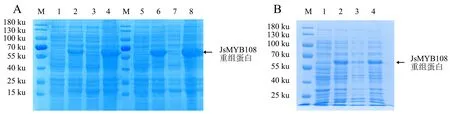
A:28、37 ℃下用0.1 mmol·L-1 IPTG诱导的重组蛋白在上清和沉淀中的表达情况(M:蛋白分子质量标准;
1、5:未诱导的菌体蛋白;
2、3、4分别为在28 ℃下用0.1 mmol·L-1 IPTG诱导的菌体蛋白、上清、沉淀;
6、7、8分别为在37 ℃下用0.1 mmol·L-1 IPTG诱导的菌体蛋白、上清、沉淀);
B:20 ℃下用0.1 mmol·L-1 IPTG诱导的重组蛋白在上清和沉淀中的表达情况(M:蛋白分子质量标准;
1:未诱导的菌体蛋白;
2、3、4分别为在20 ℃下用0.1 mmol·L-1 IPTG诱导的菌体蛋白、上清、沉淀).
2.4 重组蛋白的大量诱导和纯化
基于以上诱导温度的选择,在20 ℃下对重组蛋白进行大量诱导,取上清进行蛋白纯化.上清中的蛋白经过GST亲和树脂层析柱吸附后,依次使用10、20、30 mmol·L-1GSH进行洗脱.不同浓度GSH洗脱后的洗脱液经SDS-PAGE检测显示,用20 mmol·L-1GSH洗脱后,重组蛋白能被成功洗脱,条带较为单一(图6),表明重组蛋白成功纯化.
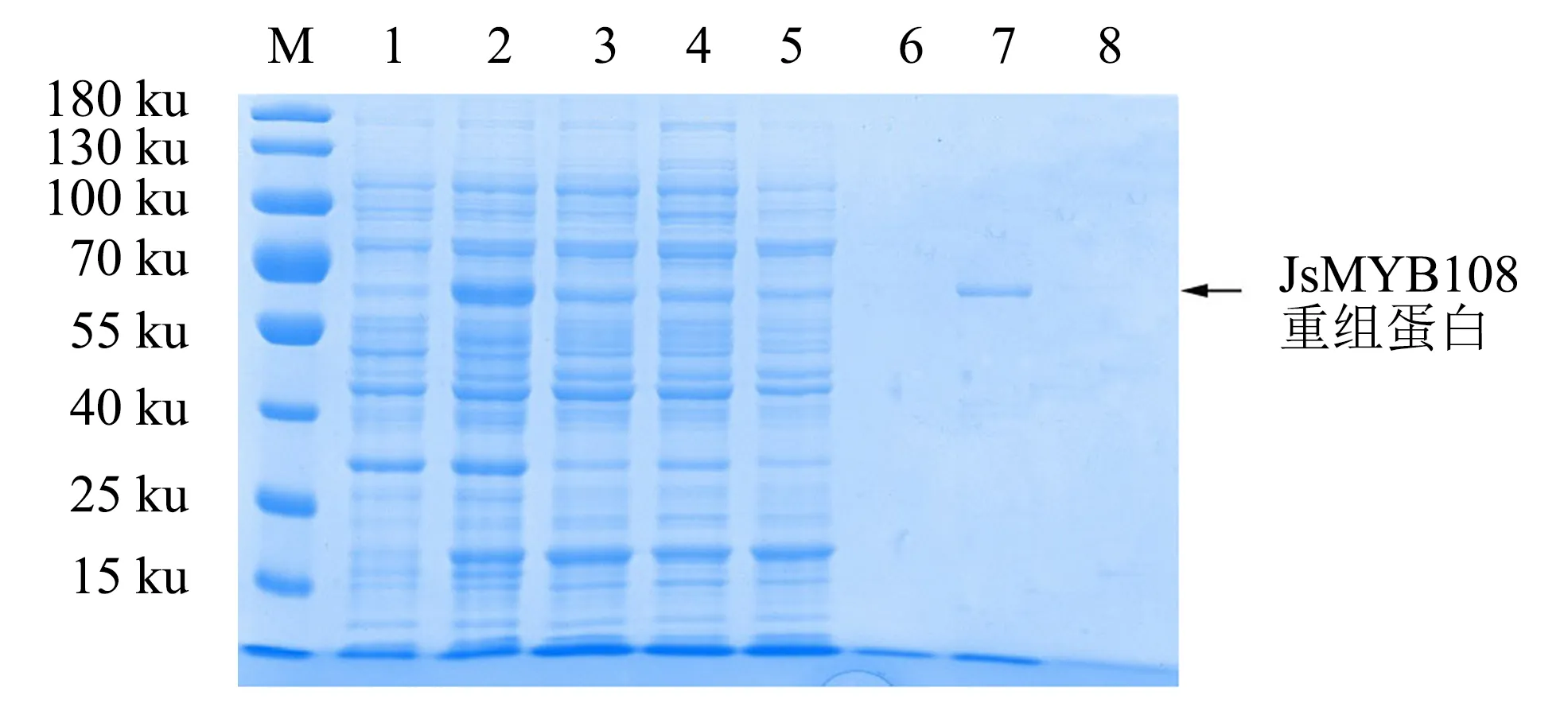
M:蛋白分子质量标准;
1:未诱导的菌体蛋白;
2:0.1 mmol·L-1 IPTG诱导后的菌体蛋白;
3:超声破碎后的菌体蛋白上清;
4:流出液;
5:洗涤液;
6、7、8分别为用10、20、30 mmol·L-1 GSH洗脱后的重组蛋白.
2.5 纯化蛋白的Western blotting检测
纯化后的JsMYB108重组蛋白采用GST单克隆抗体进行Western blotting检测.结果表明,纯化后的重组JsMYB108蛋白与GST单克隆抗体有杂交条带,且条带大小与实际相符合(图7).说明纯化后的蛋白为JsMYB108重组蛋白.

M:蛋白分子质量标准;
1为JsMYB108重组蛋白与GST抗体杂交后的条带.
蛋白质广泛参与多种生命活动,研究蛋白质的功能,体外获得蛋白至关重要.原核表达是生物工程领域用于体外获得蛋白常用的手段之一,目的基因能否在原核表达系统中成功表达受到多种因素影响,如基因本身特性、温度、表达菌株等[21-22].高温诱导时,大肠杆菌生长速度较快,蛋白更容易形成包涵体[23].本试验结果表明,JsMYB108重组蛋白是否能成功表达与IPTG浓度无显著关系,因此在确定重组蛋白能成功表达后,为纯化JsMYB108重组蛋白,需尽可能地使其在上清中富集.通过比较JsMYB108融合蛋白在20、28、37 ℃下的表达情况,发现在37 ℃诱导条件下,重组蛋白主要在包涵体中,相比28 ℃的诱导条件,20 ℃下诱导的重组蛋白在上清中的含量更高,这更有利于纯化重组蛋白.常用的原核表达载体标签有GST、His、HA等,GST标签能提高目的蛋白的可溶性[24],有利于重组蛋白的表达和纯化.本试验在前期研究中,曾用PQE30(His标签)进行JsMYB108的表达,但并未成功,后期换用pGEX-4T-1载体后,成功表达并纯化了GST-JsMYB108重组蛋白.玉米ZmAGO18b基因构建到pET-28a中能够被诱导表达,而构建到pGEX-6p载体后基本没有检测到目的蛋白[25],这与本试验结果相反,可能与基因本身的特性有关.
转录因子在植物次生代谢方面具有重要的调控作用,其可以与基因启动子结合,调控基因表达[26],因此,体外获得转录因子对于研究其对基因的调控机理有着重要意义.本试验前期研究发现,JsMYB108能显著提高茉莉花JsTPS2基因转录水平,推测JsMYB108可能直接作用于JsTPS2基因启动子,这需要后期利用凝胶阻滞(EMSA)试验做进一步分析,本试验中JsMYB108重组蛋白的成功获得可为这些研究提供参考.
GST沉淀技术在筛选互作蛋白及研究蛋白互作方面有着广泛的应用.如:李褚喆等[27]和樊晶等[28]应用GST沉淀技术分别验证了拟南芥AtARRE与ABI5蛋白、RCARs与UGT7186蛋白的相互作用;
原贵波等[29]利用GST沉淀技术联合质谱技术,筛选出37个番茄SIVQ6互作蛋白,祁静静等[30]利用相同的技术筛选出17个与柑橘抗溃疡病转录因子CsAP2-09特异性结合的蛋白.本试验获得了GST-JsMYB108蛋白,也可为筛选茉莉花中其他与JsMYB108转录因子互作的蛋白提供参考.