【www.zhangdahai.com--其他范文】
向 莉,刘 飞,陈 秋,丁祥武,颜悦蓉
(1.恩施州利川市民族中医院 药剂科,湖北 利川 445400;
2.湖北文理学院附属医院,襄阳市中心医院 消化内科,湖北 襄阳 441021)
溃疡性结肠炎是炎症性肠病的主要形式,其特征为肠粘膜具有慢性炎症和溃疡性病变[1]。溃疡性结肠炎的临床表现主要包括持续性或反复性腹泻,带粘液,血液和脓液的粪便,腹痛和各种全身症状[2]。该病的发生严重影响患者的正常生活、工作和心理健康[3]。并且,溃疡性结肠炎的病程漫长并且难以治愈,患者罹患癌症的风险更高[4]。因此,给予溃疡性结肠炎有效的治疗非常重要。黄芪多糖(Astragalus polysaccharide,APS)是从黄芪中提取的主要生物活性成分之一,在氧化应激,免疫性疾病和癌症的治疗中起着重要作用[5]。研究表明,黄芪多糖联合苦参碱对大鼠溃疡性结肠炎及相关肺损伤具有协同保护作用[5]。但是,黄芪多糖对溃疡性结肠炎的影响及潜在机理尚未完全阐明。研究发现,微小RNA(MicroRNA,miRNA)在溃疡性结肠炎进展中发挥重要作用。miR-193a-3p在溃疡性结肠炎组织中表达下调,是溃疡性结肠炎相关结肠癌的关键肿瘤抑制基因[6]。本研究生物信息学预测显示,STMN1 3’UTR序列中含有与miR-193a-3p的核苷酸序列。基因表达部分受miRNA的调控,miRNA通过与信使RNA(mRNA)的3’非翻译区(UTR)结合来调节基因表达,并抑制蛋白质翻译或破坏目标mRNA的稳定性。研究报道,Stathmin 1(STMN1)在溃疡性结肠炎组织中表达上调,溃疡性结肠炎患者STMN1积累与增生和赘生性病变相关[7]。基于上述研究结果,本研究猜想黄芪多糖通过miR-193a-3p/STMN1轴影响溃疡性结肠炎大鼠结肠上皮细胞的凋亡,利用三硝基苯磺酸(2,4,6-trinitrobenzen esulfonic acid,TNBS)/乙醇复合法构建大鼠溃疡型结肠炎模型[8],分离培养溃疡性结肠炎大鼠结肠上皮细胞,并针对此进行验证。
1.1 材料
1.1.1 动物 (无特定病原体)60只雄性SD大鼠(6周龄;
体重300±20 g),购自上海斯莱克实验动物有限公司,许可证号SCXK(沪)2017-0005。动物饲养在温度(23±2)℃和湿度(55±5)%恒定的条件下,人工照明(12 h的光/暗周期),自由进食和饮水。适应性饲养7 d后进行大鼠溃疡性结肠炎模型诱导。
1.1.2 药品 黄芪多糖 (纯度≥90.0%,SA9790)购自北京Solarbio公司,将黄芪多糖完全溶解在磷酸盐缓冲液(Phosphate Buffered Saline,PBS)中至10 mg/mL,然后用培养基稀释成100、200、400 μg/mL的浓度,并保存在4 ℃进行进一步实验。
1.1.3 试剂 TNBS购自美国Sigma-Aldrich。杜氏改良的Eagle培养基(DMEM)、胎牛血清(fetal calf serum,FBS)、TRIzol试剂、Lipofectamine 2000、膜联蛋白V(Annexin V)-FITC/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒购自美国Invitrogen。anti-miR-con、anti-miR-193a-3p、miR-con、miR-193a-3p、si-NC、si-STMN1购自上海吉玛制药公司。逆转录试剂盒、SYBR Green master mix购自日本TaKaRa。RIPA缓冲液、二辛可宁酸(Bicinchoninic acid,BCA)分析试剂盒购自北京Solarbio。STMN1抗体、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)抗体、Bcl-2相关X蛋白(Bcl-2 Associated X protein,Bax)抗体、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国Proteintech。辣根过氧化酶缀合的IgG二抗购自美国Li-Cor公司。丙二醛(Malondialdehyde,MDA)检测试剂盒、乳酸脱氢酶(Lactate dehydrofenase,LDH)检测试剂盒、超氧化物歧化酶(Superoxide dismutase,SOD)检测试剂盒、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)检测试剂盒购自上海碧云天公司。
1.2 方法
1.2.1 大鼠溃疡性结肠炎模型建立 将60只大鼠随机分为对照组和模型组两组,每组30只。根据文献[8]报道,采用TNBS/乙醇复合法构建大鼠溃疡型结肠炎模型。实验前1 d大鼠禁食不禁水,采用乙醚麻醉,用7号针头在距离肛门8 cm处的结肠内灌注50%乙醇(v/v)的TNBS药液(50 mg/kg)。注射后大鼠以头部朝下的姿势保持30 s,待药液分布均匀后,大鼠保持头低尾高的体位自然苏醒。其中,对照组注入等量50%乙醇。如前所述[8],在第3天观察到溃疡性结肠炎的症状。4 d后大鼠通过颈脱位法处死,剪取肛门2 cm上6~8 cm溃疡性结肠组织,剪碎成5 mm左右的小块,于-80 ℃冰箱保存,用于溃疡性结肠炎大鼠结肠病理检测和上皮细胞分离。如图1所示,为对照组和模型组结肠组织病理检测。可见对照组样本结构完整清晰,细胞排列有序,无炎性细胞浸润,模型组样本结构缺失,伴随大量炎性细胞浸润。

A:对照组;B实验组。
1.2.2 溃疡性结肠炎大鼠结肠上皮细胞分离培养与给药处理 根据文献[9]描述的方法从对照组和模型组大鼠中分离大鼠结肠上皮细胞。结肠上皮细胞置于37 ℃、5% CO2的恒温培养箱中,用添加了10% FBS、青霉素和链霉素(100 μg/mL)的DMEM培养基进行培养。每2~3天换1次液。取模型组大鼠结肠上皮细胞,分别使用100、200、400 μg/mL黄芪多糖处理24 h,分别记为100、200、400 μg/mL APS组,另将对照组大鼠结肠上皮细胞设为对照组。之后进行细胞凋亡和氧化应激检测,并采用实时定量PCR(qRT-PCR)检测miR-193a-3p表达。
1.2.3 细胞转染与实验分组 溃疡性结肠炎大鼠结肠上皮细胞以1×105个细胞/孔的密度接种于6孔板,保持24 h,细胞达到70%汇合时,根据Lipofectamine 2000操作手册的步骤,将anti-miR-con、anti-miR-193a-3p模拟物、si-NC、si-STMN1转染细胞48 h后以400 μg/mL黄芪多糖处理24 h,分别记为APS+anti-miR-con组、APS+anti-miR-193a-3p组、APS+anti-miR-193a-3p +si-NC组、APS+anti-miR-193a-3p+si-STMN1组。转染效率以qRT-PCR进行评估。另将miR-con、miR-193a-3p模拟物转染细胞48 h,记为miR-con组、miR-193a-3p组,检测STMN1蛋白表达。
1.2.4 流式细胞术检测细胞凋亡 溃疡性结肠炎大鼠结肠上皮细胞经1.2.2和1.2.3处理后,用PBS洗涤,并与10 μL Annexin V-FITC和5 μL PI在室温下于黑暗中孵育15 min。通过FACScan流式细胞仪进行流式细胞术分析,并使用FlowJo软件分析数据,实验重复3次。
1.2.5 免疫印迹实验(Western blot)检测STMN1、Bcl-2、Bax蛋白表达 收集1.2.2和1.2.3处理的溃疡性结肠炎大鼠结肠上皮细胞和对照大鼠结肠上皮细胞,并在含有蛋白酶抑制剂的RIPA缓冲液中溶解。总蛋白浓度用BCA分析试剂盒测定。通过12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离20 μg蛋白,转移到聚偏二氟乙烯膜上,并在室温下用5%牛奶封闭1 h。用相应的STMN1(1∶500)、Bcl-2(1∶1 000)、Bax(1∶5 000)和GAPDH(1∶2 000)一抗标记膜,4℃孵育过夜。后用二抗(1∶5 000)室温标记膜1 h。使用ECL检测系统观察免疫反应条带,以GAPDH为对照,Image Lab软件对条带强度进行定量,实验重复3次。
1.2.6 试剂盒检测MDA、LDH、SOD、GSH-Px水平 收集1.2.2和1.2.3处理的溃疡性结肠炎大鼠结肠上皮细胞和对照大鼠结肠上皮细胞,根据MDA、LDH、SOD、GSH-Px检测试剂盒的说明步骤,收集细胞上清液,进行MDA、LDH、SOD、GSH-Px水平测定,实验重复3次。
1.2.7 qRT-PCR检测miR-193a-3p表达 使用TRIzol试剂从经1.2.2和1.2.3处理过的对照组和模型组的大鼠结肠上皮细胞中分离出总RNA。通过逆转录试剂盒制备cDNA。使用SYBR Green master mix进行扩增。通过U6进行标准化,2-ΔΔCT方法计算miR-193a-3p表达。引物序列如下:miR-193a-3p F:5’-ACACTCCAGCTGGGAACTGGCCTACAAAGTCC-3’,miScript 通用引物用作反向引物。U6 F:5’-CTCGCTTCGGCAGCACA-3’,R:5’-AACGCTTCACGAATTTGCGT-3’,实验重复3次。
1.2.8 生物信息学预测和双荧光素酶报告实验验证miR-193a-3p与STMN1靶向作用 预测miR-193a-3p下游靶基因时,根据starbase获得的结果,将STMN1选作miR-193a-3p的潜在靶标。分别扩增包含miR-193a-3p假定结合序列的STMN1 3’UTR-野生型(WT)和突变体(MUT),并将二者分别克隆到荧光素酶报告质粒pMIR GLO中,生成STMN1 3’UTR-WT和STMN1 3’UTR-MUT。根据Lipofectamine 2000转染试剂的说明指示,将STMN1 3’UTR-WT或STMN1 3’UTR-MUT和miR-193a-3p模拟物或miR-con共同转染。在双荧光素酶活性测定系统中评估转染48 h后的荧光素酶活性,实验重复3次。

2.1 黄芪多糖(APS)对溃疡性结肠炎大鼠结肠上皮细胞凋亡及氧化应激的影响 实验结果见表1~2、图2。成功建立溃疡性结肠炎大鼠模型后,不同剂量黄芪多糖作用于溃疡性结肠炎大鼠结肠上皮细胞,与对照组相比,模型组大鼠结肠上皮细胞的凋亡率、Bax蛋白表达量、MDA、LDH水平明显增加,Bcl-2蛋白表达量、SOD、GSH-Px水平显著减少,差异有统计学意义(P<0.05)。与模型组相比,100、200、400 μg/mL黄芪多糖可剂量依赖性的减少溃疡性结肠炎大鼠结肠上皮细胞的凋亡率、Bax蛋白表达量、MDA、LDH水平,提高Bcl-2蛋白表达量、SOD、GSH-Px水平,且差异有统计学意义(P<0.05)。

表1 不同剂量黄芪多糖对溃疡性结肠炎大鼠结肠上皮细胞凋亡及凋亡相关蛋白表达的影响
表2 不同剂量黄芪多糖对溃疡性结肠炎大鼠结肠上皮细胞氧化应激的影响
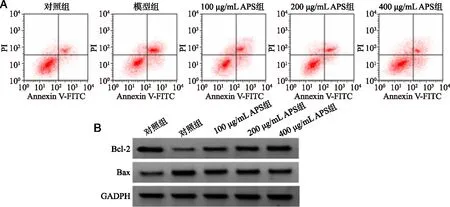
A:细胞凋亡流式结果;
B:凋亡相关蛋白表达。
2.2 黄芪多糖(APS)对溃疡性结肠炎大鼠结肠上皮细胞内miR-193a-3p表达的影响 实验结果见表3。与对照比较,模型组miR-193a-3p表达量明显降低,差异有统计学意义(P<0.05)。不同剂量黄芪多糖作用于溃疡性结肠炎大鼠结肠上皮细胞后,与模型组相比,100、200、400 μg/mL组溃疡性结肠炎大鼠结肠上皮细胞中miR-193a-3p表达量呈剂量依赖性增加,且差异有统计学意义(P<0.05)。
表3 不同剂量黄芪多糖对溃疡性大鼠结肠上皮细胞中miR-193a-3p表达的影响
2.3 下调miR-193a-3p可逆转黄芪多糖400 μg/mL对溃疡性结肠炎大鼠结肠上皮细胞凋亡及氧化应激的影响 实验结果见表4~5、图3。与APS+anti-miR-con组相比,APS+anti-miR-193a-3p组miR-193a-3p表达量降低,溃疡性结肠炎大鼠结肠上皮细胞的凋亡率、Bax蛋白表达量、MDA、LDH水平升高,Bcl-2蛋白表达量、SOD、GSH-Px水平降低,差异有统计学意义(P<0.05)。
表4 下调miR-193a-3p可逆转黄芪多糖400 μg/mL对溃疡性结肠炎大鼠结肠上皮细胞凋亡影响
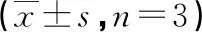
表5 下调miR-193a-3p可逆转黄芪多糖400 μg/mL对溃疡性结肠炎大鼠结肠上皮细胞氧化应激的影响

A:细胞凋亡流式结果;
B:凋亡相关蛋白表达。
2.4 miR-193a-3p与STMN1直接相互作用 生物信息学预测显示,STMN1 3’UTR序列中包含miR-193a-3p的靶向结合位点。如图4、表6所示,与miR-con组比较,miR-193a-3p组共转染STMN1 3’UTR-WT的荧光素酶活性降低,差异有统计学意义(P<0.05),共转染STMN1 3’UTR-MUT的荧光素酶活性差异无统计学意义(P>0.05)。如图5A、表7所示,与对照组比较,模型组STMN1蛋白表达量增加,差异有统计学意义(P<0.05)。与模型组相比,黄芪多糖100、200、400 μg/mL组溃疡性结肠炎大鼠结肠上皮细胞中STMN1蛋白表达量明显减少,呈剂量依赖性,且差异有统计学意义(P<0.05)。如图5B、表8所示,与miR-con组相比,过表达miR-193a-3p减少溃疡性结肠炎大鼠结肠上皮细胞STMN1蛋白表达量,差异有统计学意义(P<0.05)。

图4 miR-193a-3p与STMN1结合位点

A:不同剂量黄芪多糖对溃疡性大鼠结肠上皮细胞中STMN1蛋白表达的影响;
B:过表达miR-193a-3p对溃疡性结肠炎大鼠结肠上皮细胞STMN1蛋白表达的影响。

表6 miR-193a-3p与STMN1双荧光素酶报告实验
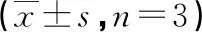
表7 不同剂量黄芪多糖处理对溃疡性大鼠结肠上皮细胞中STMN1蛋白表达的影响
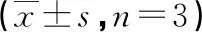
表8 过表达miR-193a-3p对溃疡性结肠炎大鼠结肠上皮细胞STMN1蛋白表达的影响
2.5 敲减STMN1逆转了下调miR-193a-3p对黄芪多糖400 μg/mL组溃疡性结肠炎大鼠结肠上皮细胞凋亡及氧化应激的影响 实验结果见表9~10、图6。与APS+anti-miR-193a-3p+si-NC组相比,APS+anti-miR-193a-3p+si-STMN1组STMN1蛋白表达量降低,溃疡性结肠炎大鼠结肠上皮细胞凋亡率、Bax蛋白表达量、MDA、LDH水平减少,Bcl-2蛋白表达量、SOD、GSH-Px水平增加,差异有统计学意义(P<0.05)。
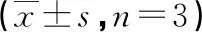
表9 敲减STMN1逆转下调miR-193a-3p对黄芪多糖400 μg/mL组溃疡性结肠炎大鼠结肠上皮细胞凋亡的影响
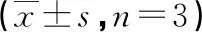
表10 敲减STMN1逆转下调miR-193a-3p对黄芪多糖400 μg/mL组治疗溃疡性结肠炎大鼠结肠上皮细胞氧化应激的影响

A:细胞凋亡流式结果;
B:凋亡相关蛋白表达。
溃疡性结肠炎是结肠的一种慢性特发性炎症性肠病,在不同程度上引起从直肠到近端结肠的连续粘膜炎症,特点是反复发作[10]。到目前为止,溃疡性结肠炎的发病机制尚未完全明确,但是研究已经证实,基因、环境、肠道微生物和自身免疫因子参与了溃疡性结肠炎的发病过程[11]。现阶段,溃疡性结肠炎患者的常规治疗方法主要包括氨基水杨酸,糖皮质激素,免疫抑制剂,生物制剂和手术治疗,但长期应用有更多的副作用,如药物不良反应[12]。补充疗法和替代疗法的优点是安全性、低毒性、有效性和经济效益。中草药作为一种补充和替代疗法,已被证明可有效治疗溃疡性结肠炎[13-14]。TNBS/乙醇复合法是诱导溃疡性结肠炎的常见模型,操作简便,易于重复,本研究同样利用TNBS/乙醇复合法模拟溃疡性结肠炎,并对大鼠结肠上皮细胞进行分离培养。结果显示,与对照的大鼠结肠上皮细胞相比,模型组大鼠结肠上皮细胞的凋亡和氧化应激增加,提示模型大鼠结肠上皮细胞受到损伤。
黄芪多糖是一种有益于人体健康的活性物质,具有多种药理作用,包括调节免疫功能、抗衰老、抗肿瘤、降血糖、降血脂、抗菌、辐射防护和抗病毒,其在各种疾病中的作用已被广泛研究[15]。先前的研究表明,黄芪多糖和党参多糖共同给药可以有效改善葡聚糖硫酸钠(Dextran sodium sulfate,DSS)诱导的急性结肠炎小鼠的临床症状,重新建立免疫平衡,并减轻结肠粘膜损伤[16]。黄芪多糖可通过抑制炎症反应来预防DSS引起的结肠炎[17]。在TNBS诱发的结肠炎中,黄芪多糖治疗7d后,大鼠结肠重量指数,结肠重量,宏观和组织学评分降低,而结肠长度增加[18],黄芪多糖还可通过调节TNF-α,IL-1β和NFATc4表达[19]对实验性结肠炎产生治疗作用。本研究结果显示,黄芪多糖100、200、400 μg/mL以剂量依赖方式显著抑制溃疡性结肠炎大鼠结肠上皮细胞的凋亡、促凋亡蛋白Bax的表达、MDA和LDH水平,并促进抗凋亡蛋白Bcl-2表达、SOD和GSH-Px水平,在溃疡性结肠炎中表现出治疗潜力,与文献研究一致[20]。溃疡性结肠炎大鼠结肠上皮细胞给予黄芪多糖100、200、400 μg/mL后,miR-193a-3p的表达被上调,说明黄芪多糖保护溃疡性结肠炎的效果可能与miR-193a-3p有关。
一些miRNA通过直接抑制其靶基因,而在溃疡性结肠炎中作为关键的转录后调节因子,参与炎症性肠病的病理过程[21]。本研究检测了溃疡性结肠炎大鼠的结肠上皮细胞中miR-193a-3p、STMN1的表达。结果显示,与对照组大鼠结肠上皮细胞比较,溃疡性结肠炎大鼠结肠上皮细胞中miR-193a-3p表达下调,STMN1蛋白表达上调,与文献研究[6-7]一致,而黄芪多糖100、200、400 μg/mL可以抑制miR-193a-3p、STMN1的表达,提示miR-193a-3p/STMN1轴在黄芪多糖作用的溃疡性结肠炎的病理进展中扮演着重要角色。文献报道,miR-193a-3p在DSS诱导的结肠炎中下调,miR-193a-3p通过靶向人PepT1 mRNA的3’ UTR减少上皮细胞凋亡,从而减轻DSS诱导的结肠炎的严重性[22],表明了miR-193a-3p在结肠炎中起保护作用。本实验中,过表达miR-193a-3p逆转了黄芪多糖400 μg/mL对溃疡性结肠炎大鼠结肠上皮细胞凋亡及氧化应激的影响。STMN1是一种主要的胞质磷蛋白,可通过促进微管去稳定来调节微管动力学,在溃疡性结肠炎患者大肠组织标本中高表达,可能用作预测发育异常和结肠癌的早期诊断标记[7]。本研究发现,敲减STMN1后,下调miR-193a-3p对黄芪多糖处理的溃疡性结肠炎大鼠结肠上皮细胞的凋亡及氧化应激的影响被逆转。此外,本研究还发现,STMN1是miR-193a-3p下游靶基因,其表达受miR-193a-3p负调控。以上结果证明,黄芪多糖可能通过上调miR-193a-3p靶向STMN1,进而发挥改善溃疡性结肠炎的作用。
本研究表明,黄芪多糖100、200、400 μg/mL可有效减轻溃疡性结肠炎大鼠结肠上皮细胞的凋亡和氧化应激,其机制与miR-193a-3p/STMN1轴有关。黄芪多糖可能成为治疗溃疡性结肠炎的候选成分。
猜你喜欢 溃疡性结肠炎结肠 新生儿先天性细小结肠症相关病因与影像表现福建医科大学学报(2022年3期)2022-09-10“结肠炎”背后的亲子关系问题中老年保健(2022年5期)2022-08-24岭南山竹子醇提物对溃疡性结肠炎小鼠的作用世界科学技术-中医药现代化(2022年3期)2022-08-22蒙药治疗慢性结肠炎的临床疗效分析中国典型病例大全(2022年9期)2022-04-19微小RNA在先天性巨结肠中的研究进展天津医科大学学报(2021年4期)2021-08-21空腹生吃鱼腥草治结肠炎恋爱婚姻家庭·养生版(2018年5期)2018-05-14憩室炎,藏在肚子里的神秘疾病医食参考(2017年12期)2017-04-01一例猫巨结肠症的诊疗中国动物保健(2015年4期)2015-10-21蒙药治疗溃疡性结肠炎46例临床观察中国民族民间医药·下半月(2011年10期)2011-12-27肠疡宁汤治疗溃疡性结肠炎15例结肠镜象观察浙江中医杂志(2004年1期)2004-07-30本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0611/610019.html




