【www.zhangdahai.com--其他范文】
陶代菊,何 波,罗兴炜,沈志强
(昆明医科大学药学院暨云南省天然药物药理重点实验室,云南昆明 650500)
脑缺血再灌注(ischemia/reperfusion,I/R)损伤是临床常见疾病之一,脑缺血引起脑组织局部损伤,随着缺血时间的延长,脑组织可能会遭受水肿甚至神经元坏死等不可逆的损害[1]。脑I/R损伤是指脑组织发生缺血或缺氧后血流供应恢复造成的组织损伤,但这种脑血液循环的恢复并不伴随着正常功能的恢复[2]。研究发现,脑I/R会导致脑组织产生大量的氧自由基和炎症因子,促使细胞发生凋亡或坏死,进而加重脑组织损伤,引起功能障碍,甚至丧失生理功能[3-5]。目前,治疗此类损伤的主要方法是减少氧自由基和炎症因子的产生,但大多数治疗药物的疗效并不理想。因此,探索新的脑卒中治疗策略备受瞩目。
外泌体是细胞分泌的纳米级囊泡,电镜下表现为圆形或椭圆形的杯碟状囊泡结构,能通过旁分泌方式将囊泡中的内容物如蛋白质、脂质和核酸等传递到靶细胞从而调控靶细胞的功能,具有良好的生物相容性和低免疫原性,可以发挥抗凋亡、抗炎和抗纤维化及促进血管内皮细胞增殖和血管生成等作用[6]。外泌体作为一种自分泌物质可穿透血脑屏障[7],这使得通过修饰外泌体直接作用于缺血区成为可能。有研究表明,外泌体可通过降低氧化应激和线粒体功能障碍改善脑I/R损伤[8-9]。外泌体以其独特的优势成为治疗脑I/R损伤的靶点,但是外泌体治疗脑I/R损伤的机制尚未完全阐明。本综述就外泌体与脑I/R损伤之间的关系作系统回顾,为脑I/R损伤的治疗开拓新的思路。
1.1 分泌
外泌体是在晚期多囊泡内体与质膜融合后由细胞分泌的膜囊泡,可选择性地募集细胞内蛋白质、脂质和核酸[10],直径30~150 nm[11]。外泌体的生物发生始于质膜内陷形成初级内吞囊泡,随后这些囊泡相互融合,形成早期内吞体腔,特定的内容物在这一过程被并入内陷膜中,而胞质成分被吞噬和封闭在腔内囊泡(intraluminal vesicles,ILV)中,包含有多个ILV的晚期核内体被称为多泡体(multivesicular bodies,MVB)。MVB 腔内小泡可能从MVB限制性外膜内表面出芽[12]。外泌体分泌到细胞外需要ILV形成、防止MVB被降解和MVB与细胞表面的融合3个步骤;
当MVB与溶酶体融合时,它们的内容物包括ILV就会被降解;
晚期核内体和MVB也可与质膜融合,将其ILV作为外泌体释放到细胞外空间[13]。在中枢神经系统中,几乎所有细胞如神经干细胞[14]、小胶质细胞[15]、神经元[16]、星形胶质细胞[17]和少突胶质细胞[18]等均能分泌外泌体。
1.2 摄取
一旦外泌体分泌到细胞外后,将其携带的蛋白质、脂质和核酸内容物转移到靶细胞,实现调控功能,但受体细胞摄取外泌体的机制尚未完全阐明。外泌体的生物活性被各种类型的内吞作用调节,如吞噬作用[19]和大胞吞作用[20]及网格蛋白[21]、网格蛋白/小凹蛋白独立[22]和脂筏[23]介导的内吞作用。不同类型细胞内化外泌体的方式也不相同,大多数外泌体附着在非吞噬细胞的质膜上,而在吞噬细胞中,这些外泌体通过吞噬作用直接进入靶细胞,吞噬细胞比非吞噬细胞能更有效地内化外泌体[22]。
外泌体作为细胞间信号交流的媒介,随着近年来研究的深入,外泌体与脑I/R损伤之间有着密切联系。有研究发现,在短期脑卒中预后差的患者中血清外泌体微RNA(microRNA,miR)-328-3p的表达水平明显高于预后较好的患者;
脑I/R损伤模型大鼠给予预后差患者血清外泌体,加重大鼠脑I/R损伤,外泌体中miR-328-3p可能作为短期判断脑I/R损伤程度的生物指标之一[24]。有学者分离大脑中动脉闭塞再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)模型大鼠血清中的外泌体,对其进行蛋白测定发现,外泌体中生长停滞和DNA损伤诱导蛋白34(growth arrest and DNA damageinducible protein 34,GADD34)显著增加,给予GADD34抑制剂可减轻大鼠脑缺血损伤[25]。有研究收集肝I/R损伤模型大鼠血清外泌体,将其注射入正常大鼠体内后引起海马和大脑皮质损害[26]。Ye等[10,27]分离并鉴定了急性脑梗死和正常人血清分离的外泌体,将急性脑梗死患者来源的外泌体注射到MCAO/R模型大鼠,导致脑损伤加重和行为恢复不良,并促进脑部炎症发生。综上,当脑I/R损伤发生时,外泌体中miRNA表达失调,产生神经毒性,进一步加重脑损伤。
在细胞层面,糖氧剥夺/再灌(oxygen glucose deprivation/reperfusion,OGD/R)模型诱导的大鼠皮质神经元分泌的外泌体中miRNA表达失调,神经元源性外泌体以浓度依赖的形式降低了神经元的存活率并促进其凋亡,且显著抑制神经元树突的形成[28]。OGD/R预处理的大鼠小肠隐窝上皮细胞与皮质神经元细胞共培养,可导致皮质神经元的突触毒性、活性降低和神经元凋亡[29]。综上所述,在脑I/R损伤的病理过程中,大鼠皮质神经元分泌的外泌体中可能含有致病因子,该致病因子被其他细胞摄取后加重细胞损伤,从而导致疾病的加重。因此,针对外泌体内容物的靶点进行干预,可有效改善脑I/R损伤的症状。
外泌体中被脂质双分子层包裹的内容物分泌到细胞外后可免受蛋白酶和核酸酶的分解,其结构微小、容易透过血脑屏障并且具有低免疫原性[30]。这种特性提示,外泌体用于治疗脑I/R损伤具有一定优势。不同细胞来源的外泌体对脑I/R损伤展现出较好的治疗作用,机制包括干细胞来源外泌体促进神经血管单元重塑;
神经系统来源的星形胶质细胞、神经祖细胞和小胶质细胞分泌的外泌体能够促进神经发育和再生,维持神经稳态;
来源于血清和血浆的外泌体可以阻止血脑屏障被破坏,使活性氧(reactive oxygen species,ROS)生成减少,超氧化物歧化酶(superoxide dismutase,SOD)活性增加,改善了线粒体功能,从而降低氧化应激反应,减少脑梗死区域(图1)。并且针对外泌体结构和内容物的修饰也展现出了良好的治疗潜能。针对外泌体研究新的药物可能给脑I/R损伤患者带来一种新型的治疗策略。

图1 外泌体治疗脑卒中的可能机制.
3.1 干细胞来源外泌体通过抗炎、抗凋亡改善脑l/R损伤
外泌体可以从不同细胞中释放出来,不同细胞来源的外泌体在脑I/R损伤中发挥着不同的作用。干细胞因其具有多向分化潜能而受到广泛关注。但干细胞替代治疗时,到达损伤部位的干细胞很少,且干细胞在植入后存活时间短,难以达到预期疗效,故有学者将干细胞的分泌物用于脑I/R损伤的治疗,其效果优于干细胞替代本身[31-32]。有研究发现,干细胞分泌的外泌体通过调节大脑的细胞和微环境改善脑I/R损伤。来源于人骨髓间充质干细胞的外泌体通过尾静脉注射给脑I/R损伤模型大鼠,模型大鼠的学习和记忆能力得以改善,血清、皮质和海马中炎症因子白细胞介素1α(interleukin-1α,IL-1α),IL-2和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平明显降低,有效抑制神经细胞凋亡[1]。有学者将大鼠骨髓间充质干细胞来源的外泌体iv给予脑I/R损伤大鼠,减少了大鼠脑梗死面积,促进了大鼠神经血管单位重塑,并且诱导M1型小胶质细胞向M2型极化,从而改善炎症反应[33]。低氧预处理的干细胞与OGD/R模型小胶质细胞共培养后,可促进OGD/R模型小胶质细胞的存活,并抑制TNF-α,IL-1β和IL-6等炎症因子的表达,促进抗炎因子IL-10的表达;
抑制干细胞外泌体的分泌则明显减轻干细胞培养物对小胶质细胞的影响[34]。MCAO/R模型大鼠尾静脉注射间充质干细胞来源的外泌体,可通过逆转半胱氨酰白三烯受体2/细胞外信号调节蛋白激酶介导的小胶质细胞M1极化,抑制小胶质细胞炎症,促进大鼠髓鞘形成和神经元再生,显著提高大鼠的运动、记忆和学习能力[35]。综上,正常干细胞分泌的外泌体可通过调节大脑细胞微环境稳态和减少促炎因子的释放,改善炎症反应,阻止神经细胞凋亡,从而改善脑I/R损伤。
3.2 神经系统细胞来源的外泌体通过抗凋亡改善脑l/R损伤
神经系统中的细胞主要包括神经元和神经胶质细胞。神经系统细胞来源的外泌体中含有许多miRNA,在脑I/R损伤中发挥着重要作用,如表1所示。最近研究表明,正常神经系统细胞分泌的外泌体在脑I/R损伤修复中具有保护作用。有研究发现,星形胶质细胞来源外泌体通过靶向Toll样受体7下调丝裂原活化蛋白激酶/核因子κB通路,表明miR-34c在星形胶质细胞来源外泌体中发挥脑I/R损伤时的神经保护作用[36]。M2型小胶质细胞来源的外泌体中含有miR-137,直接靶向Notch信号通路,在体外减少OGD处理神经元的凋亡,维持神经稳态,并且在体内改善脑I/R损伤小鼠的脑梗死体积和行为缺陷[37]。MCAO模型大鼠侧脑室注射小鼠脑微血管内皮细胞分泌的外泌体,大鼠的神经行为明显改善;
给予外泌体后,神经祖细胞迁移和增殖增加,凋亡减少[38]。M2小胶质细胞衍生的外泌体中过表达miR-124,可通过抑制下游目标蛋白特异性蛋白酶的表达减轻缺血性脑损伤,并促进神经元存活[39]。综上所述,神经系统细胞来源的外泌体能改善神经通讯,促进神经元增殖并抑制其凋亡,减轻脑I/R损伤。
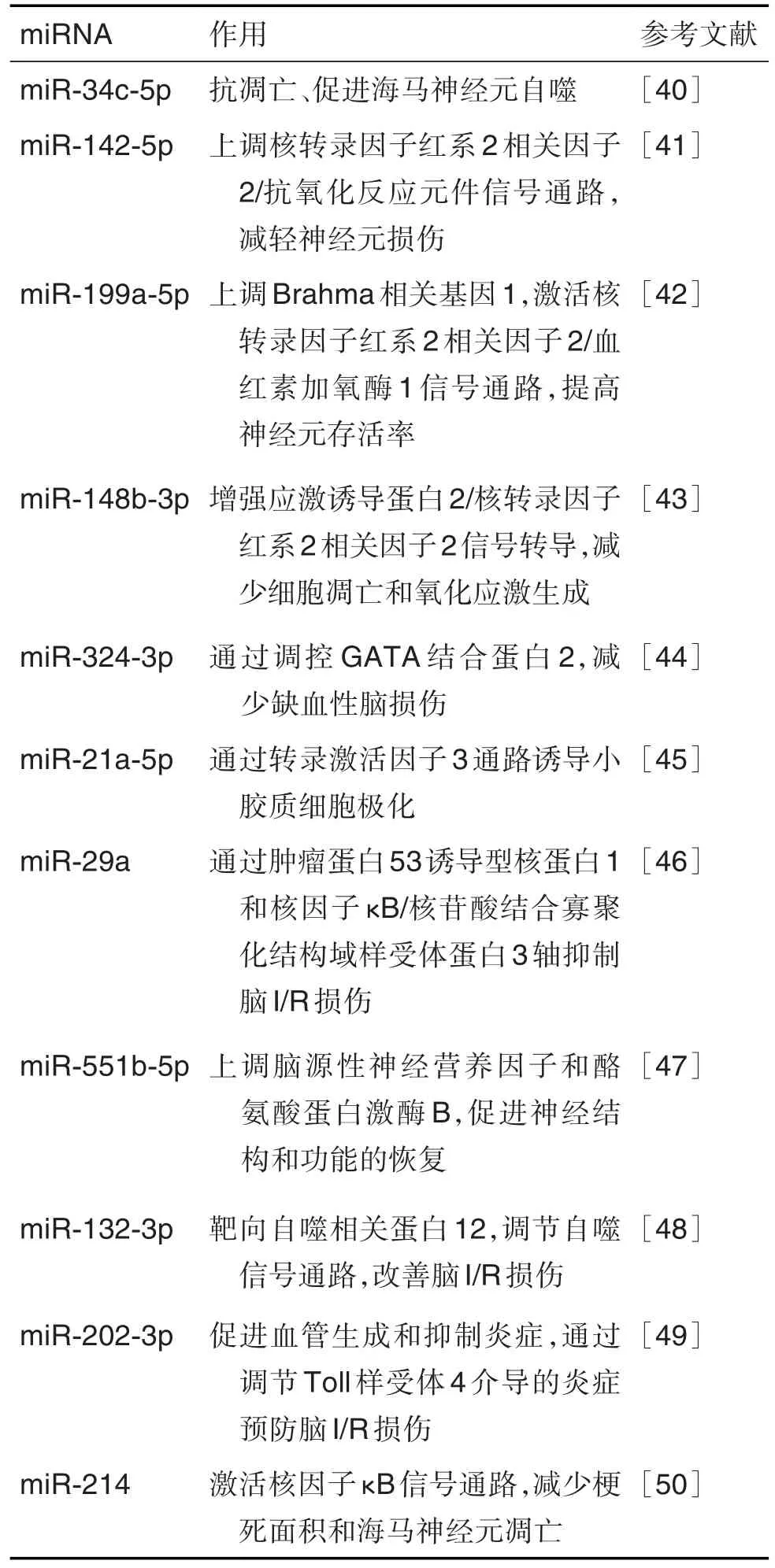
表1 外泌体微RNA(miRNA)在脑缺血再灌注(l/R)损伤中的作用
3.3 其他组织细胞来源的外泌体通过抗氧化应激和抗炎改善脑l/R损伤
人血液中也含有大量外泌体,研究证实,血液中的外泌体具有抗脑I/R损伤活性。I/R损伤模型小鼠脑注射血浆来源外泌体后,脑组织ROS生成减少,SOD活性增强,可阻止血脑屏障的破坏,抑制细胞凋亡,缓解小鼠脑I/R损伤[7]。从大脑缺血预处理的小鼠血清中提取外泌体并与OGD/R模型小鼠来源的神经瘤母细胞共培养能有效减轻炎症、凋亡和氧化,保护小鼠来源神经瘤母细胞免受OGD/R诱导的损伤,并且在外泌体中miR-451a过表达,抑制炎症和氧化发生[51]。有研究发现内皮细胞衍生的外泌体通过促进细胞生长、迁移和抑制细胞凋亡,直接保护神经细胞免受I/R损伤[52]。综上所述,血液中的外泌体可通过影响ROS生成、提高SOD活性、阻止血脑屏障破坏和减轻炎症等机制改善脑I/R损伤。
3.4 结构修饰的外泌体在脑l/R损伤中的应用
应用生物学技术可以对外泌体进行结构修饰[53],包括化学连接体、蛋白质、脂质和核酸等[54]改变外泌体特定的物质,或使用组织工程技术定量密集外泌体,可以有效治疗脑I/R损伤。从大鼠全血中分离出外泌体,将槲皮素和抗GAP43单克隆抗体整合到外泌体中,通过激活核转录因子红系2相关因子2/血红素加氧酶1(heme oxygenase-1,HO-1)通路明显减少OGD诱导的人神经瘤母细胞损伤;
将其注射入MCAO/R模型动物体内,可明显增加其在大脑中的递送,促进大鼠缺血区细胞存活,并显著抑制ROS产生[55]。过表达miR-223-3p大鼠骨髓间充质干细胞来源的外泌体可减少MCAO/R模型大鼠脑梗死体积,改善神经功能缺损,促进大鼠学习和记忆能力,并促进缺血皮质和海马中抗炎因子的分泌,体外外泌体miR-223-3p以浓度依赖的方式抑制NMLTC4诱导的M1小胶质细胞生成,并促进M2小胶质细胞转化[56]。有研究从转染miR-26a-5p的骨髓间充质干细胞中分离出外泌体,并将其注射到MCAO模型小鼠体内显著减少小鼠脑梗死体积,这种外泌体与OGD/R诱导的小鼠小胶质细胞共培养后能抑制细胞周期蛋白依赖性激酶6表达,明显降低细胞凋亡[57]。将晚期糖基化终产物拮抗肽RBP-Lamp2b-HA转染到人胚肾细胞中,获得分离外泌体,并将其开发为一种低氧特异性载体,用于抗miRNA寡核苷酸的鼻脑递送。该外泌体与经缺氧处理小鼠来源的神经瘤母细胞共同孵育,可明显减少晚期糖基化终产物受体阳性细胞的数量,这种外泌体通过鼻腔内滴注的方式给予到脑I/R损伤模型大鼠,可降低促炎因子TNF-α表达,同时减少细胞凋亡和梗死体积[58]。
多项实验结果表明,外泌体可作为脑I/R损伤的潜在标志物,但在针对外泌体纯化和稳定提取方面仍有诸多困难。超滤技术在处理和分析人类血液来源的外泌体中展现出巨大的潜力,但所使用的设备影响其分离效率[59]。虽然针对外泌体的提取和鉴定技术尚处于发展阶段,但随着技术的不断进步,传感器与微单元集成更加多功能化[60],等离子体传感器可对生物目标进行实时且无标记的检测,具有前所未有的灵敏度和检测极限。它们不仅能使外泌体得以分离,而且还可在传感器上进行现场分析[61]。未来,新的外泌体提取、分离和鉴定技术有望在脑I/R损伤中得以应用。
不同细胞来源的外泌体中多种活性成分展现出了明显的改善脑I/R损伤能力,外泌体具有低免疫原性、无毒和靶向细胞摄取内化的特点,对其进行结构修饰包载药物可将药物定向摄取到病变部位,将会极大程度提高该类药物在脑I/R损伤治疗中的地位。虽然外泌体治疗脑I/R损伤的研究大多停留在基础研究阶段,但目前已经有制剂进行临床实验并取得预期效果。尽管已对外泌体进行了大量的研究,但关于其中存在的分子成份、功能和作用机制及其分泌和摄取等环节的诸多问题仍有待回答。通过生物工程技术使外泌体携带有功能性的miRNA,长链非编码RNA和环状RNA用于防治脑I/R损伤,将为脑I/R损伤的治疗提供新策略。
猜你喜欢 外泌体胶质来源 将来吃鱼不用调刺啦学苑创造·A版(2022年5期)2022-05-19外泌体miRNA在肝细胞癌中的研究进展昆明医科大学学报(2022年2期)2022-03-29星形胶质细胞-神经元转化体内诱导研究进展昆明医科大学学报(2021年3期)2021-07-22间充质干细胞外泌体在口腔组织再生中的研究进展昆明医科大学学报(2021年5期)2021-07-22负载化疗药物的外泌体对肝癌的靶向治疗研究天津医科大学学报(2021年3期)2021-07-21循环外泌体在心血管疾病中作用的研究进展老年医学研究(2021年6期)2021-03-09研究神经胶质细胞的新兴技术神经损伤与功能重建(2020年10期)2020-12-23人类星形胶质细胞和NG2胶质细胞的特性神经损伤与功能重建(2020年11期)2020-12-01试论《说文》“丵”字的来源汉字汉语研究(2019年2期)2019-08-27“赤”的来源与“红”在服装中的应用流行色(2018年11期)2018-03-23本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0716/626069.html