【www.zhangdahai.com--其他范文】
叶 卓,吉墨轩,刘定斌
(1.河南师范大学化学化工学院,新乡 453007;
2.南开大学化学学院,药物化学生物学国家重点实验室,天津 300071)
世界范围内约有三分之一的疾病致死是由心血管疾病(Cardiovascular disease,CVD)引起的[1,2].人体许多内外因素都会导致CVD的患病率增加,这些因素包括高血压、高血脂、糖尿病、吸烟和缺乏运动等[3,4].除了这些风险因素之外,社会人口的老龄化进一步加剧了CVD的发生,给人类健康带来严峻挑战[5].动脉粥样硬化(Atherosclerosis,AS)是CVD的始动因素.AS的典型特征是动脉冠脉壁处的脂质斑块积累而导致血管腔显著狭窄[6,7],而积累在这些狭窄处的斑块会在某些情况下突然破裂或遭遇侵蚀后形成血栓而加速病情发展[8~10],从而引起急性冠状动脉综合征(Acute coronary syndrome,ACS)导致死亡[11].已知AS斑块的病理学结构错综复杂,通过动脉内成像进行诊断非常具有挑战性.尤其是存在大量相关血栓时,任何传统侵入性检测都会减少或阻碍血液灌注,从而导致心肌损伤和心力衰竭[12].因此,开发用于早期检测和成像AS的新策略有助于早期CVD的及时干预,能够最大限度减少严重CVD致死事件的发生[13].
光学探针成像是一种非侵入性的实时检测疾病发生和发展的方法[14~17],可用于病理分子事件的原位纵向监测,这是基于静态分析的体外诊断方法难以实现的.虽然单光子发射计算机断层扫描(Singlephoton emission computed tomography,SPECT)、对比增强计算机断层扫描(Contrast enhanced computed tomography,CECT)、磁共振成像(Magnetic resonance imaging,MRI)和超声成像(Ultrasonic,US)被广泛用于AS斑块成像,但这几种诊断方法主要用于检测动脉的解剖结构和功能异常,难以观察到疾病相关分子事件的动态变化[18].相比之下,光学探针成像提供了高时空分辨率和极高的灵敏度[19~22],可以通过光学信号的探测评估疾病部位生物靶标浓度的细微变化[23,24].近年来,光学探针成像在其种类和功能方面取得了长足进展,使得科研人员和临床医生能够更细致入微地观测生命系统,以呈现基础的解剖学结构[25],探究特定的生物或化学分子靶标[26],并解释各种复杂的分子和细胞机制[26,27].基于此,本文重点介绍了近年来用于AS检测与成像的光学探针的研究进展,探讨了不同类型光学探针的优缺点,并对AS的光学检测与成像的前景进行了展望.
分子成像使得亚细胞到活体层面的生理和病理过程得以可视化,为临床诊断和治疗提供了强大的工具[17,24,26,28~34].传统的成像方法,如计算机X射线断层扫描(X-ray computed tomography,X-CT)[35,36]、MRI[37~39]、US[40,41]和核医学成像(如Positron emission computed tomography,PET)目前仍然是临床分子成像的主流[42~47].尽管如此,新兴的荧光成像技术可以广泛地扩展分子成像的能力,提高病理过程分子事件监测的准确性和灵敏度[48].特别是依赖于非侵入性光-组织相互作用进行可视化读出的小分子荧光探针成像,因其高特异性、高时空分辨率、低成本和易获取而在临床前和基础研究中发挥着不可或缺的作用.
在AS的核心区域,单核巨噬细胞浸润血管壁,随后在氧化低密度脂蛋白(Oxidized low-density lipoprotein,Ox-LDL)刺激下转变成泡沫细胞[49].泡沫细胞的特征是胞质脂滴(Lipid droplets,LDs)的异常积累,被认为是AS病变所有发生发展阶段的标志性事件[50].Chen课题组[51]为脂肪肝和AS LDs的特异性成像设计了“off-on”型荧光探针.受此启发,Sang等[52]设计了一种具有高响应性和强渗透性的LDs可激活探针,用于特异性识别AS斑块中的泡沫细胞[图1(A)和(B)].在手术过程中将CN-N2贴片贴敷到暴露的血管表面后,能在5 min内对斑块进行稳定成像.此外,作者还发现围绕泡沫细胞的荧光探针成像可以快速准确地描绘斑块的边缘和大小[图1(C)].此外,将CN-N2贴片直接原位贴敷在动脉上,能有效减少探针的全身暴露.因此,这种荧光探针成像的背景信号比较微弱,信噪比显著提高,有利于颈AS斑块的手术勾画.
为了进一步提高AS脂质成像的特异性,Zheng等[53]报道了一种名为IND的智能小分子荧光探针[图1(D)],可以特异性地靶向细胞和组织中的脂质.作者发现,IND还可以作为一种简单方便的双光子探针用于染色动脉粥样硬化斑块中的脂质,甚至可以在不进行切片的情况下进行组织脂质的高分辨率成像和定量.值得注意的是,IND分子作为特殊的二聚体堆积在水相介质中,具有增强和红移的荧光发射.这使得探针能够在单一激光的激发下对脂质和水进行双色成像[图1(E)],以揭示动脉粥样硬化斑块的超微结构.
目前,用于AS斑块识别的探针通常依赖于LDs标记.然而,这些探针也可以对其它富含脂质的组织和器官(如动脉壁和肝脏)进行非特异性染色,这使得在临床上利用其精确识别AS斑块是不切实际的.最近,本课题组[54]提出了第一个双靶标顺序激活荧光传感系统,称为顺序高特异性双报告分子解锁(In-sequence high-specificity dual-reporter unlocking,iSHERLOCK),该系统允许在体内成像和离体识别AS模型小鼠主动脉中的AS斑块.基于合理设计的荧光探针具有独特的三合一特性,可选择性检测LDs和HClO(分别是AS斑块中脂质积累和氧化应激的指标)[图2(A)].通过同时分析LDs和HClO,iSHERLOCK不仅提供了主动脉中AS斑块的分布信息,还报告了这些斑块中脂质积累和氧化应激的水平[图2(B)],同时避免了由单一指标(LDs或HClO)检测带来的不确定性.iSHERLOCK有望转化为AS精准组织活检的临床诊断平台.

Fig.1 Lipid-responsive small molecule fluorescent probe
除了广泛利用脂质(或LDs)作为AS检测成像的靶标外,HClO以及相关酶类也是评估AS状况的重要靶点.Hou课题组[55]描述了一种基于香豆素衍生的荧光探针AS-ClO,其端部带有三苯基膦(TPP)作为线粒体定位的靶向基团.如图3(A)所示,该探针是由含有哌嗪的苯并噻嗪-香豆素通过简单步骤合成的.当AS-ClO被HOCl氧化后可以显示出增强的荧光变化,从而能够在AS泡沫细胞的线粒体中灵敏地检测HOCl[图3(B)].另外,Ogawa等[56]设计了一种新型的近红外荧光可激活探针Peptide-ICG2,荧光由多肽连接的2个吲哚菁绿(ICG)荧光分子相互堆积而被猝灭[图3(C)].当Peptide-ICG2被溶酶体酶—组织蛋白酶B(Cathepsin B)裂解以解除多肽的猝灭效应时,可以检测到强烈的近红外荧光.由于组织蛋白酶、半胱氨酸蛋白酶和基质金属蛋白酶由巨噬细胞分泌,通过降解动脉内膜上富含胶原的纤维帽基质,在斑块的脆弱性中发挥重要作用.这些蛋白酶的活性可以作为AS斑块易受栓塞影响的指标.
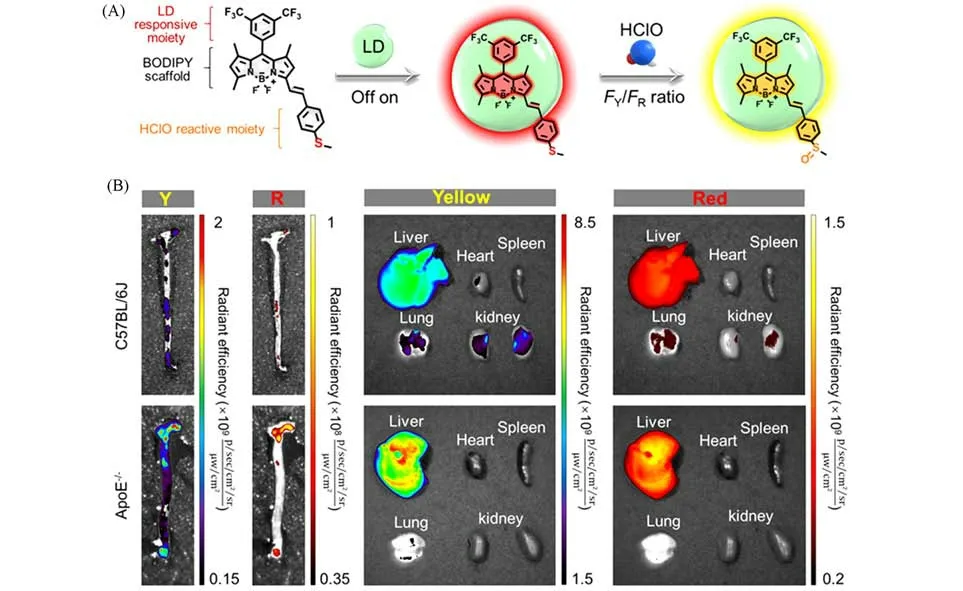
Fig.2 Dual-target responsive small molecule fluorescent probe[54]

Fig.3 Other types of responsive small molecule fluorescent probes
小分子荧光探针能够为AS的诊断成像带来更好的响应性、特异性和精细度,但由于分子化学合成本身的局限性,很难将同时具备上述优点的小分子探针的发射波长推进到近红外Ⅰ区及以上.因此,利用小分子进行AS活体成像几乎是不可能的,其更多用于离体组织成像和细胞层面的机制研究.

Fig.4 AIE probe for early imaging of AS plaques[60]
AS的高质量荧光成像需要具有高亮度和光稳定性的发光剂.然而,大多数传统荧光材料在生物系统中容易在高浓度下发生聚集而导致荧光猝灭[57].近年来开发的聚集诱导发射发光体(Aggregate-induced emission luminogens,AIEgens)是一种新型的荧光分子,其溶解时不发光,但在聚集状态下发出强烈的荧光[58,59].增强的发射和改进的光稳定性使AIEgens成为AS成像的绝佳候选.
最近,Ding等[60]开发了一种具有高荧光亮度和出色靶向能力的新型AIE纳米探针用于AS成像.具体而言,为了获得在近红外(NIR;
λ>650 nm)区域具有强发射的荧光探针,通过精细的分子手术策略合成了一系列基于罗丹宁衍生物的AIEgens[图4(A)].选择最佳的AIEgens—TPE-T-RCN进行自组装以配制水溶性纳米探针,然后用抗CD47抗体修饰以靶向AS斑块.当对AS模型小鼠静脉给药后,抗体纳米探针可以特异性地侵染斑块区域,实现对早期和晚期斑块的精确检测.此外,基于AIE纳米探针的荧光成像可以在显微CT和MRI之前对斑块进行早期诊断并监测抗AS药物的治疗效果[图4(B)].
为了对动物体内的脂质斑块进行活体成像,可以采用多光子显微镜[61].与单光子共聚焦显微镜相比,多光子成像可以提供具有高时空分辨率的3D体内生物组织成像.此外,近红外区域的激发光比紫外-可见光更能穿透生物组织,有利于深层组织成像[62].基于此,Liu等[58]设计并合成了2种三光子AIEgens—TPACN和TPAPhCN,用于体内脂质成像.二者在远红外/近红外区域发射荧光并具有高量子产率,相应的纳米粒子在几种癌细胞和巨噬-泡沫细胞中显示出高特异性的LDs标记.此外,TPAPhCN纳米粒子[图5(A)]在NIR-II飞秒激光下表现出优异的三光子激发效率.随后,对小鼠富含脂质的组织进行了活体三光子荧光成像,包括脑血管系统中的脂肪组织和AS斑块,以及颈动脉AS斑块[图5(B)],证明了TPAPhCN纳米粒子具有优异的体内脂质标记与成像能力.
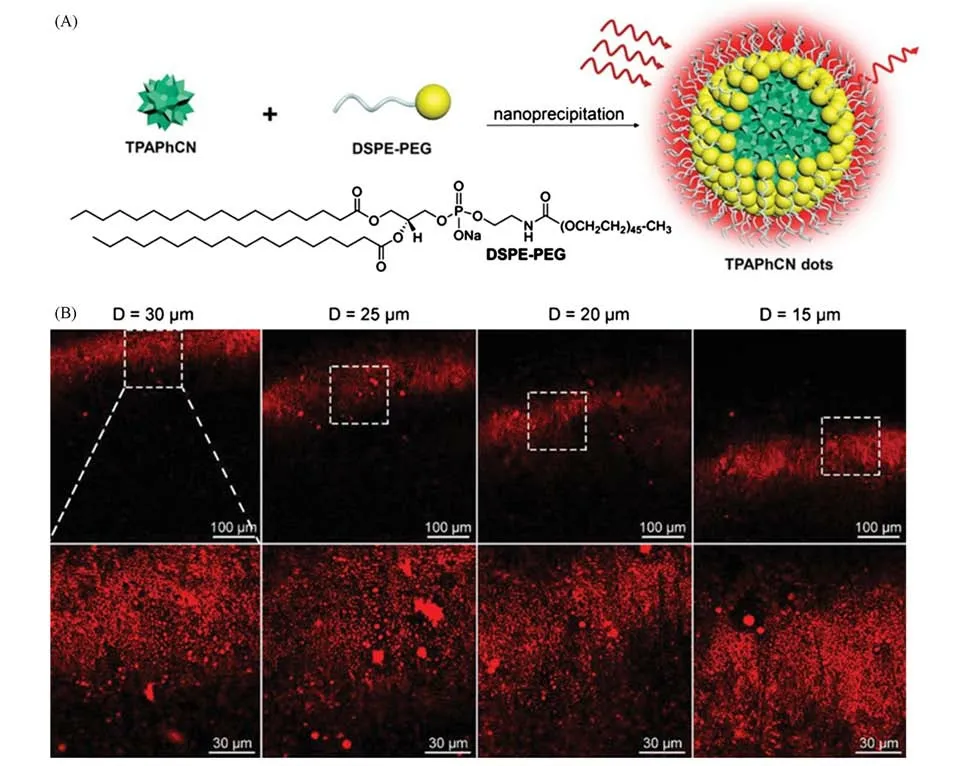
Fig.5 Three-photon AIE probe for deep AS plaque imaging[58]
AIEgens固然是一种天然绝佳的AS脂质成像探针,但也限制了此类探针在AS诊断领域的应用.因为与AS诊断相关的靶标(机制)是复杂多样的,单一的脂质检测无法适应多样化的病理研究;
而且AIEgens对于分子结构特性的限制导致诊断应具备的响应性和特异性也难以实现.
量子点(Quantum dot,QD)是一种具有独特光物理性质的材料,如尺寸依赖性的荧光发射行为[63,64].与有机染料相比,QD具有明显的光学特性优势,如优异的光亮度、出色的光漂白稳定性和窄光谱峰宽[65].利用QD的这些特性,结合QD表面化学修饰引起的光致发光性质的变化,开发了具有各种用途的光学传感器[66].目前,大部分研究主要集中于QD的离子和小分子传感系统,其主要利用荧光共振能量转移或电子转移过程来实现.QD纳米材料在分析领域和生物传感系统中表现出巨大的应用潜力[67,68].
Cui等[69]开发了封装近红外QD(QD800)并带有AS靶向元件和凝血酶抑制剂Hirulog的多功能探针SV40 VLP[图6(A)].借助这种基于SV40病毒的多功能纳米颗粒(VNP),SV40 VLP探针能够在活体ApoE-/-小鼠中无创地靶向和荧光成像AS斑块[图6(B)和(C)].当使用不同的分子识别元件(如血管细胞黏附分子-1、巨噬细胞和纤维蛋白)来检测不同阶段的AS标志物时,可以在动脉中靶向不同时期的AS斑块.另外,SV40 VNP还能向AS斑块选择性输送高浓度的抗凝药物Hirulog.

Fig.6 Quantum dot probes for in vivo imaging of AS[69]
QD探针与AIE纳米探针具有相似的缺陷.QD本身具有优异的光致发光能力,光稳定好且难以猝灭,其响应性及特异性的实现受限于屈指可数的几种能量转移机制,对于复杂多样的AS诊断成像研究缺乏足够的适用性.
与有机染料和量子点相比,上转换发光纳米粒子(Upconversion luminescent nanoparticles,UCNPs)具有高光稳定性、多波长发射、大的反斯托克斯位移和极弱的背景噪声等优点[70],这对于从根本上提高体内成像的灵敏度是非常有效的[71,72],因此,UCNPs的发展也为开发高效的AS成像工具带来了希望[73~75].
为了改善AS成像的灵敏度和特异性,受上转换发光相对较深的组织穿透能力(3~5 cm)的启发[76],Gao等[77]报道了一种用于可视化易损斑块的UCNPs探针.由于其独特的光学和固有顺磁特性,Yb,Er掺杂的Gd基纳米粒子(如NaGdF4∶Yb,Er上转换纳米粒子)在肿瘤多模态成像和治疗中引起了广泛关注[78~80].另一方面,骨桥蛋白(Osteopontin,OPN)的表达与巨噬-泡沫细胞含量密切相关,并且在易损斑块的进展中起关键性作用(包括招募白细胞、增加其活力以及诱导细胞因子和MMP表达[81,82]).通过将巨噬-泡沫细胞特异性的OPN抗体与高发光核壳型NaGdF4∶Yb,Er@NaGdF4纳米颗粒共价结合,构建了一种巨噬-泡沫细胞特异性分子探针,用于AS成像[图7(A)].同时,作者还构建了颈动脉剪切应力变化的动物模型,用于诱导稳定和易损AS斑块.通过将体内成像研究与体外免疫组织化学分析相结合,发现OPN在易损的AS斑块中的表达比稳定斑块更多[图7(B)和(C)].

Fig.7 Upconversion luminescent nanoparticle probe for in vivo imaging of AS[77]
UCNPs能够在激发端显著提高成像的灵敏度和穿透深度,但对于发射端的成像能力提升有限,其灵敏度和穿透深度仍然依赖于UCNPs的发射波长.另外受制于UCNPs材料本身的光吸收能力和长程能量转换效率,其临床实践应用仍有很长的一段路要走.
光声(Photoacoustic,PA)成像是一种新兴的生物医学诊断方法,结合了光学成像的高灵敏性和超声成像较深的穿透深度,具有高的空间分辨率和良好的组织对比度[83,84].AS的PA成像主要集中在动物模型和体外研究,借助商用血管内超声导管[85,86]对动物血管内斑块进行成像[87,88].另外,单纯的体外研究并不能充分证明PA成像在更真实的包含血液和复杂组织的环境中的成像可行性,而体内PA成像是一种侵入性的诊断方法,这给直接识别活体组织中的易损斑块带来了很大的危险性.近红外纳米探针的出现为克服上述缺点提供了很好的解决方案.近红外纳米探针通常具有优异的光吸收系数,即使在面临强背景干扰的情况下,也能显著提高PA成像的灵敏度[89~92].同时,各种功能性分子与纳米探针的结合使得在分子水平进行非侵入性诊断这一愿景得以实现.

Fig.8 ROS responsive PA probe for in vivo imaging of AS[96]
近年来已经报道了一些光声探针用于AS的检测与成像[93~95].Zhang等[96]开发了一种新的比率半导体聚合物纳米探针,用于AS斑块内O2-水平的光声成像.通过纳米沉淀法将疏水性·O2-响应性分子、疏水性·O2-不敏感半导体聚合物分子和两亲性聚合物(DSPE-PEG2000)自组装成RSPN[图8(A)和(B)].值得注意的是,比率光声成像(PA690/PA800)使RSPN能够可靠地显示溶液或生物体系中的·O2-,可以有效地克服外界因素(如基质干扰和探针局部浓度等)的干扰.重要的是,RSPN不仅可以靶向聚集到AS区域,而且可以动态评估易损斑块的氧化应激水平,从而为预测AS斑块的易感性,特别是为AS合并肺炎提供了一种无创的工具[图8(C)].
AS斑块形成、发展和破裂直接与局部炎症有关,特别是与巨噬细胞的激活有关.巨噬细胞激活会产生大量的活性氧物种(ROS)并扰乱氧化还原稳态.为了量化斑块特有的氧化还原状态,Tang等[97]利用2种分子荧光探针,即用于GSH检测的Cy-3-NO2和用于H2O2检测的Mito-NIRHP,并引入牛血清白蛋白(BSA)进行自组装,制备出用于体内氧化还原状态成像的BSA-Cy-Mito PA纳米探针[图9(A)].此探针在765和680 nm处显示出强烈的GSH和H2O2依赖性吸光度,可同时光声检测低至亚微摩尔浓度的GSH/H2O2.利用BSA-Cy-Mito可准确检测Ox-LDL激活的巨噬细胞和高脂饲料喂养的ApoE-/-小鼠的氧化还原相关炎症过程.此外,此探针还可以根据斑块中H2O2含量和氧化还原状态的不同来区分易损斑块和稳定斑块[图9(B)].

Fig.9 Dual-target responsive PA probe for in vivo imaging of AS[97]
易损AS斑块是造成急性CVD事件的主要原因.然而,临床方法尚不能直接在分子水平上识别易损的AS斑块.Zheng等[95]利用Ti3C2纳米片/吲哚菁绿(Ti3C2/ICG)纳米复合材料作为PA纳米探针开发了一种无创PA成像平台,实现了易损AS斑块的直接体内可视化成像[图10(A)和(B)].Ti3C2纳米片和ICG均具有优异的PA成像能力.此外,Ti3C2纳米片具有较大的比表面积,可作为纳米载体负载大量的疏水ICG分子,从而赋予Ti3C2/ICG纳米探针显著增强的PA性能.为了提高探针识别易损斑块特异性,选择在AS易损斑块的泡沫细胞中过表达的OPN作为靶向位点.在纳米复合材料上修饰OPN抗体(OPN Ab),形成OPN Ab/Ti3C2/ICG纳米探针,实验结果表明,该探针具有优异的AS易损斑块成像诊断能力[图10(C)和(D)].
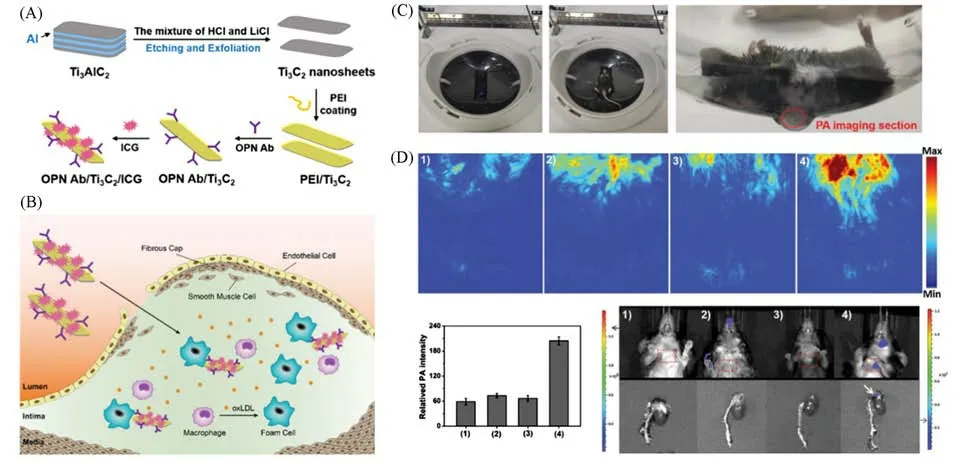
Fig.10 Targeted PA probe for in vivo imaging of AS[95]
PA成像集合了荧光与超声两大成像技术的优点,是目前最有希望应用于临床研究的光学成像技术之一.但同时也必然会具有两种成像技术的缺点,比如激发端荧光的有限穿透深度和接收(发射)端超声的低分辨率.
临床应用中的成像手段通常包括MRI,CT,US,PET和SPECT等.每种成像技术都有其独特的优势以及无法避免的缺陷,如MRI不受成像深度限制,但其灵敏度和空间分辨率不足,导致难以在病灶部位获得准确可靠的病理信息[98].为了弥补这一缺陷,Optical/MRI或Optical/CT等多模态成像技术的联用已引起研究人员的兴趣,这种多模态方式可以提供多维的病灶信息,显著优于目前用于疾病诊断的单一成像手段.如光学成像提供病理分子事件的精确描绘,PET成像能高灵敏的反应组织器官的功能性变化,CT和MRI可以为解剖学特征提供高分辨率和更深入有机体的图像.如果将这些不同的成像技术组合在一起,就可以同时实现高灵敏度、高分辨率和高穿透深度,得到AS病灶中更丰富详细的生理学和解剖学信息[99].
促炎的M1型巨噬细胞是引起AS易损斑块恶化的重要成分[100,101].Gao课题组[102]通过缩合反应将多克隆MARCO抗体缀合到NaGdF4∶Yb,Er@NaGdF4纳米探针的表面,构建了抗MARCO NaGdF4∶Yb,Er@NaGdF4UCNPs[图11(A)].此UCNPs具备高度的单分散性,平均尺寸为(26.7±0.8)nm,拥有良好的生物相容性.活体内的上转换光学成像显示,注射10 min后在颈动脉区域可以观察到独特的荧光信号,在注射1 h后达到峰值,并在之后的24 h内降至基线[图11(B)].另一方面,通过7.0 T MRI测定,在注射抗MARCO UCNPs后,颈动脉在T1加权MR图像上显示出高信号强度.颈动脉组织切片的免疫荧光染色显示MARCO在斑块的肩区显著上调.因此,抗MARCO UCNPs是一种很有前景的光学/MRI双模态成像探针,可以无创地成像体内AS斑块及其相关M1型巨噬细胞的行为.
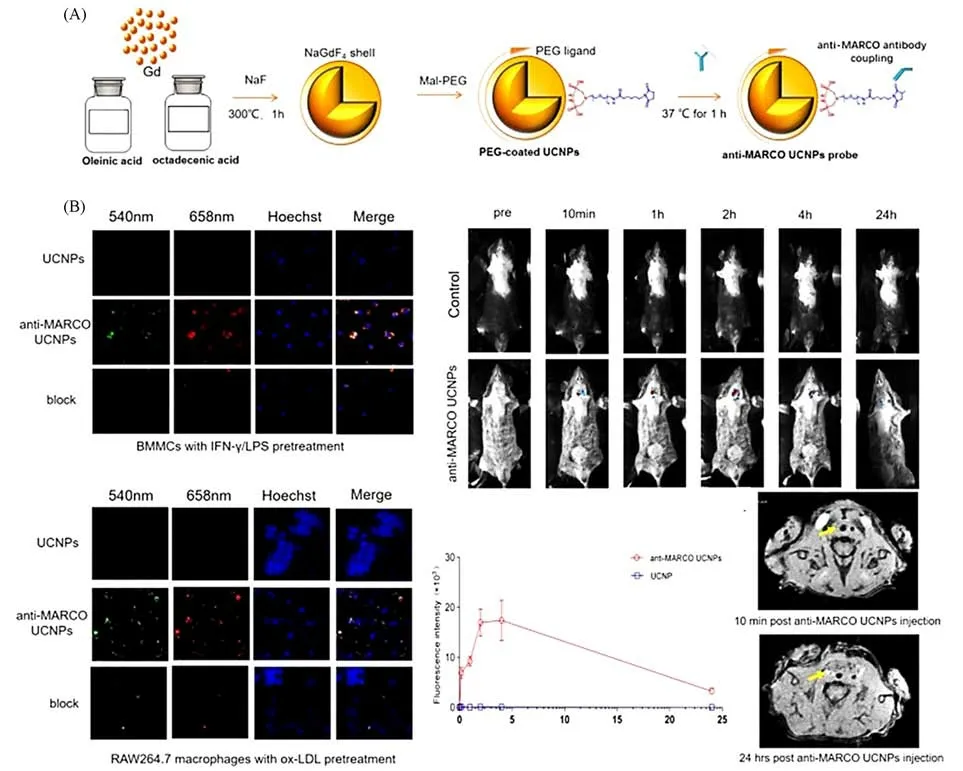
Fig.11 Multimodal probe for in vivo imaging of AS[100]
多模态成像技术集众家所长,是目前最完善的成像解决方案.但其合成制备路线繁琐冗长,不利于实际推广应用.
AS及其相关疾病,每年都造成了巨量的人财损失,越来越引起多方面的重点关注.光学探针成像对于推动生命科学和医学的发展意义重大,能够以极佳的时空分辨率实现各种生物靶标的精细可视化,并对复杂多样的生理和病理过程进行实时监测.此外,光学探针成像对于临床前的研究和临床中的应用也发挥着重要作用,可以实现更精准、高效的疾病诊断,进而改善患者的整体预后和治疗效果.为了提高光学探针成像的分辨率、灵敏度、穿透深度、准确度和采集速度,研究人员在探针设计和成像方式等方面进行了创新和改进,本文总结了近年来几种被广泛应用的光学探针成像技术,及其在检测、成像和诊断AS方面的优势和不足.基于目前的研究工作和进展,提出以下建议:
(1)开发高效的活体非侵入性光学成像手段仍然是重中之重.绝大部分光学探针的工作波长刚刚到达近红外区,这对于AS的活体成像还远不足.因此,开发具有高穿透深度、高分辨率、高信噪比的成像技术,以及能够响应病灶区微环境、避免非特异性富集的成像探针,将是下一代疾病成像解决方案的基础.
(2)多靶标的同时检测仍然是未来疾病诊断与成像的发展方向.如何进一步拓展此类探针的设计和制备方法是根本的解决之道.显然,仅依赖单分子探针会有难以避免的局限性;
而纳米探针的高度丰富性与可调性为解决这一困境带来了更多的可能.
(3)光学成像技术可无创性提供分子靶标信息,对组织、细胞的病理过程进行可视化分析.然而,单一成像手段难以同时满足疾病监测所需要的高时空分辨率、高灵敏度和无穿透深度限制等条件.结合光学成像的多模态成像技术整合了多种成像技术的优势,并能规避单一成像策略的不足,能达到多维度诊断疾病目的.
(4)AS易损斑块是造成严重CVD事件的主因.围绕易损斑块的快速鉴定与检出,是临床及时干预、降低致死致残率同时避免过度治疗的关键.开发能够准确迅速地检测易损斑块的手段或方法,对于克服AS的“阿喀琉斯之踵”不言而喻.
猜你喜欢 易损探针脂质 基于FANUC数控系统的马波斯探针标定原理及应用装备制造技术(2020年1期)2020-12-25探究CT诊断冠状动脉易损斑块价值及危险因素中国医疗器械信息(2020年12期)2020-10-16复方一枝蒿提取物固体脂质纳米粒的制备中成药(2018年9期)2018-10-09姜黄素诱协同阿托伐他汀稳定易损斑块的作用与机制天然产物研究与开发(2018年2期)2018-04-04白杨素固体脂质纳米粒的制备及其药动学行为中成药(2018年1期)2018-02-02更正声明中西医结合心血管病电子杂志(2016年30期)2017-05-27马钱子碱固体脂质纳米粒在小鼠体内的组织分布中成药(2017年4期)2017-05-17更正声明中西医结合心血管病杂志(电子版)(2016年30期)2016-01-20Les consommateurs peuvent-ils rendre des produits sortis de leur emballage ?中国与非洲(法文版)(2015年4期)2015-11-09川陈皮素固体脂质纳米粒的制备中成药(2014年9期)2014-02-28本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0728/631511.html




