【www.zhangdahai.com--其他范文】
周庆楠, 赵焕英, 蔡爽, 杨宁燕, 周焱, 尚佳健
1.首都医科大学附属北京口腔医院儿童口腔科,北京(100050);
2.首都医科大学中心实验室基因组学研究平台,北京(100069)
重度低龄儿童龋(severe early childhood caries,S-ECC)是指小于6 岁的儿童所患的严重龋病,存在患病率高、进展快的特点。儿童龋病的分布并非平均,而是存在患龋风险高的人群,即使在接受全口牙齿治疗后,仍有较高的龋病复发倾向,术后1年再发龋率可达59%[1]。乳牙列易患龋,也是恒牙患龋的危险因素,这部分患儿在混合牙列期乃至恒牙列期依旧存在患龋高风险。
S-ECC 的病因是多因素和复杂的,生态菌斑学说的提出表明,龋病的发生并不依赖于某一种特定的细菌,微生物间、宿主与牙菌斑间的相互作用共同维持微生态的动态平衡,龋病可能是由龋损不同阶段和部位的主要致龋微生物水平以及环境失衡决定的,菌群微生物群落结构和多样性的变化与龋病发生密切相关[2-3]。
全身麻醉下一次完成全口龋病治疗后,患儿口内的患龋状态可以得到迅速改善,恢复咀嚼效能,从微生物角度分析,普遍认为,口内微生物环境会在短时间内发生较大变化,但菌群微生物群落改建的过程、某些菌群在治疗后的早期定植等对于远期无龋状态维持的作用尚不明确。因此本研究拟利用16S rRNA 基因的高通量测序技术,分析在全身麻醉下一次完成龋病治疗的S-ECC 患儿治疗前、治疗后短期内菌斑微生物群落构成变化,从微生物学角度观察治疗对于群落动态改建的影响,以期为儿童龋病风险评估、龋病管理和防治等提供新的思路。
1.1 研究对象

菌群微生物多样性统计研究的样本量的计算参考调查幼儿菌斑细菌微生物群多样性的类似研究[4-5],旨为初步探究治疗后短期内牙菌斑微生物改建过程,依据α 多样性(Shannon 指数等)的平均值、稀疏曲线、测序深度覆盖及前期预实验观察结果,设定α=0.05,1-β=0.9,考虑失访率,每组拟纳入20 例S-ECC 患儿。无龋对照组1∶1 设定。纳入2020 年8 月—2021 年1 月期间在首都医科大学附属北京口腔医院儿童口腔科接受全身麻醉下龋病治疗的3 ~5 岁S-ECC 患儿20 例为龋病组。纳入经口腔检查无龋的20 名儿童作为对照组。纳入标准:龋病组:①乳牙列完整,既往充填体≤1;
②龋均(dmft)≥6;
对照组(caries-free,CF):经口腔检查无早期脱矿或白斑病变的临床证据[6],龋面均(dmfs)=0。排除标准:①治疗前3 个月内全身应用抗生素;
②系统性疾病史及遗传病史。本项目已得到首都医科大学附属北京口腔医院伦理委员会的批准(批号:CMUSH-IRB-KJ-PJ-2020-17),患儿家长知情同意,并自愿签署知情同意书。
1.2 研究方法
1.2.1 样本采集部位及方法 两组儿童均安排在早上进食和刷牙前采集龈上菌斑,时间为上午8∶00—10∶00。在采样前用清水、生理盐水交替冲洗口腔30 s(如随访复查过程中,遇患儿无法自主配合的情况,情绪安抚、家长陪同下,在采样前用清水漱口1 min),四手操作棉卷、吸唾器隔湿下,用无菌刮匙采集全牙列无龋部位龈上菌斑(除金属预成冠表面)。
采集样本置于装有0.2 mL ATL 缓冲液(pH=8.0,Zeesan,中国)的EP 管中,样本2 h 内置于-20 ℃保存,4 h 内转运至-80 ℃冻存备用。
1.2.2 牙齿治疗及术后随访 S-ECC 患儿在全身麻醉下一次完成全口龋病治疗,治疗结束后的7 d、1 个月、3 个月随访复查,进行菌斑采集,根据随访复查时间点分为龋病术前(C)、治疗后7 d(C-7D)、1 个月(C-1M)、3 个月(C-3M)。详细记录新发龋坏、继发龋坏、充填物脱落及并发症等情况。
1.2.3 高通量测序 室温下解冻临床收集到的菌斑样本,进行DNA 提取、纯化,筛选A260/A280 比值为1.8 ~2.0,浓度>20 ng/μL 的DNA 样品进行PCR扩增、建立16S rRNA 基因文库,应用Illumina Miseq平台进行双端测序,保留长度大于200 bp 的序列。
1.3 统计学分析
采取独立样本t检验对两组初诊月龄、性别进行比较;
获得有效序列后,对提取出的操作分类单元(operational taxonomic units,OTU)进行聚类分析(相似性设为97%);
应用SPSS26.0 对组间α 多样性指数进行单因素方差分析及组间多重比较;
筛选组间差异物种,经Kruskal-Wallis 非参数检验或单因素方差分析,Bonferroni 校正P值进行组间两两比较。检验水准α=0.05。
2.1 OTU 聚类
本研究共纳入S-ECC 患儿(C)和无龋儿童(CF)各20例,其中,S-ECC患儿组初诊月龄(50.77±8.87)个月,男10 例,女10 例;
无龋儿童组初诊月龄(48.80 ± 11.75)个月,男7 例,女13 例,两组月龄、性别差异无统计学意义(P>0.05)。C 组术前dmft为12.75 ± 2.86,dmfs 为27.50 ± 9.14,术前、治疗后7 d、1 个月、3 个月无著差异(P>0.05)。
共获得7 203 146 条高质量DNA 序列,共可识别287 个OTU,每一个OTU 代表一个物种,以组内50%以上样本内存在为OTU 筛选条件,作韦恩图(图1)。5 组共有74 个物种,各组存在特有OTU 序列,其中无龋组特有23 个OTU,物种组成更为多样。

Figure 1 Venn diagram of OTU of plaque microbial cimmunity before and after treatment in children with S-ECC图1 S-ECC 患儿治疗前后菌斑微生物OTU 韦恩图
2.2 微生物多样性水平
基于OTU 结果计算物种丰富度估计指数(Chao1)及物种多样性指数(Shannon-Wiener 和Simpson 指数)等评价微生物α 多样性水平常用的指标,统计学分析结果如图2 所示,组间α 多样性指数无显著性差异(P>0.05)。

Figure 2 Comparison of alpha diversity of plaque microbial cimmunity before and after treatment in children with S-ECC图2 S-ECC 患儿治疗前后菌斑微生物α 多样性指数比较
2.3 微生物群落物种构成分析
如图3 所示,共获得10 门,15 纲,28 目,45 科,84 属和99 种的物种分布信息。厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)五个菌门,是主要优势菌门;
链球菌属(Streptococcus)、纤毛菌属(Leptotrichia)、二氧化碳嗜纤维菌属(Capnocytophaga)、奈瑟菌属(Neisseria)、韦荣菌属(Veillonella)、梭杆菌属(Fusobacterium)、棒杆菌(Corynebacteriaceae)、放线菌属(Actinomyces)、嗜血菌属(Haemophilus)等16 种菌属占获得序列的80%以上,为主要优势菌属。其中链球菌属、纤毛菌属、二氧化碳嗜纤维菌属、韦荣菌属、放线菌属、嗜血菌属(Haemophilus)、弯曲菌属(Campylobacter)等的相对丰度在组间存在差异。
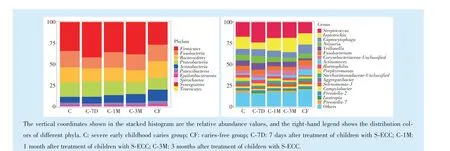
Figure 3 The relative abundance of phylum and genus of plaque microbial cimmunity before and after treatment in children with S-ECC图3 S-ECC 患儿治疗前后菌斑微生物门、属水平物种组成
观察差异菌属在组间的变化趋势。其中,链球菌属的相对丰度在S-ECC 患儿治疗前(C)和无龋儿童(CF)组间无显著性差异,在S-ECC 患儿治疗后7 d(C-7D)链球菌属相对丰度较治疗前显著增高,在术后复查各时间点,链球菌属在结构中所占比例均高于无龋儿童(CF)组(P<0.05)。在治疗后7 d,可以观察到S-ECC 患儿的纤毛菌属相对丰度水平低于其余各组(P<0.05);
聚集杆菌属(Aggregatibacter)、普雷沃-7 属(Prevotella-7)的相对丰度在治疗后7 d 显著下降(P<0.05)。韦荣菌属、放线菌属、拟普雷沃菌属(Allprevotella)在S-ECC 患儿治疗前(C)和无龋儿童(CF)组间相对丰度存在差异,可能与龋病状态识别相关;
二氧化碳嗜纤维菌属(Capnocytophaga)在无龋儿童中的相对丰度高于S-ECC 患儿,表现与无龋状态相关(P<0.05)。S-ECC 患儿治疗后的1 个月和3 个月,菌群内微生物属水平相对丰度水平相似;
术后3 个月,链球菌属、韦荣菌属的相对丰度水平升高,二氧化碳嗜纤维菌属的相对丰度下降,见图4。

Figure 4 Relative abundance of different genera of plaque before and after treatment in children with S-ECC图4 S-ECC 患儿治疗前后菌斑差异菌属相对丰度
S-ECC 患儿治疗术后7 d(C-7D)的血链球菌(Streptococcus sanguinis)相对丰度显著高于S-ECC患儿治疗前(C)、无龋儿童(CF)(P<0.05),在治疗后血链球菌相对丰度上升,在治疗后3 个月下降。颗粒二氧化碳嗜纤维菌(Capnocytophaga granulosa)在CF 组的相对丰度高于S-ECC 患儿治疗前后,与治疗前、治疗后7 d、3 个月的相对丰度比较,差异具有统计学意义。S-ECC 患儿治疗前(C)和无龋儿童(CF)的变异链球菌(Streptococcus mutans)相对丰度存在显著差异(P<0.01),S-ECC 患儿治疗后7 d、3 个月与CF 组无显著差异,而在治疗后3 个月相对丰度出现上升,显著高于无龋儿童组(P<0.01),见表1。

表1 S-ECC 患儿治疗前后菌斑血链球菌、变异链球菌、颗粒二氧化碳嗜纤维菌相对丰度Table 1 Relative abundance of Streptococcus sanguine,Streptococcus mutans and Capnocytophaga granulosa of plaque before and after treatment in children with S-ECC
随着分子生物学和微生物功能基因组学的发展进步,学者们得以破译生物膜内复杂的生态,对微生物群落中细菌的种群分布、多样性及致龋机制进行更深入的探讨。在本研究中,支持以往假设“核心微生物”的概念[7-8],菌斑微生物群落总体微生物组成相似,组间共有优势菌属表明核心微生物群的存在,使微生物生态环境保持相对稳定,强调了揭示个体间共有微生物的必要性和重要性。
目前对于“核心微生物菌群”组成并未达成一致,主要与不同种族、社区封闭水平、特定的取样部位、局部解剖形态和分析方法等相关。以往学者研究中发现牙齿、舌、软硬腭、黏膜等不同口腔部位具有不同的微生物组成[9],微生物在不同的生态位之间是不同的,局部解剖形态及组织结构等均能对微生物产生影响。唾液中的细菌数量众多,其微生物和营养成分受食物摄入量、回流、环境和其他影响而形成。Hurley 等[10]确定了菌斑微生物群和唾液微生物群之间的明显差异,虽然菌斑及龋病部位微生物群的多样性不如唾液微生物群,但一些罕见分类群的存在可能是这些儿童健康与疾病之间的差异。由于龋病是一种由菌斑生物膜介导的局部疾病,生物膜中的细菌不同于唾液中悬浮的单个细菌,它们是整体生存的微生物生态群体,是口腔细菌生存、代谢和致病的基础。检测龈上菌斑微生物群组成的变化是在龋病临床表现之前检测低龄儿童龋风险的一种方法,并为早期治疗龋病提供了机会,以防止不可逆转的成洞性龋形成[7]。因此本研究认为,对于龋病的研究采集菌斑生物膜样本更具有代表性。
以往有研究表明,龋病的发生、发展与口腔微生物群落多样性水平的改变密切相关。健康牙面的牙菌斑比龋损部位的菌斑α 多样性水平高,认为更多样化的群落可能对应更健康的生态系统,随着龋病严重程度的加重,多样性水平降低[11-12]。在本研究中,主要观察在治疗后微生物菌群的整体改变,因此本研究采集部位是全牙列无龋牙面的集合菌斑,降低了由于不同龋坏程度部位对α 多样性水平的影响。结果与先前的研究一致,并未观察到显著的微生物α 多样性水平变化。Teng 等[13]则认为在临床症状未出现时,微生物多样性随着低龄儿童龋严重程度变化而显著增加,而在龋病进展阶段,微生物多样性趋于稳定。龋病相关的群落通常是高度多样化的,治疗前后微生物群落的改变并不体现在α 多样性指数水平,定性、定量的α 多样性指数研究对远期监测治疗后龋病状态改变、识别早期龋病发生的意义较低。
全身麻醉下牙齿治疗可以在短时间内迅速改善口内微生物环境,治疗后7 d 的菌群结构表现出更大的波动性,体现了治疗对于菌斑群落的影响,有学者认为树脂单体对人体免疫系统细胞有生物学效应,修复材料可能会影响细菌的黏附,进而扰乱口腔微生物群谱[14]。
有学者研究认为,变异链球菌和血链球菌之间存在拮抗关系,变异链球菌产生的突变素能抑制血链球菌的生长,而血链球菌能产生过氧化氢来抑制变异链球菌的初始生物膜形成。血链球菌在牙面的早期定植延迟了变异链球菌在牙齿表面的定植,变异链球菌与血链球菌的相互作用会影响儿童的龋病状况[15],两者间的比例也被认为是评估龋病风险的一种方法。本研究中,治疗后血链球菌的迅速定植,对远期无龋状态的维持起到重要作用。随着术后血链球菌的相对丰度下降,术后3 个月出现复发情况时可以观察到变异链球菌相对丰度的上升,且变异链球菌在无龋组、龋病组间存在的显著差异,表现出对于龋病状态识别的敏感性,但其是否能够真正预测远期龋病复发仍需长时间进一步观察。也有研究表明不同类型、不同基因型的链球菌可能在儿童早期龋病中起重要作用,在未检出或仅检测到低水平变异链球菌的受试者中,唾液链球菌、戈登链球菌水平的升高被证实与龋病有关[16]。在以远缘链球菌为主的大多数样本中,也存在低水平的变异链球菌[17]。唾液中变形链球菌、索氏链球菌等水平的升高可能是儿童饮食中碳水化合物摄入频繁的替代指标。这种摄入导致微生物群落的失调,导致龈上菌斑中产酸细菌和耐酸细菌的增加[7]。提示这些菌种与龋病的关系还有待于进一步的研究,可能这些菌种是变异链球菌的替代病原菌,推测其致龋机制并不是单纯的变异链球菌含量升高,可能是与整个微生物群落结构变化相关。
二氧化碳嗜纤维菌属为兼性厌氧菌或微需氧菌,菌属中各菌种鉴别特征不明显,以往多报导其与牙周疾病密切相关。但也有研究中指出,其对牙周炎的致病性被过高估计,该菌从健康龈沟处分离率相当高,属于龈沟菌斑的正常菌群成员,故应认为是人类口腔的正常菌群[17]。
因此本研究推测是由于治疗改变了口内的致龋环境,打破了原有微生物间的平衡,一些在低pH环境下活跃的致龋菌群减少,如聚集杆菌属、普雷沃-7 属、纤毛菌属、血链球菌属等所表现出的对于治疗的敏感性,在相互协同、拮抗作用下,逐渐开始建立新平衡状态下的群落结构,这其中同样不乏精氨酸代谢等过程的参与。
有研究表明,血链球菌等在健康人群菌斑生物膜中比例较高的一个关键特性是它们可以通过精氨酸脱亚胺酶系统(arginine deiminase system,ADS)产生氨的能力,这对生物膜的pH 动态平衡有着积极的影响[18]。Nascimento 等[19]的研究也证实与龋齿活跃儿童相比,无龋组儿童牙齿表面的牙菌斑细菌具有更高的精氨酸活性,认为龈上生物膜中的精氨酸代谢可能会极大地影响宿主对龋齿的抵抗力或易感性。龋齿活跃个体和龋齿活跃牙齿部位的生物膜中的微环境也可能不利于高水平的精氨酸表达,或者可能包含降低精氨酸表达或酶活性的抑制因子。
综上所述,口腔菌斑群落内存在“核心微生物群”,共同维持菌斑微生态的稳定。S-ECC 患儿在接受治疗后口内微生物致龋环境迅速变化,菌斑菌群结构发生改变。纤毛菌属、聚集杆菌属等表现出对于治疗的敏感性,血链球菌、纤毛菌属等的早期定植有助于逐渐建立新平衡(无龋)状态下的群落结构。值得持续关注二氧化碳嗜纤维菌属、颗粒二氧化碳嗜纤维菌属等在微生物结构中维持无龋状态的作用,对群落中存在的韦荣菌属、拟普雷沃菌属、变异链球菌等可能的龋病微生物标记物仍需继续监测并辅以代谢组学等技术手段验证,有待进一步研究。
【Author contributions】 Zhou QN processed the research and wrote the article. Shang JJ designed the study and revised the article. Zhao HY processed and analyzed the data. Yang NY, Cai S and Zhou Y processed the research and revised the article. All authors read and approved the final manuscript as submitted.
猜你喜欢 龋病菌斑链球菌 妊娠晚期B族链球菌感染及干预措施对妊娠结局的影响四川生理科学杂志(2022年4期)2022-12-06大学生牙龈炎龈上菌斑的微生物群落昆明医科大学学报(2022年2期)2022-03-29链球菌感染与银屑病相关性探究皮肤病与性病(2021年3期)2021-07-30龋活跃性与年轻人龋病严重程度之间关系的研究天津医科大学学报(2021年1期)2021-01-26学龄前儿童口腔内致龋菌的活性与其龋病严重程度关系的研究当代医药论丛(2020年20期)2020-12-02龈下菌斑对慢性牙周炎患者种植体周围边缘骨吸收的影响中外医学研究(2017年6期)2017-03-30变形链球菌蛋白质组学研究进展中华老年口腔医学杂志(2016年6期)2017-01-15缺血性脑卒中患者龈下菌斑中牙周致病菌检测中华老年口腔医学杂志(2016年5期)2016-03-01180例学龄前儿童乳牙龋病调查研究分析中国卫生标准管理(2015年17期)2016-01-20肺炎链球菌表面蛋白A的制备与鉴定中国医药生物技术(2015年4期)2015-12-26本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0808/636828.html




