【www.zhangdahai.com--其他范文】
何治锋,杜玥瑶,姜宇晨,马方伟, 田春贵
(黑龙江大学 化学化工与材料学院, 哈尔滨 150080)
氨作为人类生活和工业生产中相当重要的化学原材料,广泛应用于工农业领域,例如氨水、燃料、塑料和化肥等,对当前世界的人口快速增长和经济发展起着重要作用[1-4]。此外,氨具有能量密度高和易液化等优点,与氢气相比便于储存和运输,所以氨也是重要的能量中间储存体和氢气的主要来源[5]。目前,氨主要以N2和H2为原材料通过传统的哈伯法(Haber-Bosch)生产,该方法需要高温(400~600 ℃)和高压(20~40 MPa),能耗高且CO2排放量大[6]。随着化石燃料的日益减少和环境污染的愈发严重,开发新的可持续的合成氨工艺具有重要的理论价值和现实意义。

1.1 电催化合成氨的热力学机理研究

与N2的催化还原类似,电化学反应也是最具有挑战性的。N2还原成氨是一个多步骤的过程,包括6个电子和6个质子的转移。N2还原和加氢的半反应及其在酸性和碱性介质中相应的平衡电位分别为:
N2(g)+6H+(aq)+6e-2NH3(aq)
(1)
E0= 0.092 V (vs. RHE)
2H+(aq)+2e-H2(g)
(2)
E0= 0.000 V (vs. RHE)
N2(g)+6H2O(l)+6e-2NH3+6OH-(aq)
(3)
E0= 0.092 V (vs. RHE)
2H2O(l)+2e-H2(g)+2OH-(aq)
(4)
E0= 0.000 V (vs. RHE)
从理论上讲,当电极电势足够低时,氮还原反应便可以在常温常压下发生,如上式表示N2还原反应的平衡电势与析氢反应的平衡电势相同。但是,析氢反应在一个半反应中在每个H2产生的过程中仅需要两个电子。相反,将N2还原为NH3的六电子的电势,是多个步骤的平均值。式(5)~式(7)提供了从N2到NH3的连续两电子还原的热力学参数E0值。N2H2是一种反应性极强的分子,由于其迅速歧化成N2和N2H4,因此从未在溶液中进行过光谱观察。尽管从未通过实验确定ΔGfo,但气相测量确定了trans-N2H2的ΔHfo下限(≥204.1 kJ·mol-1)。式(5)中用于计算E的ΔGf值为ΔGfo(298 K)= 230.1 kJ·mol-1,在理论上的CCSD(T)/aVTZ水平下计算,可准确地再现trans-N2H2(g)的实验ΔHfo值[20]。从trans-N2H2的ΔGfo(298 K)和热化学值很容易计算出式(6)和式(7)中的E0值。由式(5)~式(7)中的三个半反应计算出的N2(g)转化为NH3(aq)的六电子的E0值(0.229 V)高于式(1)中的E0值(0.092 V)。式(1)中的E0是根据公认的NH3(aq)的ΔGfo值(298 K)计算得出的,式(5)和式(6)是依据trans-N2H2的ΔGfo(298 K)的理论值。
N2+2H++2e-N2H2(g)
(5)
E0=-1.190 V (vs. RHE)
N2H2(g)+2H++2e-N2H4(g)
(6)
E0= 0.529 V (vs. RHE)
N2H4(aq)+2H++2e-2NH3(aq)
(7)
E0= 0.939 V (vs. RHE)
式(5)中的高能反应与实验测得的低法拉第制氨效率一致。式(8)为N2得到第一电子的E0。所有这些预测,如果没有催化剂稳定这些中间体,N2的第一电子还原能垒将会非常高。因此,在电催化合成氨反应中,由于单电子在还原中间体的过程中具有非常高的热力学能垒,导致电催化合成氨反应在热力学上很难发生。
(8)
E0= 0.000 V (vs. RHE)
如式(8)所示,虽然热力学结果显示将N2还原为NH3的六电子还原反应优于氢生成反应,但在第一个还原过程中容易形成潜在的中间物,必须通过引入催化剂加以规避[21-23]。因此,寻找适合的催化剂对电催化合成氨反应来说至关重要。
1.2 电催化合成氨的解离机理研究

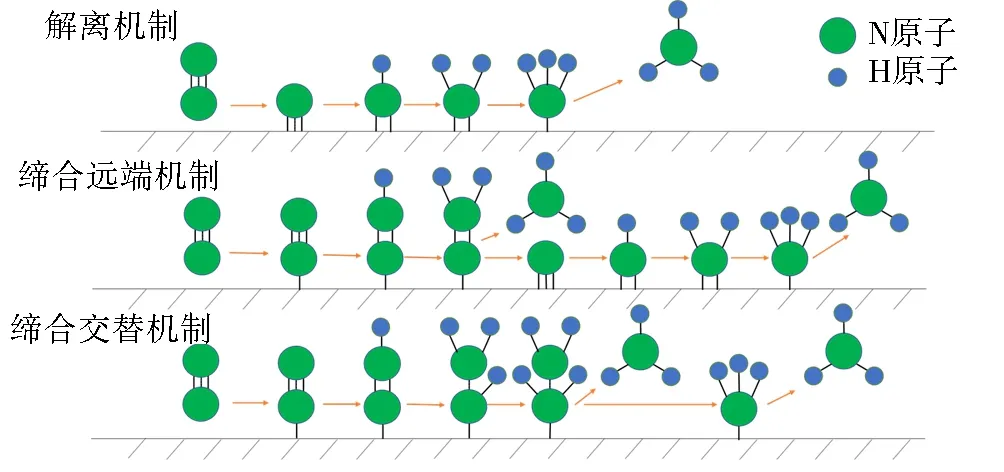
图1 非均相催化剂上N2还原为氨的一般机理
钛副族元素原子的价电子层结构为(n-1)dns,所以钛、锆和铪的最稳定氧化态是+4价[25]。在个别配位化合物中,钛还可以呈低氧化态0和-1价。锆和铪生成低氧化态的趋势比钛小,它们的M(Ⅳ)化合物主要以共价键结合[26]。
2.1 钛的氧化物
对于钛基电催化NRR催化剂,研究最多的是二氧化钛,金属钛对N原子的结合力强于H原子,因此具有较好的N2还原能力,是一种有前景的电催化NRR催化剂,但由于二氧化钛的电导率较低,导致其NRR性能较低[27]。因此,为了提高产氨率和法拉第效率,可以通过元素掺杂和引入氧空位等方法来提升二氧化钛的电导率和N2吸附性能。
Zhang等报道,富含氧空位的二氧化钛在-0.7 V时的法拉第效率达到2.5%,产氨率达到9.16×10-11mol· s-1·cm-2[28]。为了提升其催化性能,该课题组又对二氧化钛进行了元素掺杂。首先研究了碳掺杂的二氧化钛,碳的掺杂促进二氧化钛内部的电子转移到其表面,从而提高了二氧化钛的电导率,产氨率提高到16.22 μg· h-1·mg-1[29]。紧接着在二氧化钛中掺杂了硼,硼的正电荷更有利于对N原子的吸附,并且使二氧化钛从半导体状态转为半金属性质而提高了二氧化钛的电导率[30]。铁元素的掺杂也对二氧化钛的产氨率有极大的提升[31],如图2所示,铁元素掺杂的二氧化钛从XRD图像来看化学组成并未发生变化。此外,与单纯二氧化钛相比,铁掺杂的二氧化钛表现出更宽的衍射峰,这表明由于铁的掺杂,晶体结晶度略有降低。这是由于铁掺杂引起了二氧化钛晶格常数的增加,因此,可以推断,铁离子进入二氧化钛晶格中,形成一种铁、钛固溶体。铁掺杂二氧化钛的产氨率达到25.6 μg·h-1·mg-1,法拉第效率也高达25.6%。钒掺杂二氧化钛的产氨率在-0.4 V条件下达到17.73 μg·h-1·mg-1,法拉第效率达到15.3%,该性能主要归功于V-TiO2表面的V与Ti原子协同增强了NH2反应中间物在表面的吸附,从而提高TiO2的NRR性能[32]。
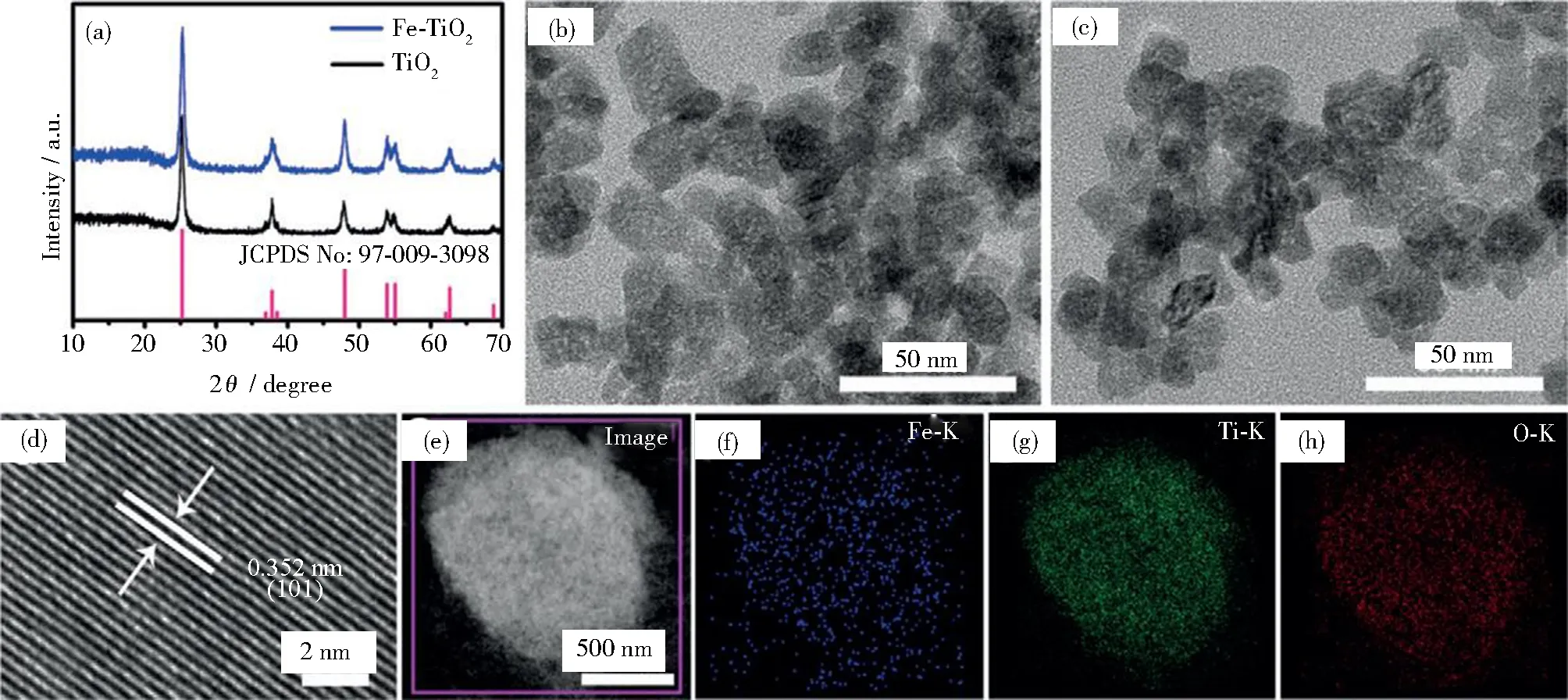
图2 (a)二氧化钛和Fe-TiO2的XRD谱图;
二氧化钛(b)和Fe-TiO2 (c)的TEM图像;
(d) Fe-TiO2的HRTEM图像;
(e) Fe-TiO2的STEM图像及(f) Fe、(g) Ti、(h) O对应的EDX元素分布图像[31]
Qin等首次通过高温热解MIL-125(Ti)制备了碳掺杂的TiO2/C复合催化剂[33],获得17.8%的法拉第效率和14.8 μg·h-1·mg-1的产氨率,其优异的性能主要是由于碳进入氧空穴形成的Ti—C键促进了N2的活化。
Liu等在TiO2纤维上生长CoS片并进行碳纳米涂敷,得到了C@CoS@TiO2异质的复合材料,CoS和TiO2之间的紧密耦合促进了电荷转移,在异质界面上产生快速的反应动力学,所得的C@CoS@TiO2电催化剂实现了惊人的高产氨率(8.09×10-10mol· s-1·cm-2)、法拉第效率(28.6%)和出色的长期稳定性[34]。
2.2 锆基催化剂
虽然锆的化合物在水中易水解,但作为钛的同族元素,锆的电催化NRR潜力是毋庸置疑的。Luo等利用廉价且易制备的MOF材料(UiO-66)为前驱体,通过原子掺杂引入Y3+,制备了碳包覆钇稳定氧化锆(C@YSZ)与碳包覆氧化锆(C@ZrO2)催化剂[35]。如图3所示,C@YSZ材料为约200 nm的纳米球结构。TEM图像表明,一个C@YSZ纳米球是由许多较小(约为20 nm)的纳米粒子组成的。从图3(d)中可以看出,Y、Zr、O和C元素均匀分布在C@YSZ材料当中,进一步证明了Y元素已被均匀地掺杂到二氧化锆晶格中。在0.1 mol·L-1Na2SO4电解液中,C@YSZ和C@ZrO2电催化剂的产氨率和法拉第效率分别达到24.6 μg·h-1·mg-1、8.2%和22.4 μg·h-1·mg-1、7.9%,是非常优秀的固氮电催化剂。

图3 (a) C@YSZ的SEM图像;
(b) C@YSZ的TEM图像;
(c) C@YSZ的HRTEM图像;
(d) C@YSZ的Y、Zr、O和C的EDX元素分布图像[35]
铬副族元素包括铬、钼和钨三个元素。价电子层结构均为(n-1)dns,它们的最高氧化态为+6,都具有d区元素多种氧化态的特征[36-37]。它们的最高氧化态稳定性按铬、钼、钨的顺序增强,而低氧化态的稳定性则相反。
3.1 钼基催化剂
源于钼的类固氮酶催化机理及高催化加氢能力,钼基催化剂已被证实是有效的NRR催化剂,钼的化合物具有较高的稳定性,在电催化过程中不会产生中毒失活等现象[38]。对于钼基化合物,MoS2、Mo2C、MoO3和MoO2都有希望成为高效的NRR催化剂。
3.1.1 钼的氧化物

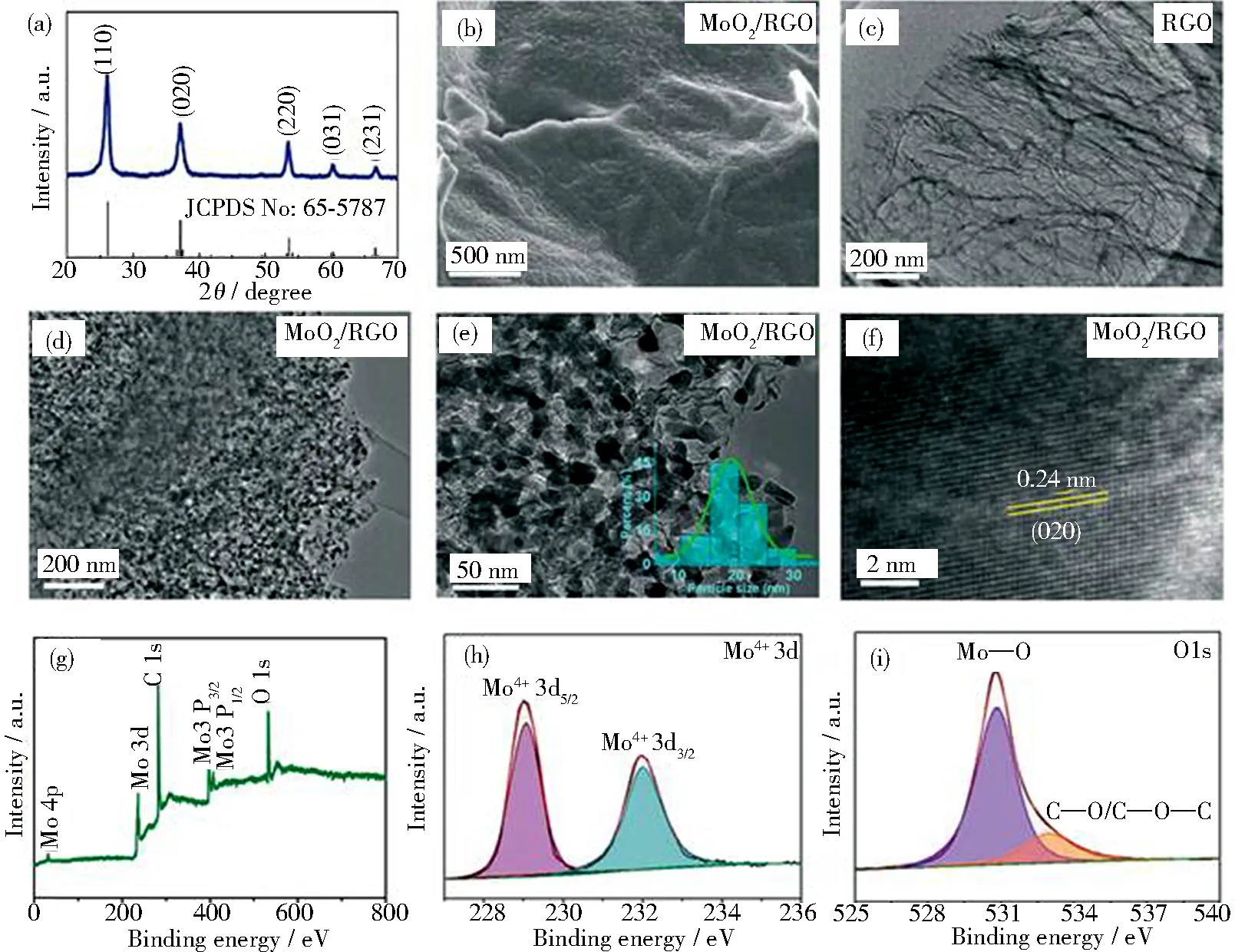
图4 (a) MoO2/RGO的XRD谱图;
(b) MoO2/RGO的SEM图像;
(c) RGO的TEM图像;
(d、e) MoO2/RGO的TEM图像;
(f) MoO2/RGO的HRTEM图像;
(g~i) MoO2/RGO的XPS分析[40]
3.1.2 钼的硫化物



图5 Fe-MoS2纳米片的(a) SEM图像和(b)HAADF-STEM图像;
(c) Fe-MoS2纳米片的HAADF-STEM和STEM-EDX元素分布图像;
(d) Fe-MoS2和MoS2纳米片的S 2p和(e)Fe 2p3/2 XPS光谱; (f) Fe-MoS2纳米片、Fe2O3和Fe箔的XANES光谱[45]
3.1.3 钼的碳化物

3.2 钨基催化剂
澳大利亚的Jin等报道了含N空位的W2N3,其产氨率达到11.66 μg·h-1·mg-1,法拉第效率高达11.67%。因其具有独特的空位特性,可吸附N原子,且HER活性差,过渡金属氮化物上的N空位被认为是NRR的理想活性位点[52]。Tong等制备了铁掺杂的含缺陷的W18O49,W18O49具有低的H2结合能,缺陷工程制造了更多的活性位点,极大地削弱了与固氮竞争的析氢反应,并降低了室温下电化学NRR的能垒[53]。铁掺杂策略和调整后的氧空位状态同时优化了W18O49的电子状态和表面结构,从而提高了N2吸附强度,并获得低电位的反应路径,使产氨率达到24.7 μg·h-1·mg-1,法拉第效率达到20.0%。

4.1 铁基催化剂
铁是一种廉价且地球含量较高的元素,在工业Haber-Bosch过程中对N2固定起着重要作用,铁是唯一存在于所有三种已知的固氮酶(MoFe-、VFe-、Fe-N2ase)中的元素[56]。铁原子的电子构型为4s23d6,即有4个未配对的d自旋电子。Fe2+有2个空轨道和2个半占位轨道,而Fe3+有3个空轨道和1个半占位轨道,这些电子结构有利于N2的吸附[57]。铁基催化剂以其低成本和高催化活性而受到人们的广泛关注。
4.1.1 铁的氧化物
金属氧化物是过渡金属最常见的形态,铁元素的主要三价化合物为Fe2O3和FeOOH,其中Fe2O3-Cu在很久以前便作为Haber-Bosch法制氨的主要催化剂。基于其理论研究,Fe2O3表面的Fe原子可吸附并活化N2分子,第一次氢化过程是最需要能量的步骤[58]。为了提高产氨率和法拉第效率,在催化剂中引入缺陷来重新分配电荷密度和引入活性中心是一种有效的方法[59]。通过对赤铁矿退火制备了富氧空位的Fe2O3,然后负载在碳纳米管上得到复合催化剂(o-Fe2O3-Ar/CNT),其最大产氨率为0.46 mg·h-1·cm-2。催化剂基底的高导电性对NRR也很重要,因为基底中丰富的电子可以增加电子注入N2反键轨道的可能性,也有利于随后的NRR。Chen等将氧化铁纳米材料直接附着在碳纳米管上,铁颗粒与碳纳米管界面形成的特定碳位,利于N2的活化,其产氨率达到2.2×10-3g·h-1·m-2,法拉第效率高达95.4%[60]。美国乔治华盛顿大学的Cui等将AC浸泡到硝酸铁溶液中进行热处理制备了Fe2O3/AC[61],循环伏安法研究表明,Fe2O3/AC催化剂能抑制氢还原,促进NRR,最大产氨率为8.27×10-9mol·s-1·cm-2。
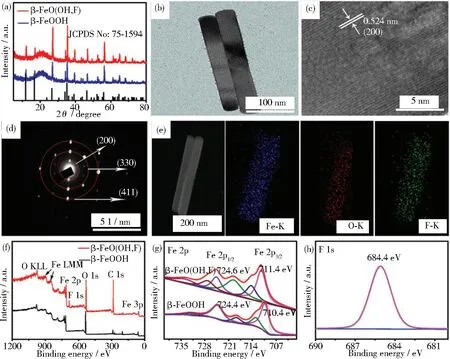
图6 (a)β-FeOOH和β-FeO(OH,F)的XRD谱图;
(b)β-FeO(OH,F)的TEM图像; β-FeO(OH,F)纳米棒的(c)HRTEM图像和(d)SAED图像;
(e)β-FeO(OH,F)的TEM图像和对应的Fe、O、F的EDX元素分布图像;
(f)β-FeOOH和β-FeO(OH,F)的XPS测量光谱;
(g)Fe 2p和(h)F 1s区域中的XPS光谱[63]
Zhu等报道,β-FeOOH材料在0.5 mol·L-1LiClO4条件下,产氨率为23.32 μg·h-1·mg-1,法拉第效率为6.7%,发现电解质(LiClO4、NaClO4和KClO4)对NRR有一定的影响[62]。产氨率和法拉第效率均随Li+、Na+和K+离子半径的增大而下降,这归因于一价平衡离子与N2之间的强相互作用,Li+的平衡离子层可以限制H2O分子接近活性位点,从而抑制竞争性HER。非金属F的电负性大于O和Fe,F掺杂可以导致电子的重新分布和增强N2的吸附能力。该课题组在相同条件下对β-FeOOH进行F掺杂[63],如图6所示,材料是纳米棒结构,表面的晶格条纹间距为0.524 nm,且F、Fe和O元素在纳米棒中分布均匀。其产氨率增至42.38 μg·h-1·mg-1,法拉第效率也增加到了9.2%。
除了上述重点关注的Fe2O3和FeOOH催化剂外,Hu等通过电还原制备了Fe/Fe3O4,该催化剂具有多孔的表面形貌和良好的导电率,结果表明,Fe/Fe3O4催化剂具有较高的NRR活性,并对HER有较好的抑制作用,其法拉第效率高达8.29%,是裸铁箔的120倍左右,也优于Fe和Fe2O3纳米粒子[64]。
4.1.2 铁的硫化物

4.1.3 铁的碳化物
澳大利亚的Zhang等利用木质纤维素吸附Fe离子后,进行分步热解制备了Fe-(O-C2)4,该催化剂产氨率为32.1 μg·h-1·mg-1,法拉第效率高达29.3%。该研究还利用含富氧官能团的无氮木质纤维素(LC)作为前驱体吸附Fe3+,再通过简单的热还原过程形成Fe—O配位键,抑制HER,增强电催化NRR的性能[67]。受固氮酶Mo-Fe活性中心的启发,Qin等合成了Mo3Fe3C复合材料,该催化剂具有出色的固氮催化性能,可以有效抑制HER。在-0.05 V时,产氨率为50.1 μmol·h-1·g-1,但法拉第效率只有3.9%[68]。
4.2 钴基催化剂
钴基材料一直在燃料电池领域表现出很大的应用前景,并且在电催化水分解领域中也是一个非常重要的分支,由于具有类似的催化加氢活性,钴基催化材料也被应用于NRR领域[69-70]。
4.2.1 钴的氧化物
Luo等通过热解ZIF-67制备了Co3O4@NCs纳米复合材料,该材料在-0.2 V条件下的产氨率为42.58 μg·h-1·mg-1,法拉第效率为8.5%。良好的NRR性能主要归因于氮杂化碳材料和富含氧空位的Co3O4产生的协同效应,氧空位可以稳定地捕捉亚稳态的电子,核壳结构也可以增加被捕获的N2与催化剂之间的碰撞机率[71]。但由于其导电性不佳、分散性差和活性位点有限等原因,极大地阻碍了进一步应用。Lv等通过热解双金属ZIF制备了氧空位浓度可调的锌掺杂Co3O4电催化剂[72]。锌和钴原子之间的相互作用可以有效地调节它们的电子结构,优化N2在电催化反应中的吸附性能。优化后的电催化剂具有11.9%的法拉第效率和22.71 μg·h-1·mg-1的产氨率,并具有优异的电化学耐久性和稳定性。不同元素掺杂和形貌控制会对催化剂产生不同的影响,该课题组又通过水热和退火处理制备了富含氧空位的三维镍泡沫负载的海胆状掺铝Co3O4纳米球(Al-Co3O4/NF)[73]。结果表明,将铝原子引入Co3O4有效调节了催化剂的电子结构,且铝掺杂增加了表面氧空位而促进N2的活化。此外,这种具有类似海胆形状的纳米结构具有限制气泡聚结的能力,能够迅速去除小气泡,并使活性位点更好地吸附N2,从而提高产氨率(6.48×10-11mol·s-1·cm-2)和法拉第效率(6.25%)。
4.2.2 钴的硫化物
钴的硫化合物因为具有较强的导电性和较高的催化活性,也是具有发展潜力的NRR催化剂。Chen等报道了CoS2/N-S杂化石墨烯材料,该材料在-0.05 V条件下的法拉第效率为25.9%,产氨率最高为25 μg·h-1·mg-1。通过XANES证实了CoSx纳米颗粒与N、S共掺杂的石墨烯界面间成功构建了强桥接键(Co—N/S—C),这些键可以作为电子传递通道直接加速反应,降低NRR的反应电位[74]。
4.3 镍基催化剂

4.4 铜基催化剂


表1 过渡金属基催化剂的NRR性能

续表
纳米结构的表面空位是电催化剂中研究最广的缺陷类型,空位由于具有丰富的局域电子,不仅可以作为单原子的锚定位,还可以作为参与N2键断裂反应的活性位点。因此,空位的制备可以有效提高NRR的催化性能,纳米结构过渡金属氧化物表面的氧空位更是经常被用作提高NRR催化性能的活性中心。如表1数据所示,富氧空位二氧化钛和富氧空位氧化钼的产氨率和法拉第效率都有显著提高,受氧空位引起的NRR性能提高的启发,由于氧和硫的化学性质相似,可以合理地假设硫空位在提高电化学NRR活性方面也会具有很大的潜力。表1数据也证实这一点,富硫空位花状硫化钼材料的产氨率达到29.28 μg·h-1·mg-1,法拉第效率也提升到了8.4%。
元素掺杂在纳米结构NRR电催化剂的制备中有着广泛的应用,通过引入杂原子,可以调整电子结构,使电子密度重新分布。此外,杂原子的引入还可以更好地形成表面缺陷,从而提高与N2分子的结合能力。由于上述原因,杂原子掺杂已被广泛用作提高电催化性能的重要手段。通过对比不同元素对TiO2、MoS2、β-FeOOH三种材料掺杂后的数据,可以发现金属元素中的铁元素相比其他金属元素更能有效提高产氨率和法拉第效率,非金属元素中的氟元素也对材料的法拉第效率提升较多。通过对上述数据分析,相比其他催化剂,MoS2和β-FeOOH在电催化NRR领域具有较大的应用潜力。
本文回顾和总结了过渡金属中的电催化NRR用非贵金属基催化剂的研究状况,包括它们的氧化物、氮化物、碳化物和氮化物等,并且对它们的结构调控、性能和优缺点进行了分析和总结。目前,电催化NRR合成氨仍存在一些关键问题,需要通过进一步提高催化剂本征活性和选择性来加以解决。(1)由于HER的存在,需要消耗大量的电子和质子形成H2,与NRR形成了竞争关系,几乎所有电催化剂都存在法拉第效率低的难题。因此,亟需采取一些策略来抑制HER,提高产氨率和法拉第效率;
(2)N2的吸附能力和活化能力与产氨率直接相关,而N2的吸附能力主要来源于催化剂表面的活性位点,因此,如何增加更多的活性位点是非常重要的,在催化剂表面制造空位可以提供更多的活性位点来增加N2的吸附;
(3)调节活性中心的电子结构可以优化NRR过程的反应路径,降低反应活化能,异质结构、空位和原子掺杂等策略均可优化催化剂的电子结构,从而提高催化剂的电催化NRR性能。





