【www.zhangdahai.com--其他范文】
李亚港,姜福林,李一萍,黄 民,钟国平
(1.中山大学药学院药物代谢与药动学实验室;
2.广东省创新药物药代动力学研究与评价重点实验室,广东 广州 510006)
炎症性肠病(inflammatory bowel disease,IBD)包括克罗恩病和溃疡性结肠炎等至少两种独立疾病。过去10年,IBD在全球范围内呈现发病率上升的趋势[1]。目前IBD的发病原因尚不清楚,且难以治愈,因此IBD的治疗主要以缓解症状与防治并发症为目的,一些炎症调控因子[2]和中药单体[3]在缓解IBD症状中表现出潜力,但未应用于临床实践,目前临床应用于IBD的药物包括氨基水杨酸类、糖皮质激素类、免疫调节剂等药物。沙利度胺作为免疫调节剂,兼有抑制血管生成作用,且价格低廉,已用于IBD的临床维持缓解治疗[4],并且表现出显著疗效[5]。
由于沙利度胺溶解性差,在水中稳定性差,因此市售沙利度胺多为固体制剂,给药途径以口服为主。胃肠道是口服药物的主要吸收部位,胃肠功能的改变可能对药物的吸收产生影响,从而影响到药物的安全性和有效性。IBD在组织学中表现为粘膜破坏、炎症细胞浸润和息肉、肿块的形成等,但对沙利度胺口服吸收的影响尚不明确。因此,本研究拟分别使用健康大鼠与IBD大鼠进行沙利度胺药代动力学的研究,为沙利度胺的合理使用提供依据。
1.1 药品与试剂沙利度胺标准品(Sigma-Aldrich,纯度>96%),7-羟基香豆素(Sigma-H24003,纯度>99%),2,4,6-三硝基苯磺酸(Sigma-Aldrich,5%),无水乙醇(TEDIA,分析纯),乙酸乙酯(TEDIA,色谱纯),甲醇(TEDIA,色谱纯),甲酸(TEDIA,色谱纯)。
1.2 仪器HPLC-UltiMate 3000&MS (Thermo Fisher Scientific,美国),TSQ Quantum Access MAX(Thermo Fisher Scientific,美国),Mili-Q超纯水机(Thermo Fisher Scientific,美国),移液器(Eppendorf,德国),CT15RE台式微量高速离心机(日立工机,日本),DZF-6050型真空干燥箱(上海恒科技有限公司),PH510 Series酸度计(吉尔森公司),AL104电子天平(梅特勒-托利多仪器上海有限公司),XW-80A旋涡混合器(上海精科实业有限公司),Multi-Tube Vortexer(北京踏锦科技有限公司)。
1.3 动物SPF级健康成年SD大鼠22只,雌雄各半,体质量(200±15)g,由广东省实验动物中心提供,许可证号SCXK(粤)2013-0002。动物在中山大学东校园实验动物中心SPF标准动物房中饲养,每日自由摄取去离子水和标准饲料。实验程序经中山大学东校园实验动物中心伦理委员会批准,符合中国伦理委员会有关动物研究指导原则。
1.4 方法
1.4.1IBD大鼠模型的建立与评价
1.4.1.1 模型建立 取16只大鼠分别作为IBD造模组与空白对照组,雌雄各半。采用三硝基苯磺酸(trinitrobenzenesulfonic acid,TNBS)造模法,按照体积比2 ∶1的比例混合5%TNBS水溶液与无水乙醇得TNBS灌肠溶液,对照组以生理盐水代替5%TNBS水溶液。大鼠禁食24 h后,按0.3 mL·100g-1剂量腹腔注射10%水合氯醛麻醉,随后使用灌胃针经大鼠肛门插入8 cm达结肠部位,按照0.5 mL·100g-1剂量快速灌入灌肠液,倒提大鼠30 s后待大鼠自然清醒常规饲养。
1.4.1.2 评价指标 造模期间,每天观察和记录IBD组和对照组大鼠进食、毛色、活动情况、称量和记录大鼠体质量、记录评价大便性状。肉眼观察大便隐血情况,进行疾病活动指数(disease activity index,DAI)评分[6]。造模结束后,取出距肛门10 cm的结肠组织,沿肠系膜纵行切开,用冰冷生理盐水冲洗,将黏膜向上展开,观察豁膜损伤,进行结肠黏膜的大体损伤评分[7]。采用10%甲醛固定结肠组织,常规石蜡包埋后切片,通过光镜下HE染色观察大鼠肠道黏膜改变并评分[8],平均观察3个100倍视野,取平均值。
1.4.2IBD大鼠药动学研究
1.4.2.1 供试品配制 精密称取沙利度胺粉末适量,加入1%二甲基亚砜的生理盐水涡旋混匀,得浓度2 g·L-1的沙利度胺混悬液,置于4 ℃冰箱保存,用于口服给药。
1.4.2.2 动物分组与样本采集 另取6只健康SD大鼠作为健康大鼠沙利度胺口服组用于药动学研究,雌雄各半,同时对IBD模型组大鼠于造模6天后灌胃口服给予沙利度胺。根据沙利度胺用于IBD患者维持缓解的临床剂量(50~300 mg·d-1)[5,9],通过人与大鼠体表面积换算[10],最终设置大鼠给药剂量为10 mg·kg-1。于给药前(空白血样)及给药后5 min、15 min、30 min、1 h、2 h、4 h、6 h、8 h、10 h、12 h、24 h和48 h经眼眶后静脉丛取血约0.3 mL,置于1.5 mL的肝素化EP管中。全血经4 500 r·min-1,4 ℃离心10 min分离得到血浆样品,保存于-20 ℃冰箱备用。
1.4.2.3 储备液与工作液配制 分别精密称取两份沙利度胺标准品10 mg,溶解于1 mL体积比为50 ∶49 ∶1的甲醇 ∶乙腈 ∶甲酸溶液中,转移至10 mL容量瓶,并用体积比为50 ∶49 ∶1的甲醇:乙腈:甲酸溶液定容到刻度,摇匀得1 g·L-1的标准储备液,置于-20 ℃冰箱保存。两份储备液分别经50 ∶49 ∶1的甲醇:乙腈:甲酸溶液梯度稀释,分别得到浓度20、50、100、500、1 000、5 000、10 000、20 000 μg·L-1的标准曲线工作液与浓度为50、1 000、16 000 μg·L-1的质控工作液,置于4 ℃冰箱保存。内标物7-羟基香豆素储备液与工作液按照同样方法配制最终得1 mg·L-1的标准工作液,置于冰箱4 ℃保存。
1.4.2.4 已知浓度样本制备与样本前处理 取大鼠空白血浆90 μL,置于1.5 mL离心管中,加入工作液10 μL,涡旋30 s混匀,配制成沙利度胺血浆浓度为2、5、10、50、100、500、1 000、2 000 μg·L-1的标准曲线血浆样本和浓度为5、100、1600 μg·L-1的质控样本。取血浆样品100 μL,置于1.5 mL的离心管中;
加入的柠檬酸钠缓冲液100 μL(pH=1.5);
加入内标工作液10 μL,旋涡10 s混匀;
加入500 μL乙酸乙酯,旋涡振荡1 min,静置3 min,15 000 r·min-1,4 ℃离心5 min;
吸上清液400 μL于另一干净的1.5 mL离心管中,于真空干燥器中挥干约1 h;
残渣用流动相200 μL复溶,旋涡混合1 min,15 000 r·min-1离心5 min;
取上清140 μL加入进样瓶,采用经过方法学验证的检测方法[11]上样20 μL分析。
1.4.2.5 色谱条件 色谱柱为BETASIL C18(4.6 mm×150 mm,5 μm),流动相为甲醇:0.1%甲酸水溶液(70 ∶30,V/V),以0.5 mL·min-1等度洗脱,柱温为25 ℃,自动进样器温度为4 ℃,进样盘温度为10 ℃。
1.4.2.6 质谱条件 质谱离子源为大气压力化学电离源,离子化模式为正离子模式,喷雾电压4 500 V,涡旋离子喷雾温度280 ℃,毛细管温度300 ℃,鞘气(N2)压力10 psi,辅助气(N2)压力8 psi,碰撞池气体(N2)压力1.5 mTorr。检测模式为多反应监测,沙利度胺m/z259.1→186.1,碰撞能24 eV;
7-羟基香豆素m/z163.1→107.1,碰撞能22 eV。

2.1 大鼠一般状况与DAI评分对照组大鼠精神好,毛发平顺,活动正常;
体质量稳定增长;
大便性状正常,大便成形,呈颗粒状,无便血;
存活率100%。
IBD组大鼠在造模1 d后个别出现毛发变黄、竖毛等状况,伴有精神怠慢,懒动弓背情况,出现稀便及肉眼血便;
造模3 d后部分大鼠明显消瘦,毛发干燥竖起,大便成形,多伴有黏液和脓液与少量隐血;
造模5 d后3号雄鼠死亡,存活率87.5%。IBD组2号雄鼠和6号雌鼠外观及活动情况正常,表现与对照组一致,其他大鼠在造模期间体质量呈明显下降趋势,结果见Fig 1与Tab 1。
结合大鼠的体质量和粪便性状,进行疾病活动指数(DAI)评分,由于IBD组的2号和6号大鼠的一般状况与空白组相同,考虑造模失败,未将其进行评分。评分结果如Fig 2所示,造模期间IBD组大鼠的DAI评分明显升高,造模后3 d评分迅速增高超过2分,且维持在较高水平,d 4评分开始下降,但仍然显示有IBD症状,并且连续5 d维持在1分左右。

Fig 1 The body weight of rats in IBD group
*P<0.05,**P<0.01vsControl group.
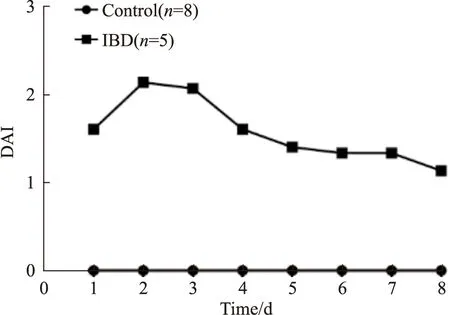
Fig 2 The disease activity index of rats in various groups

Tab 1 The observation records of rat behavior and body hair
2.2 大鼠标本形态与组织评分肉眼观察,对照组大鼠的结肠颜色粉红,褶皱清晰,结肠细长;
除2号和6号大鼠外,IBD组部分大鼠结肠出现溃疡、充血、水肿以及肠壁增厚,重者可见坏死,结肠长度较粗,且长度明显低于对照组。HE染色结果显示,对照组大鼠的肠组织正常,结构完整(Fig 3A)。IBD组大鼠出现炎症细胞浸润、黏膜层糜烂、溃疡、腺体排列紊乱等情况(Fig 3B)。组织病理学评分见Tab 2。

Fig 3 Colon tissues on day 7(×100)A:Control group;
B:IBD group

Tab 2 Score of colonic macroscopic morphous and histopathology of rats in various
2.3 大鼠血药浓度与药代动力学参数采用UPLC-MS/MS测定血浆沙利度胺浓度,代表性色谱图如Fig 4所示,药时曲线如Fig 5所示,其药代动力学参数见Tab 3。与健康大鼠相比,IBD组大鼠Cmax(3 767.8±2 259.1vs1 148.2±337.3(μg·L-1),P<0.05)、AUC0-t(14 326.2±4 038.1vs6 002.8±2510.6(μg·h·L-1),P<0.01)、AUC0-∞(14 375.6±4021.7vs6 064.2±2 549.5(μg·h·L-1),P<0.01)均升高了2~3倍,而T1/2、Tmax、MRT等参数无明显差异。
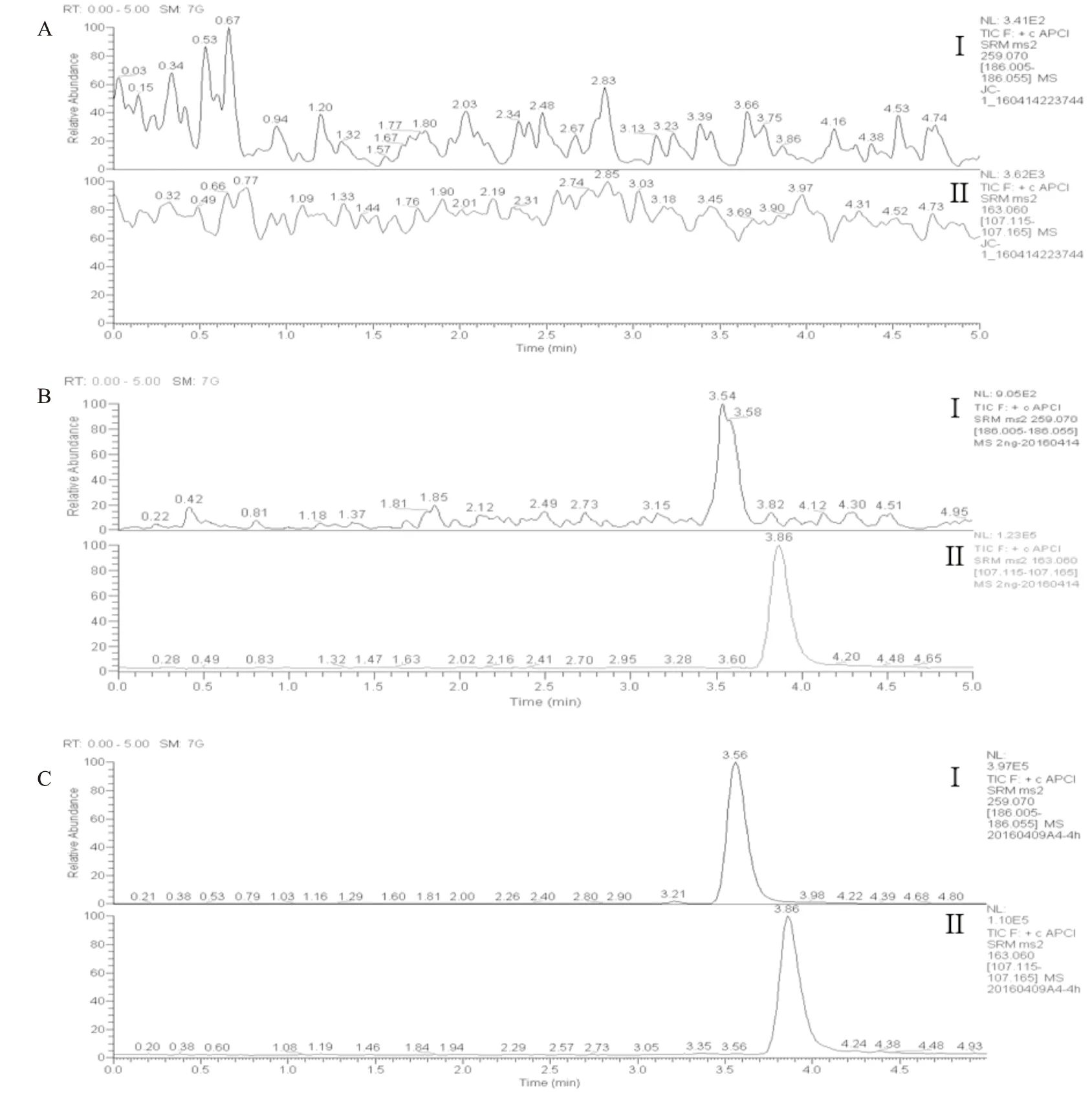
Fig 4 Chromatogram of thalidomide and 7-HydroxycoumarinA:Blank sample;
B:LLOQ sample;
C:Pharmacokinetic plasma sample;
Ⅰ:thalidomide;
Ⅱ:7-Hydroxycoumarin

Fig 5 Plasma concentration-time profiles of thalidomide after administration of 10 mg·kg-1 in

Tab 3 The pharmacokinetic parameters of thalidomide in plasma of
疾病可使机体生理状态发生一系列的变化,进而影响药动学特征,使药物效应出现增强或减弱,甚至发生药物不良反应。本研究通过TNBS法构建得到了与临床IBD病症相似的IBD大鼠模型,考察了IBD对沙利度胺口服吸收的影响,结果显示IBD大鼠口服沙利度胺的生物利用度增加了2.36倍,提示IBD疾病因素可促进大鼠口服沙利度胺的吸收。
目前IBD缺乏有效的根治方法,世界卫生组织将其列作现代难治病之一[12]。实验动物模型的建立对研究IBD的发病机制、防治手段及药物筛选等至关重要。TNBS合用乙醇是常用于IBD造模的方法,相较于乙酸诱导法、恶唑酮诱导法、角叉菜胶诱导法等方法,该方法操作简单,成本较小,重复性好,维持时间久,且所构建的模型与人类IBD病症相类似[13]。本研究采用TNBS法建立大鼠IBD疾病模型,并通过观察大鼠状态与量表评分以评价疾病模型,发现造模成功率为62.5%,且表现出了与临床IBD相似的症状,提示造模较为成功,可用于后续研究。
药物吸收的过程受到许多因素的影响,包括药物性质、晶型、剂型和给药途径等[14],机体本身生理病理状态也会对药物的吸收产生影响。对于口服药物,消化系统疾病将影响药物从消化道的吸收,如克罗恩病可减慢维生素D的吸收[15]。IBD作为一类炎症性消化系统疾病,疾病发展过程中与免疫系统与肠道微生物群的相互作用密切相关[16]。研究表明,炎症状态下常伴有药物代谢酶与转运体表达与活性的改变,从而影响外源性物质的代谢与转运,最终对血药浓度产生影响[17-18];
此外由于IBD导致的胃肠道动力学、胃肠道pH、黏膜通透性、血流分布等的改变也可能对药物的吸收产生影响。
本研究结果显示,IBD状态下大鼠口服沙利度胺的吸收显著增加,这可能为临床口服沙利度胺用于IBD治疗提出新的考量,虽然有研究发现克罗恩病患者口服沙利度胺的吸收程度与速度相较健康人无明显差异[11],但该研究采血点稀疏,因此这一结论仍有待于临床更大样本量数据的支持。由于IBD发病机制复杂,这一结果可能是药物代谢酶、转运体与胃肠道生理因素变化共同作用的结果,其确切的机制仍需进一步研究。
猜你喜欢沙利度胺工作液造模脾肾阳虚型骨质疏松症动物模型造模方法及模型评价世界科学技术-中医药现代化(2021年12期)2021-04-19胆囊胆固醇结石湿热证小鼠造模方法的研制与评价世界科学技术-中医药现代化(2021年12期)2021-04-19湿热证动物模型造模方法及评价研究世界科学技术-中医药现代化(2021年12期)2021-04-19慢性萎缩性胃炎及胃癌前病变大鼠造模方法的文献研究*天津中医药(2019年9期)2019-09-18HSWEDM加工中工作液性能变化及其对电极丝损耗影响的研究制造技术与机床(2017年9期)2017-11-27沙利度胺治疗炎症性肠病的有效性及安全性分析中华结直肠疾病电子杂志(2017年3期)2017-01-12中医火针联合沙利度胺治疗结节性痒疹78例临床观察中国中西医结合皮肤性病学杂志(2016年4期)2016-07-18沙利度胺治疗肺纤维化新进展天津医科大学学报(2015年3期)2015-06-05裂缝性致密储层工作液损害机理及防治方法西南石油大学学报(自然科学版)(2015年3期)2015-04-16小剂量沙利度胺联合泼尼松治疗原发性骨髓纤维化14例中国药业(2014年17期)2014-05-26本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0911/652705.html




