【www.zhangdahai.com--其他范文】
梁紫积,陈楚义
[深圳市龙岗区人民医院,香港中文大学(深圳)医学院附属第二医院泌尿外科,广东深圳 518172]
前列腺癌(prostate cancer,PC)是一种威胁全球男性健康的常见恶性肿瘤,晚期患者癌细胞远处转移是造成患者死亡的主要原因,目前尚无针对其治疗的有效方法,因此了解其转移及治疗机制,对患者的生存至关重要[1-2]。大量研究显示,长链非编码RNA(long non-coding RNA,lncRNA)影响肿瘤细胞的增殖、转移,在包括PC在内的多种肿瘤中具有抑癌或促癌作用[3]。母系表达基因3(maternally expressed gene 3,MEG3)作为多种癌症的抑癌基因,在PC组织及癌细胞中表达异常下调,其过表达可显著抑制PC细胞(DU 145细胞)的增殖、侵袭及迁移能力[3-4]。微小RNA(microRNA,miR)可通过与其靶基因3’非翻译区结合来调控基因表达,从而参与癌症转移,研究表明,抑制miR-181b-5p表达可抑制PC细胞(PC3细胞)上皮间质转化及侵袭[1]。组织金属蛋白酶抑制因子3(tissue Inhibitor of Metalloproteinase 3,TIMP3)是miR-181b-5p的靶基因,抑制miR-181b-5p/TIMP3轴可阻碍PC细胞生长及转移[5]。目前关于MEG3在PC细胞转移机制中的研究知之甚少,因此,本研究通过探究MEG3调控miR-181b-5p/TIMP3轴对PC细胞侵袭、迁移的影响,为PC转移及治疗机制的研究提供参考。
1.1 试剂和仪器LipofectamineTM2000 Transfection Reagent[11668019,朗智(上海)生物科技有限公司];
RPMI 1640培养基、BCA蛋白检测试剂盒(SP1413、SS0901,北京硕华佰奥生物科技有限公司);
蛋白提取试剂盒(zk7795,深圳子科生物科技有限公司);
双荧光素酶检测试剂盒[LF004,亚太恒信生物科技(北京)有限公司];
兔抗β-actin、TIMP3、基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)、Anti-rabbit IgG,HRP-linked Antibody、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)抗体(4970、5673、4022、7074、13667,Cell Signaling Technology);
MTT检测试剂盒(BYT0005,上海三抒生物科技有限公司);
反转录试剂盒(R3563,北京康瑞纳生物科技有限公司);
实时荧光定量PCR(quantitative Real-time PCR,qRT-PCR)试剂盒(货号:T427S/L,广州英赞生物科技有限公司);
博日荧光定量PCR检测系统LineGene 9600 Plus(FQD-96A,杭州博日科技股份有限公司);
InvitrogenQuickGel6200凝胶成像系统(DH.WGD00020,上海连桥生物科技有限公司)。
1.2 实验方法
1.2.1临床样本获取 收集2019年12月—2021年12月本院所收治的20例PC患者的PC组织及其对应的癌旁组织。患者平均(57.30±6.07)岁。经伦理委员会批准,患者全部知情,并签署同意书。
1.2.2细胞培养 将人正常前列腺上皮细胞系(P69)和PC细胞系(DU145、LNCaP、PC3、22Rv1)接种到RPMI 1640培养基(体积分数为10%胎牛血清)37 ℃培养(体积分数5%CO2),待细胞汇合到约80%时胰酶消化、传代。
1.2.3分组及转染 于6孔板中接种PC3细胞(2×105个/孔)培养24 h后,分为对照组(未处理)、pcDNA3.1-NC组(转染pcDNA3.1-NC)、pcDNA3.1-MEG3组(转染pcDNA3.1-MEG)、pcDNA3.1-MEG3+miR-NC组(pcDNA3.1-MEG3与miR-NC共转染)、pcDNA3.1-MEG3+ miR-181b-5p mimic组(pcDNA3.1-MEG3与miR-181b-5p mimic共转染),使用LipofectamineTM2 000试剂盒分别将50 ng的pcDNA3.1-NC、pcDNA3.1-MEG3及100 nmol/L的miR-NC、miR-181b-5pmimics转染至各组的PC3细胞中,培养48 h,qRT-PCR检测转染效果。
1.2.4qRT-PCR检测MEG3及miR-181b-5p的表达 按Trizol法提取P69、DU145、LNCaP、PC3、22Rv1细胞总RNA,采用逆转录试剂盒将其逆转录成cDNA,再根据qRT-PCR试剂盒进行扩增(GAPDH、U6分别为MEG3及miR-181b-5p内参,表1),2-ΔΔCt分析MEG3及miR-181b-5p表达水平(n=5)。1.2.5MTT法检测PC3细胞活力 于96孔板中接种转染后的各组PC3细胞(2×104个/孔、200 μL/孔),培养48 h后添加20 μL MTT溶液(5 mg/mL),4 h后弃培养液,添加DMSO 150 μL摇晃震荡至结晶溶解,在酶标仪490 nm处测定吸光度值(A490),细胞存活率(%)=[(实验组A值-空白组A值)/(对照组A值-空白组A值)]×100%,重复5孔。

表1 qRT-PCR引物
1.2.6Transwell实验检测PC3细胞侵袭能力 Matrigel胶包被上室,孵育24 h后,于含200 μL无血清培养基的上室接种转染后的PC3细胞(4×104个/孔),下室添加200 μL RPMI 1640培养基,培养48 h后经PBS冲洗,棉签擦去上室未穿膜细胞,15 min无水乙醇固定后进行结晶紫染色(30 min),随机选5个视野计数穿膜细胞数(n=5)。
1.2.7划痕实验检测PC3细胞迁移能力 于6孔板中接种转染后的PC3细胞(2×105个/孔),24 h后使用200 μL的枪头在6孔板底部进行划痕,PBS清洗后观察0 h与24 h细胞迁移距离,计算迁移率=[(0 h宽度-24 h宽度)/0 h宽度] ×100%,重复5孔。
1.2.8Western blot检测PC3细胞TIMP3、MMP9、MMP2蛋白表达 蛋白裂解液裂解转染后的PC3细胞(20 min),并提取总蛋白,使用BCA法定量,SDS-PAGE电泳分离蛋白,低温下转至硝酸纤维膜,在50 g/L的脱脂奶粉封闭液中封闭,4 ℃摇床上孵育兔抗TIMP3、MMP9、MMP2、β-actin抗体(1∶2 000),过夜后常温孵育2 h二抗(1∶3 000),使用ECL发光液在成像仪中显影,计算TIMP3、MMP9、MMP2蛋白表达(n=5)。
1.2.9双荧光素酶报告基因检测MEG3、miR-181b-5p、TIMP3的靶向关系 使用starBase网站预测miR-181b-5p分别与MEG3、TIMP3的结合位点;
扩增MEG3、TIMP3分别与miR-181b-5p结合的3’-UTR片段,与pmirGLO载体连接:构建pmirGLO-MEG3-wt、pmirGLO-TIMP3-wt野生型载体;
使用定点突变技术将结合片段突变,构建pmirGLO-MEG3-mut、pmirGLO-TIMP3-mut突变型载体。将PC3细胞分为pmirGLO-MEG3-wt+miR-181b-5p mimics组、pmirGLO-MEG3-wt+miR-NC组、pmirGLO-MEG3-mut+miR-181b-5p mimics组、pmirGLO-MEG3-mut+miR-NC组、pmirGLO-TIMP3-wt +miR-181b-5p mimics组、pmirGLO-TIMP3-wt+ miR-NC组、pmirGLO-TIMP3-mut+ miR-181b-5p mimics组、pmirGLO-TIMP3-mut+miR-NC组,将miR-NC、miR-181b-5p mimics分别与各重组质粒转染至PC3细胞中,24 h后使用双荧光素酶报告基因试剂盒检测海肾及萤火虫荧光值(海肾荧光值为内参),计算PC3细胞相对荧光素酶活性。
2.1 MEG3在PC组织和癌旁组织中表达水平的比较与癌旁组织相比,MEG3在前列腺癌组织中表达显著降低(0.37±0.05vs.1.00±0.04,P<0.05,图1)。
2.2 MEG3在人正常前列腺上皮细胞系(P69)和PC细胞系(DU145、LNCaP、PC3、22Rv1)表达水平的比较与在P69细胞中的表达(1.00±0.01)相比,MEG3在DU145(0.81±0.10)、LNCaP(0.63±0.09)、PC3(0.31±0.06)、22Rv1(0.76±0.12)细胞中表达显著降低,其中在PC3细胞中降低最为显著(P<0.05),故选取PC3细胞开展后续研究。
2.3 MEG3过表达对MEG3、miR-181b-5p、TIMP3蛋白表达的影响与对照组相比,pcDNA3.1-NC组MEG3、miR-181b-5p及TIMP3蛋白表达差异无显著统计学意义(P>0.05),pcDNA3.1-MEG3组miR-181b-5p表达显著降低,MEG3、TIMP3蛋白表达显著增加(P<0.05,表2、图2)。

*与癌旁组织相比,P<0.05;n=20。

表2 MEG3过表达对MEG3、miR-181b-5p、TIMP3表达的影响

A:对照组;
B:pcDNA3.1-NC组;
C:pcDNA3.1-MEG3组。
2.4 各组PC3细胞存活率比较与对照组相比,pcDNA3.1-NC组PC3细胞存活率差异无统计学意义(P>0.05),pcDNA3.1-MEG3组细胞存活率显著降低(P<0.05);
与pcDNA3.1-MEG3组相比,pcDNA3.1-MEG3+miR-NC组细胞存活率差异无统计学意义(P>0.05),pcDNA3.1-MEG3+ miR-181b-5p mimic组细胞存活率显著增加(P<0.05,表3)。
2.5 各组PC3细胞侵袭情况比较与对照组相比,pcDNA3.1-NC组PC3细胞侵袭细胞数无统计学差异(P>0.05),pcDNA3.1-MEG3组侵袭细胞数显著降低(P<0.05);
与pcDNA3.1-MEG3组相比,pcDNA3.1-MEG3+miR-NC组侵袭细胞数差异无统计学意义(P>0.05),pcDNA3.1-MEG3+ miR-181b-5p mimic组侵袭细胞数显著增加(P<0.05,表3、图3)。

表3 各组PC3细胞存活及侵袭情况比较

A:对照组;
B:pcDNA3.1-NC组;
C:pcDNA3.1-MEG3组;
D:pcDNA3.1-MEG3+miR-NC组;
E:pcDNA3.1-MEG3+ miR-181b-5p mimic组。
2.6 各组PC3细胞迁移情况比较与对照组相比,pcDNA3.1-NC组PC3细胞迁移率无统计学差异(P>0.05),pcDNA3.1-MEG3组迁移率显著降低(P<0.05);
与pcDNA3.1-MEG3组相比,pcDNA3.1-MEG3+miR-NC组迁移率无显著差异(P>0.05),pcDNA3.1-MEG3+ miR-181b-5p mimic组迁移率显著增加(P<0.05,表3、图4)。

A:对照组;
B:pcDNA3.1-NC组;
C:pcDNA3.1-MEG3组;
D:pcDNA3.1-MEG3+miR-NC组;
E:pcDNA3.1-MEG3+ miR-181b-5p mimic组。
2.7 各组PC3细胞MMP9、MMP2蛋白表达情况比较与对照组相比,pcDNA3.1-NC组PC3细胞MMP9、MMP2表达无统计学差异(P>0.05),pcDNA3.1-MEG3组MMP9、MMP2表达显著降低(P<0.05);
与pcDNA3.1-MEG3组相比,pcDNA3.1-MEG3+miR-NC组MMP9、MMP2表达无统计学差异(P>0.05),pcDNA3.1-MEG3+miR-181b-5p mimic组MMP9、MMP2表达显著增加(P<0.05,表4、图5)。
2.8 MEG3、miR-181b-5p、TIMP3靶向关系验证starBase网站预测miR-181b-5p与MEG3、TIMP3间均存在靶向关系(图6A、B)。双荧光素酶报告基因结果显示:与pmirGLO-MEG3-wt+miR-NC组相比,pmirGLO-MEG3-wt+miR-181b-5p mimics组PC3细胞荧光素酶活性显著降低(P<0.05),而pmirGLO-MEG3-mut+miR-181b-5p mimics组、pmirGLO-MEG3-mut+miR-NC组无显著差异(P>0.05,图7A);
与pmirGLO-TIMP3-wt+miR-NC组相比,pmirGLO-TIMP3-wt +miR-181b-5p mimics组PC3细胞荧光素酶活性显著降低(P<0.05),而pmirGLO-TIMP3-mut+miR-181b-5p mimics组、pmirGLO-TIMP3-mut+miR-NC组无显著差异(P>0.05,图7B)。与对照组相比,miR-NC组TIMP3表达(0.52±0.10vs.0.53±0.08)无明显变化(P>0.05),而miR-181b-5p mimics组TIMP3表达(0.21±0.05vs.0.53±0.08 )显著降低(P<0.05,图8)。

表4 各组PC3细胞MMP9、MMP2的蛋白表达

A:对照组;
B:pcDNA3.1-NC组;
C:pcDNA3.1-MEG3组;
D:pcDNA3.1-MEG3+miR-NC组;
E:pcDNA3.1-MEG3+ miR-181b-5p mimic组。
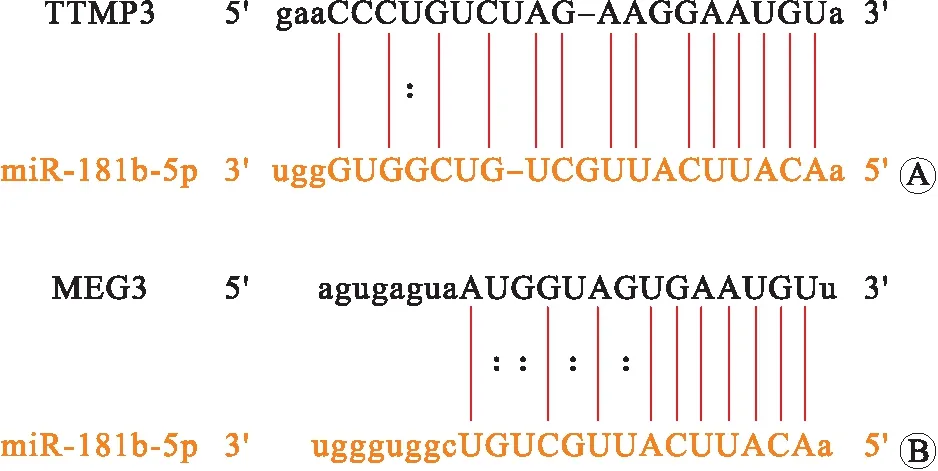
A:miR-181b-5p与TIMP3的结合位点;
B:miR-181b-5p与MEG3的结合位点。

A:MEG3与miR-181b-5p靶向关系验证(* 与pmirGLO-MEG3-wt+miR-NC组相比,P<0.05);
B:miR-181b-5p与TIMP3靶向关系验证(#与pmirGLO-TIMP3-wt+miR-NC组相比,P<0.05)。

A:对照组;
B:miR-NC组;
C:miR-181b-5p mimics组。
PC是男性最常见的一种恶性肿瘤疾病,也是全球癌症相关的男性死亡的第二大主要原因[6-7]。由于PC发病的隐匿性,多数患者自初次确诊时已出现转移,而肿瘤转移是导致PC患者死亡最主要的原因,因此,有效抑制PC细胞转移是患者治愈的关键[8-9]。转移是一个复杂过程,受多种因子及通路的调控,而目前关于PC转移及治疗机制的研究不甚清晰,因此还有待进一步研究[10]。
大量数据证实,lncRNA在调节癌症进展过程中具有重要作用,MEG3已被报道在胃癌、PC等多种癌症中具有抑癌作用[11-13]。MEG3在PC中异常下调,其过表达可通过抑制miR-9-5p/RNA结合蛋白QKI-5轴来抑制PC进展[3]。MEG3可通过与zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)相结合来促进同源异型盒基因EN2甲基化,从而抑制PC3细胞增殖、侵袭、迁移及肿瘤发生,起到抑癌作用[14]。但MEG3在PC中的作用机制研究还不够充分。本研究发现,MEG3在PC组织及癌细胞中表达显著下调,其过表达可显著降低细胞存活率、侵袭细胞数、细胞迁移率、MMP9和MMP2表达,该结果表明MEG3高表达可有效抑制PC细胞增殖、侵袭及迁移,与前人研究结果相一致,提示MEG3有作为PC转移有效抑制靶点的潜能[3]。
miRNA已被证明可作为癌基因或抑癌因子来促进或抑制侵袭性肿瘤表型,最近有研究发现,PC组织中多种miRNA存在差异表达[15]。研究证实,miR-181b-5p在PC细胞中表达异常升高,迁移和侵袭抑制蛋白MIIP可通过抑制miR-181a/b-5p表达来抑制PC3细胞的上皮间质转化及侵袭[1]。本研究发现,MEG3过表达可显著抑制miR-181b-5p表达,miR-181b-5p与MEG3间存在靶向关系,miR-181b-5p高表达则可逆转MEG3过表达对PC-3细胞增殖、侵袭及迁移的抑制作用,该结果表明,miR-181b-5p过表达具有促癌作用,与前人研究结果相一致[1]。有研究发现,circSMARCA5可通过抑制miR-181b-5p-TIMP3轴来抑制PC细胞增殖及侵袭[5]。TIMP3作为一种金属蛋白酶组织抑制剂,可抑制肿瘤迁移、侵袭[16]。TIMP3表达下调可加速PC肿瘤的生长及转移[5,17],本研究发现,MEG3过表达可促进PC-3细胞TIMP3表达,而miR-181b-5p过表达则可抑制TIMP3的表达,上述结果表明,MEG3过表达可能通过抑制miR-181b-5p来促进TIMP3表达,从而抑制PC3细胞侵袭、迁移。
综上所述,LncRNA MEG3在PC中低表达,lncRNA MEG3过表达可通过抑制miR-181b-5p/TIMP3轴来抑制PC细胞侵袭、迁移。本研究不仅对PC转移机制的研究具有一定参考价值,还对其治疗机制的研究具有重要意义,但本研究目前的研究内容尚不深入,有待后期深入验证。
猜你喜欢生物科技荧光素酶存活率深圳市爱康生物科技有限公司临床输血与检验(2022年4期)2022-08-22山西蜂之歌生物科技有限公司蜜蜂杂志(2022年5期)2022-07-20NNMT基因启动子双荧光素酶报告系统的构建及其与SND1靶向关系的验证天津医科大学学报(2021年4期)2021-08-21园林绿化施工中如何提高植树存活率建材发展导向(2021年11期)2021-07-28美亚生物科技海峡科技与产业(2021年1期)2021-05-22不同双荧光素酶方法对检测胃癌相关miRNAs靶向基因TIAM1的影响中日友好医院学报(2021年1期)2021-04-14重组双荧光素酶报告基因质粒psiCHECK-2-Intron构建转染及转染细胞萤火虫荧光素酶和海肾荧光素酶表达山东医药(2020年9期)2020-05-20损耗率高达30%,保命就是保收益!这条70万吨的鱼要如何破存活率困局?当代水产(2020年10期)2020-03-17水产小白养蛙2年,10亩塘预计年产3.5万斤,亩纯利15000元!存活率90%,他是怎样做到的?当代水产(2019年8期)2019-10-12生物科技让里约奥运更安全知识就是力量(2016年8期)2016-11-02本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0913/653724.html




