【www.zhangdahai.com--其他范文】
王 苗,王全凯,李昕苇,马顺鹏,乌瀚宝栎尔,许建宁,
(1.中国疾病预防控制中心职业卫生与中毒控制所,北京 100050;
2.中国疾病预防控制中心化学污染与健康安全重点实验室,北京 100050)
甲基丙烯酸环氧丙酯(glycidyl methacrylate,GMA)是一种聚合反应用单体,其反应产物可作为牙科和骨科中使用的密封剂和黏合剂,也作为加工过程的副产品或包装成分存在于食品中。GMA慢性吸入染毒,可观察到大鼠、小鼠发生鼻腔鳞状细胞癌、支气管肺泡癌、子宫内膜间质肉瘤等多种类型肿瘤。2019年国际癌症研究中心(International Agency for Research on Cancer,IARC)将GMA归类为“对人类很可能致癌物”(2A类)。化学致癌物的致癌过程,涉及基因突变和表观遗传改变及其相互作用。研究表明,GMA具有致突变性,可引起人和哺乳动物细胞发生基因突变、染色体畸变等;
但其致癌机制中表观遗传学部分有关RNA修饰的内容尚未见研究报道。
N-甲 基 腺 嘌 呤(N-methyladenosine,mA),即RNA中腺苷酸(A)第6位N原子上发生的甲基化,是真核生物mRNA中最丰富的表观转录组学修饰。mA修饰受到甲基转移酶、去甲基化酶动态可逆的调控,并且通过与识别蛋白的结合影响mRNA的加工和代谢过程,调控基因表达。研究表明mA RNA甲基化在肿瘤的形成和发展中扮演着重要的角色。本研究利用高通量人类表观转录组芯片结合生物信息学方法,对GMA诱导的恶性转化人支气管上皮细胞(16HBE)的mRNA mA修饰水平和mRNA表达水平进行分析,筛选出mA修饰的mRNA并进行功能解释,为从表观遗传学角度进一步研究GMA的致癌机制奠定基础。
1.1 试剂与仪器
甲基丙烯酸环氧丙酯(纯度≥98.5%)、二甲基亚砜(dimethyl sulfoxide,DMSO)均购于美国Sigma公司;
MEM培养基(minimum essential medium,MEM)和胎牛血清由美国Gibco公司生产;
青链霉素混合液购于北京索莱宝科技有限公司;
TRIzol试剂购于上海碧云天生物技术有限公司;
RNA Flash Labling Kit和RNA标记试剂盒由美国Arraystar公司生产;
RNA逆转录试剂盒和DynabeadsM-280绵羊抗兔IgG抗体由美国Invitrogen公司生产;
亲和纯化抗mA兔多克隆抗体由德国Synaptic Systems公司生产;
RNase抑制剂由美国Enzymatics公司生产;
RNA提取试剂盒由QIAGEN公司生产。
CO恒温培养箱购于美国Thermo Fisher公司;
台式高速低温离心机购于美国Beckman公司;
倒置显微镜购于日本Olympus公司;
ND-1000分光光度计购于美国NanoDrop公司;
Arraystar Human mRNA &lncRNA Epitranscriptomic Arrays芯片技术服务和引物设计的技术支持由上海康成生物公司提供。
1.2 高通量人类表观转录组芯片检测
细胞培养与GMA诱导16HBE细胞恶性转化的方法参照杨敏等的报道。本课题组既往研究已证实,以8μg/mL浓度GMA(DMSO为对照组)重复染毒16HBE细胞后,传代至第30代的细胞具备恶性转化细胞的生物学特性。采用TRIzol提取并收集细胞总RNA。使用Nanodrop ND-1000对每个样本的总RNA进行定量,使用抗N-甲基腺苷(mA)抗体免疫沉淀,mA修饰的RNA从免疫沉淀磁珠中洗脱,称为“IP”,未修饰的RNA从上清液中回收作为“Sup”。将“IP”和“Sup”RNA扩增为cRNA,并分别使用Arraystar Super RNA标记试剂盒进行Cy5和Cy3标记。将标记的cRNA混合,在Agilent杂交箱中于65℃下与芯片杂交17 h。洗涤芯片后,用Agilent Scanner G2505C在双色通道中扫描获得阵列图像。
1.3 m6A修饰水平异常mRNA和表达水平异常mRNA的筛选
使用Agilent特征提取软件(v11.0.1.1)对采集到的阵列图像进行分析。IP(免疫沉淀,Cy5标记)和Sup(上清液,Cy3标记)的原始信号值进行数据标准化后,经过筛选高质量探针(某探针在6个样品中至少有1个被标记为Present或Marginal)进行进一步分析。mA甲基化水平根据转录物中修饰RNA的百分比进行计算;
在探针标记筛选之前,使用limma软件包的分位数标准化方法对阵列间RNA表达水平进行标准化,RNA表达水平以转录本中修饰RNA和未修饰RNA的总量计算。
P
<0.05作为阈值,筛选两组样品间mA修饰水平差异的mRNA和表达水平差异的mRNA。采用分级聚类的方法对两组样本间mA修饰水平差异的mRNA进行展示,将筛选出的表达水平差异mRNA以散点图的形式进行可视化。1.4 mRNA m6A修饰水平与mRNA表达水平的联合分析
经上述步骤可得GMA诱导16HBE细胞恶性转化相关的mRNA mA修饰水平和mRNA表达水平,使用Visual Studio Code软件进行数据处理,将这两个表达谱中的mRNA互相取交集,得到mA修饰的mRNA,结果以四象限图表示。
1.5 m6A修饰mRNA的GO富集分析和KEGG通路分析
以人类基因组为背景对照,利用在线分析工具Omicshare(https://www.omicshare.com/tools/)进一步对上述mA修饰mRNA进行功能解释,即GO富集分析和KEGG通路分析。GO分析使用0.05的阈值识别显著丰富的GO术语,通路分析利用KEGG数据库的超几何检验进行富集分析,阈值为0.05。
2.1 GMA诱导16HBE细胞恶性转化过程中m6A修饰水平异常的mRNA
利用NanoDrop ND1000分光光度计检测GMA组和DMSO组16HBE第30代细胞提取的RNA,确证所提取样本RNA质量达到要求,如表1所示。采用高通量人类表观转录组芯片检测得到mRNA mA甲基化修饰谱,设置阈值为|FC|≥2且P
<0.05,筛选获得GMA组和DMSO对照组间mA修饰水平差异的mRNA,结果以热图形式显示(图1)。与DMSO组比较,GMA组细胞中mA修饰水平差异的mRNA共有454个,其中高甲基化水平的mRNA 334个、低甲基化水平的mRNA 120个。
表1 GMA组和DMSO组细胞RNA提取质量检测结果
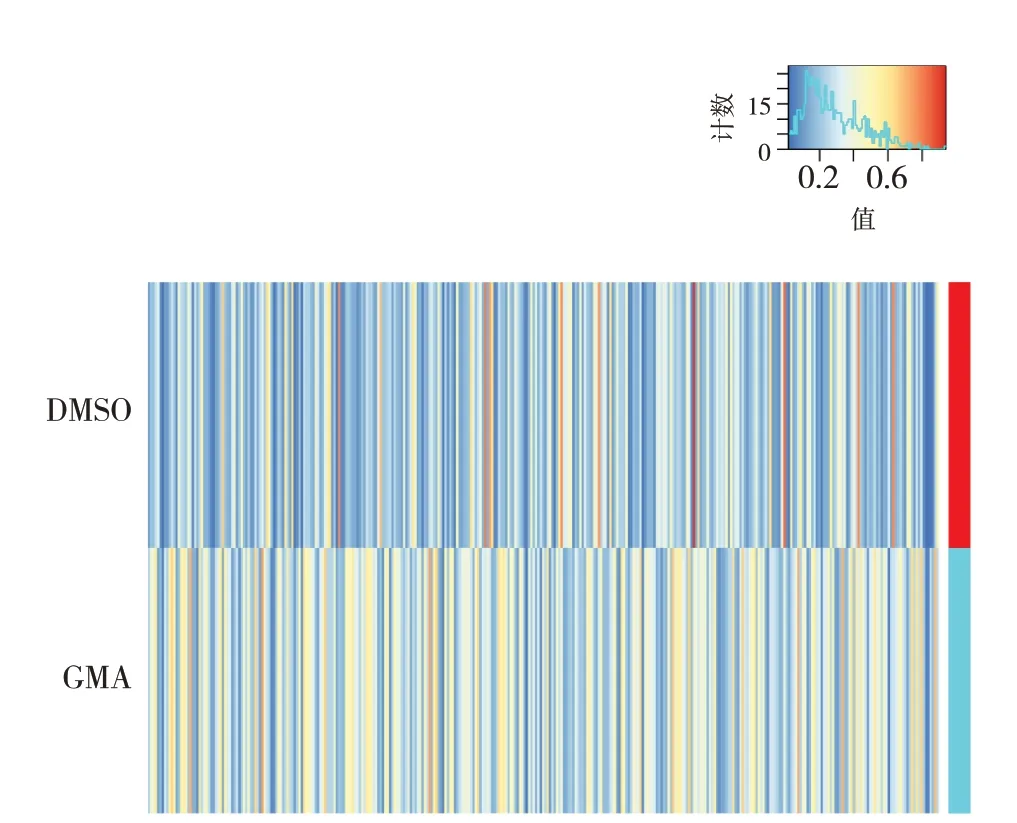
图1 GMA诱导16HBE第30代细胞恶性转化过程中m6A修饰水平异常的mRNA
2.2 GMA诱导16HBE细胞恶性转化过程中表达水平异常的mRNA
采用高通量人类表观转录组芯片检测结果,以转录本中修饰RNA和未修饰RNA的总量计算mRNA的表达水平,共有3 8647个mRNA。设置阈值为FC≥2且P
<0.05,筛选得到GMA组和DMSO对照组间差异表达的mRNA,结果以散点图形式显示(图2)。与DMSO对照组比较,GMA组细胞中差异表达的mRNA共有434个,其中高表达水平mRNA为236个,低表达水平mRNA为198个。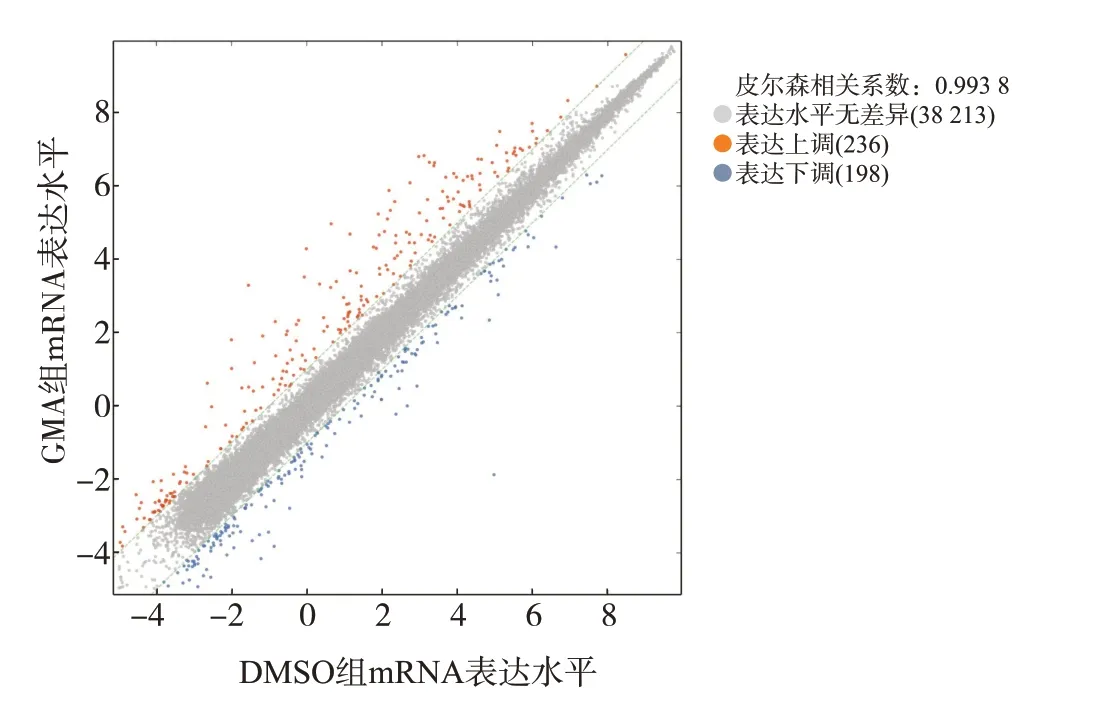
图2 GMA诱导16HBE细胞恶性转化过程中表达水平异常的mRNA
2.3 恶性转化的16HBE细胞中m6A修饰mRNA的GO富集分析和KEGG通路分析
GMA诱导16HBE细胞恶性转化过程中mRNA mA修饰水平与其表达水平进行联合分析,结果如图3所示,mA修饰的mRNA共有45个。GO富集分析显示,mA修饰mRNA主要富集于SNAP受体活性、SNARE结合、SNARE复合体等,具体见表2;
KEGG通路分析显示,以上基因主要富集于囊泡运输中的SNARE相互作用、非同源末端连接、苯丙氨酸代谢通路(表3)。
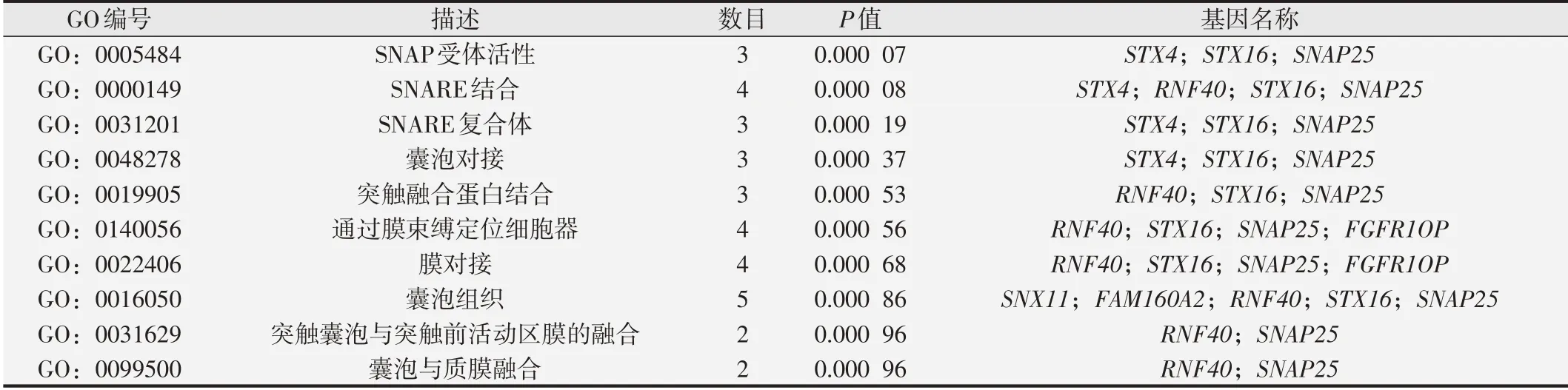
表2 m6A修饰mRNA的GO数据库富集分析结果(前10项)

表3 m6A修饰mRNA的KEGG通路数据库富集分析结果

图3 mRNA m6A修饰水平与其表达水平的联合分析
表观遗传是在不改变DNA基本序列的前提下通过调控基因组与环境之间的相互作用而调控基因表达的可遗传或可继承机制的统称,表观遗传异常被认为是最重要的致癌机制之一,主要包括DNA甲基化、组蛋白修饰、染色质重塑、RNA修饰等。所有RNA修饰中,mA修饰是真核生物RNA中最常见也是分布最广泛的表观转录修饰。mA修饰由RNA甲基转移酶(如METTL3和METTL14等)催化形成,由去甲基酶(如FTO和ALKBH5等)去除,并经mA结合蛋白(如YTHDF1和IGF2BP1等)识别来发挥功能。对真核生物中mRNA mA修饰的研究发现,mA修饰与mRNA的剪接、降解、翻译及环状RNA翻译等生物学过程密切相关。研究发现,METTL3在胶质母细胞瘤干细胞(GSCs)中表达上调,通过增加干性基因SOX2
mRNA的稳定性实现GSCs干性维持和放疗抵抗。METTL14可能通过促进抑癌因子pri-miR-126和DGCR8的结合,抑制肝细胞癌细胞转移。因此,对mRNA mA修饰的研究将有助于揭示GMA诱导16HBE细胞恶性转化的表观遗传机制。本研究利用高通量人类表观转录组芯片对GMA诱导的恶性转化细胞及同代龄对照组细胞进行检测和筛选,发现两组细胞间mA修饰水平差异的mRNA共有454个,表达水平差异mRNA共有434个,进一步对mRNA甲基化水平与其表达水平联合分析,获得mA修饰的mRNA,提示GMA诱导16HBE细胞恶性转化过程中mRNA mA修饰可能发挥重要作用。通过GO富集分析和KEGG通路分析,发现mA修饰mRNA富集于SNAP受体活性、SNARE结合、SNARE复合体等相关的基因功能,以及囊泡运输中的SNARE相互作用、非同源末端连接、苯丙氨酸代谢等通路中。SNARE蛋白介导分泌囊泡与质膜的锚定、融合,是真核细胞中调节膜融合的关键因子,参与多种细胞功能。Meng等发现SNARE蛋白参与肿瘤的发生发展进程。SNARE蛋白syntaxin4(STX4)通过与Munc18c蛋白相互作用促进肿瘤细胞侵袭伪足形成和细胞外基质侵袭。He等发现STX4在肾透明细胞癌组织中高表达。在畸胎瘤中发现,细胞外STX4激活F9细胞分化程序,从而影响细胞黏附特性。SNARE相关通路是参与肿瘤发生发展过程的重要信号通路,本研究结果提示其可能通过mA修饰参与GMA诱导16HBE细胞恶性转化过程。通过各种DNA修复机制对细胞遗传损伤及维持基因组稳定性作出响应,在肿瘤的发生发展过程中至关重要。通路分析富集到的另一通路非同源末端连接(non-homologous end joining,NHEJ),是指在不依赖DNA同源性的情况下,在一些修复元件的参与下将断裂两端的DNA直接连接的修复过程,是真核生物的主要修复方式。其中,X射线修复交叉互补基因4(X-ray repair cross complementing protein 4,XRCC4)在NHEJ通路中发挥着重要作用,是维持基因组稳定性的重要基因。研究表明,XRCC4的遗传多态性与乳腺癌、食管癌、宫颈癌等多种癌症易感性相关。基于表观转录组芯片结合生物信息学方法分析得到与GMA诱导16HBE细胞恶性转化关系密切的基因功能信息,尚需进一步研究验证,但本研究结果的部分内容与已发表文献相符,提示本研究获得的通路及基因功能信息具有研究价值。
综上所述,本研究使用高通量芯片检测GMA诱导16HBE恶性转化细胞,得到mA修饰的mRNA,结合GO富集分析和KEGG通路分析,推测这些mRNA可能通过mA修饰经囊泡运输中的SNARE相互作用、非同源末端连接等通路在GMA诱导16HBE细胞恶性转化过程中发挥重要作用。
本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0412/583221.html