【www.zhangdahai.com--其他范文】
谢学辉, 赵江贵, 方英荣, 秦 艳,陈小光,杨珊珊, 宋新山, 刘 娜,张庆云
(1.东华大学 环境科学与工程学院/国家环境保护纺织工业污染防治工程技术中心/中国纺织工业联合会纺织行业污染治理与减排技术重点实验室,上海 201620;
2.上海污染控制与生态安全研究院,上海 200092;
3.宿州学院 环境与测绘工程学院,安徽 宿州 234000;
4.安徽工程大学 化学与环境工程学院,安徽 芜湖 241000)
“衣”“食”“住”“行”被称为人类的四大基本需求,其中 “伴衣而生”的纺织行业是我国国民经济的传统支柱型产业和民生产业。然而,纺织制造工艺中会产生大量染料废水,这些废水具有高色度、高盐度、高化学需氧量(COD)和酸碱性强等特点,处理难度高[1]。在所有已知的染料中,偶氮类染料是应用最广泛的一种,约占工业染料的2/3,它是指含有一个或以上偶氮基(—N=N—)并连接有至少一个芳香结构的染料[2-3],这类染料废水水质复杂,有机物成分含量高,可生化性差,其不完全降解可能产生苯胺类物质[4],会对生态环境和人体健康造成巨大危害。
目前,对染料废水的处理主要采用物理处理法、化学处理法和微生物处理法等[5]。其中物理处理法和化学处理法主要采用絮凝、混凝、吸附和膜过滤等方法。这些方法并不能很好地去除水中的染料及其降解中间产物,且在处理过程中均会产生大量的污泥,造成二次污染的同时也会增加处理成本[5-6]。相比之下,微生物处理法是一种经济、环保、高效的染料废水处理技术[7]。利用微生物(细菌、真菌等)的代谢作用去除废水中的有机物质,作用条件温和,去除效率高,不会造成二次污染[8]。CAO等从当地一家染色厂分离出一种名为YHK的菌群,经研究发现该菌群对磺化偶氮染料(DB2)的脱色效率达90%以上[9]。此类微生物处理法降解染料废水的研究还有很多[10-12]。
通常情况下,微生物降解染料废水的能力与微生物的活性直接相关。然而,由于制造工艺的多样性,染料废水的性状往往波动较大,其中重金属、盐度、pH和温度等会影响微生物的活性[9],降低微生物降解效率。微生物固定化技术有望解决这一问题。相比游离态的微生物,固定化后的微生物具有密度高、耐毒、处理效率高等优势[13-15]。已有许多有关微生物固定化技术的研究,如:
CAI等使用聚乙烯醇-海藻酸钙-活性炭固定分离出的芽孢杆菌JF4,且JF4-固定化珠10 d内对100 mg/L活性蓝19染料的脱色效率接近100%,而相同条件下游离的芽孢杆菌JF4在12 d内脱色效率仅为92.1%[16]。DURRUTY等利用天然植物材料丝瓜络作为载体固定真菌,形成丝瓜络-真菌系统用于偶氮染料直接黑22号脱色,固定化后的真菌生长速度是游离化真菌的9倍,脱色效率增加了2倍[17]。
本研究采用课题组前期从水解酸化反应器污泥样品中驯化筛选得到的天然功能菌群DDMZ1做固定化,分析对比了经聚乙烯醇-海藻酸钠-沸石固定化的DDMZ1小球与游离化DDMZ1菌液对偶氮染料活性黑5的脱色效果。同时分别对游离化DDMZ1菌液和循环使用20次与30次的固定化DDMZ1小球进行群落结构分析,探究其微生物组成的差异性。研究结果对于了解聚乙烯醇-海藻酸钠-沸石复合固定化材料对功能菌群DDMZI的脱色效果和微生物群落结构的影响有指导作用。
1.1 材料和仪器设备
1.1.1 功能菌群DDMZ1
功能菌群DDMZ1是由本课题组通过浓度梯度压力驯化法从上海松江污水处理厂二沉池的活性污泥中筛选得到。该菌群在兼氧、37 ℃、pH为5.5时生长状态最佳,生长速率较快且延迟期短(约2 h),可迅速进入对数生长期以进行染料代谢活动[4,18]。
1.1.2 实验材料
基础培养基(溶剂:去离子水,其中KH2PO42.66 g/L,NH4Cl 0.2 g/L,无水硫酸钠 0.5 g/L,Yeast extract 3 g/L)
交联剂:质量分数为 4%的CaCl2饱和硼酸溶液。
上述所有培养基和交联剂均在115 ℃灭菌30 min后冷却备用。
聚乙烯醇1 750±50 (沪试)、人造沸石(20~40目)(CP)、氢氧化钠(AR)、硼酸和 25% 戊二醛(GR),均购自国药;
Sodium alginate(AR,购自上海生工);
活性黑5(RB5,购自Sigma-Aldrich);
无水氯化钙 AR,购自GENERAL-REAGENT©);
丙酮(GR,购自永华化学)。
1.1.3 仪器设备
恒温磁力搅拌器(Feb-85,上海梅颖浦仪器仪表制造有限公司);
电热恒温培养箱(HPX-9052MBE,上海博讯实业有限公司医疗设备厂);
电热恒温鼓风干燥箱(DGG-9030DB,上海森信实验仪器有限公司);
立式高压蒸汽灭菌器(LDZM-40L-I,上海申安医疗器械厂);
超声波清洗器(KQ-100B,昆山市超声波仪器有限公司);
磁力搅拌加热锅(ZNCL-GS型190*90,上海越众仪器设备有限公司);
微量紫外分光光度计(2166型,IMPLEN)。
1.2 实验方法
1.2.1 游离化DDMZ1菌液的制备
取1 mL保存于-80 ℃的DDMZ1浓缩液接种于100 mL的基础培养基中,在恒温培养箱(兼氧pH=5.5、37 ℃)中进行活化培养[19]。培养48 h后,取10 mL培养液接种到90 mL新鲜基础培养基中传代培养,连续培养2代后达到菌群的稳定生长期。再次取10 mL稳定生长的菌液接种到90 mL新鲜培养基中,即制得游离化DDMZ1菌液。
1.2.2 固定化DDMZ1小球的制备
固定化DDMZ1小球制备方法依照文献[20]进行,使用聚乙烯醇(PVA)和海藻酸钠(SA)作为菌液包埋载体,并添加沸石作为吸附剂。具体操作如下:室温下在烧杯中用去离子水溶解SA(1%);
另备一只烧杯倒入适量去离子水并置于96 ℃水浴锅中,加入PVA(8%)搅拌使其溶解;
接着用一次性注射器分别取10 mL SA溶液和PVA溶液,将二者混合均匀后制成20 mL含有SA和PVA的包埋液,利用水浴锅将包埋液温度控制在37 ℃。随后,取沸石液加入湿菌体并充分混合均匀,接着取适量沸石混合液加入包埋液中,控制沸石浓度约为2%。最后使用一次性注射器吸取最终混合液,并将注射器悬空置于盛有交联剂的烧杯正上方约10 cm处,缓慢滴入60 mL混合液至交联剂中。交联固定一定时间以后,使之形成直径较为均匀的小球,用生理盐水冲洗2~3次后密封于4 ℃保存备用。
1.2.3 脱色实验
将10 mL游离化DDMZ1菌液和体积相近的一定数量固定化DDMZ1小球分别放入含有90 mL基础培养基的锥形瓶中,加入RB5使其最终质量浓度为100 mg/L。密封后放入恒温培养箱中静置培养,于24、48、72 h分别取2 mL样品离心(12 000 r/min, 4 ℃)10 min后测定上清液在597 nm波长的吸光度,每次实验重复3次,结果取平均值。按照式(1)计算不同时间节点的脱色率(D)。
D=(A0-At)/A0×100%
(1)
式中:A0为染料溶液脱色前的吸光度值;
At为染料溶液脱色t时的吸光度值。
1.2.4 固定化功能菌群DDMZ1群落结构
采用高通量测序方法分析固定化技术及固定化后循环使用批次对DDMZ1菌群微生物群落多样性的影响。
1) DNA抽提。实验菌液和固定化小球均在37 ℃下静置培养,RB5 染料的初始质量浓度均为100 mg/L。在基础培养基中接种10%(体积比)菌液培养48 h后到达稳定生长期,抽取样品记为DDMZ1;
在固定化小球循环使用达20批次时抽取样品记为IMDDMZ11(60 d);
在固定化小球循环使用达30批次时抽取样品记为IMDDMZ12(90 d)。其中固定化小球样品需先放在4 ℃冰箱中冷干后,移至超净工作台上用灭菌后的刀片将其粉碎、超声处理后装入无菌离心管中以待检测。用土壤 DNA 提取试剂盒E.Z.N.A.© (Omega Bio-tek, Norcross, GA, U.S.)完成基因组DNA抽提后,使用1%琼脂糖凝胶电泳对基因组DNA进行检测。
2) PCR扩增和荧光定量。以提取的DNA为模板,使用引物515F(5′-GTGCCAGCMGCCGCGG-3′)和907R(5′-CCGTCAATTCMTTTRAGTTT-3′)扩增16S rDNA基因序列。PCR反应参数依次为:首先在95 ℃下预解链3 min;
随后进行循环:95 ℃解链30 s,55 ℃退火30 s,72 ℃延伸45 s,此循环操作进行27次;
接着在72 ℃下延伸10 min,并于10 ℃停止。最后将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统进行检测定量。
3) Miseq文库构建和测序。通过PCR将Illumina官方接头序列添加至目标区域外端;
使用凝胶回收试剂盒切胶回收PCR产物;
用Tris-HCl缓冲液洗脱,2%琼脂糖电泳检测;
氢氧化钠变性后产生单链的DNA片段;
将DNA片段固定在芯片上;
PCR扩增产生DNA簇,随后DNA扩增子线性化成为单链;
加入DNA聚合酶(改造后)和dNTP(带有4种荧光标记);
用激光扫描,读取模板序列上的核苷酸种类;
将“荧光基团”和“终止基团”化学切割,恢复3′端黏性,继续聚合第二个核苷酸;
统计每轮收集到的荧光信号结果,以获知模板DNA片段的序列[21-22]。
4) 微生物生物信息分析。高通量测序后将初始fastq格式的文件用QIIME(Quantitative Insights into Microbial Ecology)质控过滤统计优化序列,使用相同数量序列以比对不相同样品的微生物菌群结构[23]。使用Mothur 1.30.2软件生成α多样性指数和稀释曲线。并将有效序列用RDP Classifier 2.11软件序列分类注释,采用R安装包对样品运行主成分进行分析(PCA)。
2.1 脱色效果
游离化DDMZ1菌液和固定化DDMZ1小球对RB5偶氮染料脱色效果如图1所示。
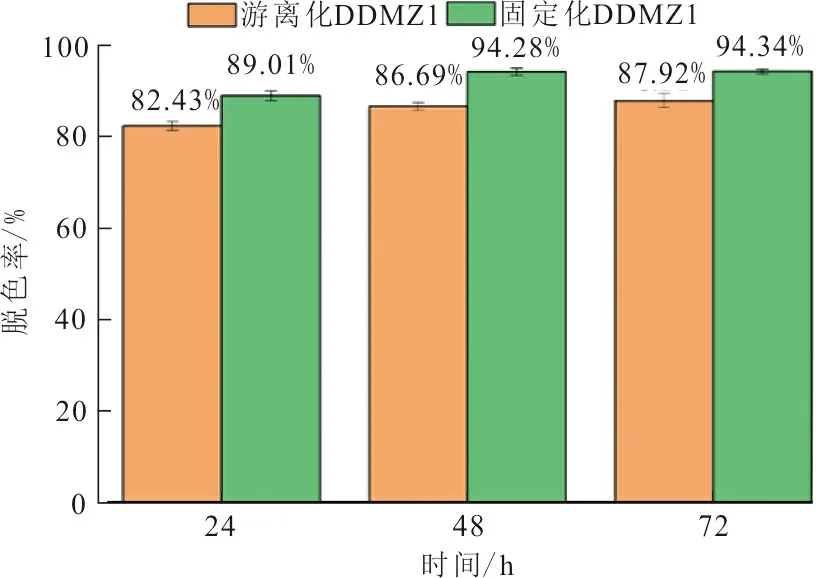
图 1 游离化DDMZ1菌液与固定化DDMZ1小球脱色效果Fig.1 Decolorization effect of free DDMZ1 bacterialsolution and immobilized DDMZ1 pellets
总体看来,固定化DDMZ1小球脱色效果优于游离化DDMZ1菌液。24 h时固定化DDMZ1小球脱色率为89.01%,甚至高于72 h时游离化DDMZ1菌液的脱色率(87.92%),这表明其脱色速率得到了显著提升。至72 h时固定化DDMZ1的脱色率达到了94.34%,相比游离化DDMZ1菌液提高了6.42%。此外,本课题组前期的研究表明,固定化DDMZ1小球实现了微生物与载体材料的多位点结合,其内部结构稳定,大大降低了外部环境对微生物细胞的影响,使得固定化DDMZ1小球可适应更加复杂的工作环境[20]。因此可推测,固定化是脱色效率和速率提高的最主要因素,固定化DDMZ1小球在实际RB5偶氮废水处理中更具价值。
2.2 固定化功能菌群DDMZ1群落结构分析
通过Illumina MiSeq 高通量微生物多样性测序方法分析固定化和循环使用批次对功能菌群中微生物群落结构的影响。样品DDMZ1、IMDDMZ11和IMDDMZ12分别产生了61 598、48 792和58 487个有效序列数目,以此序列数目结果来比较测序结果。
1) 主成分分析。基于OTU分析不同样本群落组成可以反映样本间的差异和距离,PCA主成分分析运用方差分解,将多组数据的差异反映在二维坐标图上,坐标轴取能够最大反映样品间差异的2个特征值。样本物种组成越相似,反映在PCA图中的距离越近。
图2为各类样品微生物群落组成的PCA分析结果,其中第一主成分(PC1)和第二主成分(PC2)分别可以解释91.86%和8.15%。可以看到,样品DDMZ1与IMDDMZ11和IMDDMZ12的直线距离均较远,其两两之间数据投影的PC1和PC2均较大。故可说明,样品DDMZ1相对另外2组样品在微生物群落结构上有显著的差异。而样品IMDDMZ11和IMDDMZ12在图中显示PC1差距较小,且直线距离相对较近,说明IMDDMZ11和IMDDMZ12的微生物群落结构具有一定的差异性,但总体组成较为相似。
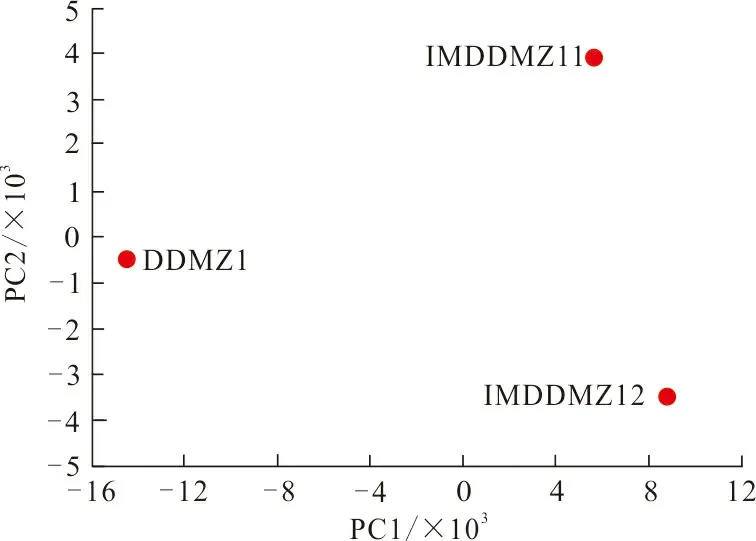
图 2 基于各类样品微生物群落组成的PCA分析Fig.2 PCA analysis of microbial community of various samples
2) 稀释性曲线。稀释性曲线可用来比较测序数据量不同的样本中物种的丰富度及说明样本的测序数据量的合理性。采用对序列随机抽样的方法,以抽到的序列数与它们所能代表各分类学水平的数目构建稀释性曲线。当曲线趋向平坦时,说明测序数据量合理。
图3为各类样品OTUs的稀释性曲线。由图3知,3个样品的稀释性曲线随着分析序列数据量的增加均呈现逐渐平缓稳定的趋势。这不仅表明高通量测序数据量合理,数据分析结果可信度高,更说明测序数据达到饱和状态,能够覆盖功能菌群DDMZ1和固定化DDMZ1小球微生物组群落的大范围物种。

图 3 各类样品OTUs的稀释性曲线Fig.3 Rarefaction curves for OTUs of various samples
3) 环境微生物群落多样性指数。样品中的Chao指数数值越大,样品中群落的丰富度越高。Shannon指数和Simpson指数则反映样品中细菌群落的多样性,Shannon指数越大,Simpson指数越小,说明微生物的群落结构组成多样性越丰富,反之则相反[24]。3组样品的对应指数如表1所示。

表 1 样品的微生物多样性指数和序列信息
从表1可以看出,在97%的相似水平下的OTU进行生物信息统计分析结果中,样品DDMZ1、IMDDMZ12和IMDDMZ11分别划分为13、21和23个分类单元(OTUs)。Coverage 是样品(克隆)文库的覆盖率,数值越高,样品中序列被测出的概率越高。2组固定化DDMZ1小球的样品Chao和Shannon指数均明显高于游离化DDMZ1菌液样品,说明该菌群经固定化后群落的丰富度得到了显著提高。从循环使用20批次和30批次的2组样品IMDDMZ11、IMDDMZ12对比可看出,样品IMDDMZ12的Chao指数略有下降,且Shannon指数较小,而Simpson指数略大;
这表明循环批次对固定化DDMZ1小球的群落丰富度和多样性有一定的影响。循环30批次的群落丰富度和群落多样性均略有下降。但是相差不大,整体趋于稳定。
4) 不同分类学水平的固定化微生物群落结构。根据RDP Classifier分析结果,可得3个样品序列以门、纲、科和属水平划分的群落物种结构组成情况。根据群落Bar图可直观得出不同分类学水平上各样品的微生物种类及样品中各微生物的相对丰度(所占比例),结果见图4。

(a) 门水平

(b) 纲水平

(c) 科水平图 4 不同分类学水平上3个样品的微生物群落结构Fig.4 Microbial community analysis in three samples at different levels
图4表明3个样品间的微生物群落结构组成和丰富度具有明显差异。在群落组成门的分类水平上,3个样品的微生物群落结构组成显现出相似的多样性而差异化的丰度,见图4(a)。变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)、拟杆菌门(Bacteroidota)和脱硫菌门(Desulfobacterota)是其检测出的五大菌门。变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)是游离化DDMZ1菌液样品的两大优势菌群,这一检测结果与本课题组之前的检测结果及在厌氧或兼氧条件下可降解脱色染料相一致[25]。而在固定化DDMZ1小球分别循环使用20次和30次的样品检测中出现了特有的拟杆菌门(Bacteroidota)、放线菌门(Actinobacteriota)和脱硫菌门(Desulfobacterota)。循环使用20次的样品IMDDMZ11其主要优势菌群为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota);
循环使用30次样品IMDDMZ12优势菌群为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)和放线菌门(Actinobacteriota)。可看出样品IMDDMZ12中放线菌门(Actinobacteriota)的丰度较样品IMDDMZ11明显提高,其他3种优势菌群的丰度略有降低。有研究表明在好氧颗粒污泥处理实际印染废水中拟杆菌门(Bacteroidetes)是其优势菌门[26],厌氧/好氧反应器降解直接染料中放线菌门(Actinobacteriota)、拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)等优势菌群对染料的脱色降解起主要作用[27]。
此外,将甲基红、甲基橙、茜黄素R钠盐、金橙I和混合染料作为Winogradsky模拟的反应器中的染料废水,用序批式间歇补料运行方式污泥对其进行脱色降解,分离出的微生物组成群落中拟杆菌门(Bacteroidota)是优势菌群,其次是厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),印染废水降解中厚壁菌门能在极端环境因子下生长,且经多种染料驯化后的污泥里,该菌依旧存在[28]。实验中功能菌群DDMZ1经复合载体固定化循环降解RB5偶氮染料(初始质量浓度100 mg/L) 20次后,微生物群落多样性和厚壁菌门的丰度得到了显著提升,为处理染料废水寻找高效混合菌群及其固定化提供研究应用依据。
图4(b)呈现出3个样品在群落组成纲的分类水平上的微生物群落相对丰度。变形菌门的γ-变形菌(Gammaproteobacteria)在DDMZ1样品中占据优势,占比约为80%,但在IMDDMZ11和IMDDMZ12样品中的其相对丰度所占比例明显减少,仅约为45%和38%。厚壁菌门的芽孢杆菌纲(Bacilli)在3个样品的菌群相对丰度中相差不大,它被证明可降解蒽醌和甲基红染料[29]。但拟杆菌门的拟杆菌纲(Bacteroidia)、厚壁菌门的梭菌纲(Clostridia)和脱硫菌门的脱硫杆菌纲(Desulfobacterota)在IMDDMZ11样品中依次增加了约20%、7%和2%;
在IMDDMZ12样品中增加量依次约为15%、7%和1.5%,此外 IMDDMZ12样品中放线菌门的放线菌纲(Actinobacteria)丰度大幅增加,增加量约为样品DDMZ1的13%。结果表明,固定化DDMZ1小球的微生物群落多样性较游离化DDMZ1菌液增加,且随着降解RB5染料的循环批次增加,放线菌纲(Actinobacteria)的丰度得到提升,并使得该菌群结构组成所占的相对丰度更趋均匀化。
在群落组成科的分类水平上共检测到22种菌,结果如图4(c)所示。在3个样品中共有的肠杆菌科(Enterobacteriaceae)的相对丰度较大,鼠孢菌科(Sporomusaceae)相对丰度较小。肠球菌科(Enterococcus)的相对丰度在样品DDMZ1中较小,在IMDDMZ11和IMDDMZ12中较大,有研究表明其降解RR198染料(初始质量浓度10~25 mg/L)的脱色率高于98%[30]。在样品DDMZ1中黄单胞菌科(Xanthomonadaceae)是其第二优势菌群,还有少量的产碱菌科(Alcaligenaceae)和假单胞菌科(Pseudomonadaceae),该菌可用于生物絮凝剂,使活性嫩黄K-4G和活性翠蓝KN-G 等可溶性的活性染料絮凝沉淀[31]。而在样品IMDDMZ11和IMDDMZ12中检测出特有的梭菌科(Clostridiaceae)、黄杆菌科(Flavobacteriaceae)、兼性厌氧菌科(Dysgonomonadaceae)、链球菌属(Streptococcaceae)和脱硫杆菌属(Desulfovibrionaceae)等,两者群落结构组成相似度高,其中样品IMDDMZ12中链球菌属(Streptococcaceae)丰度较大。总之,3个样品的群落结构组成和相对丰度表明固定化DDMZ1小球相比游离化DDMZ1菌液显著地改变了其微生物群落结构组成和相对丰度,且固定化DDMZ1小球群落组成稳定性高,循环使用批次对其微生物群落结构组成的影响较小,仅存在部分菌种的丰度变化。
图5为3个样品中属的Heatmap图,其中每个矩形的色块颜色展示一个样品中菌属的丰富度。

图 5 3个样品中属的Heatmap图Fig.5 Heatmap of the genera in all three samples
从图5可看出,样品DDMZ1与IMDDMZ11和IMDDMZ12微生物群落结构组成在属的分类平上差异显著。其中,样品IMDDMZ11和IMDDMZ12相似,而样品DDMZ1单独聚类。大肠杆菌-志贺菌(Escherichia-Shigella)在3个样品中丰度均占优势,其次是厌氧菌(Anaerospora)。在高毒性的锑污染的水环境中大肠杆菌-志贺菌(Escherichia-Shigella)的微生物群落相对丰度较高,是一种潜在修复锑污染水体和沉积物的菌种[32]。厌氧菌(Anaerospora)能将偶氮染料作为唯一碳源和能源进行矿化[33]。在样品DDMZ1中大肠杆菌-志贺菌(Escherichia-Shigella)和寡养单胞菌(Stenotrophomonas)占优势。而在样品IMDDMZ11和IMDDMZ12中菌群还富集有兼性厌氧-拟杆菌属(Dysgonomonas)、肠球菌属(Enterococcus)、梭菌菌群(Clostridium_sensu_stricto_12)和厌氧菌(Anaerospora)。有研究发现进水碱质量浓度为1 300~1 500 mg/L时的厌氧反应器中兼性厌氧-拟杆菌属(Dysgonomonas)是其常驻菌属[34],说明该菌能耐受高碱度的染料废水。肠球菌属(Enterococcus)可对活性红198偶氮染料脱色和生物降解[30]。梭菌菌群(Clostridium_sensu_stricto_12)能对染料中的聚乙烯醇(PVA)退浆废水进行降解[35],而本实验中PVA是固定化材料之一,该菌群可减少载体材料对环境的危害。在样品IMDDMZ11和IMDDMZ12中还有少量富集的菌群,是在水解酸化反应器中降解RB5 和 RBBR染料的主要功能菌属[22]。如产丙酸单胞菌属(Propionicimonas)、大肠杆菌属(Lachnoclostridium)、脱硫孤菌属(Desulfovibrio)、柠檬酸菌属(Citrobacter)和乳酸菌属(Citrobacter)。脱硫孤菌属(Desulfovibrio)和乳酸菌属(Citrobacter)。此外,样品IMDDMZ11中还富集了黄杆菌属(Flavobacterium)、不动杆菌属(Acinetobacter)和寡养单胞菌(Stenotrophomonas)。黄杆菌属(Flavobacterium)可降解废水中的氯氰菊酯[36],不动杆菌属(Acinetobacter)在黑臭河水的治理中起重要作用[37]。总体看来,游离化DDMZ1菌液与固定化DDMZ1小球在属的分类水平上群落结构组成差异明显;
同时,循环使用批次对固定化DDMZ1小球群落结构组成具有一定影响,但总体群落结构组成相似度高。
1) 在相同条件下,固定化DDMZ1小球对RB5偶氮染料的脱色率显著优于游离化DDMZ1菌液,脱色速率也得到了提升。
2) 微生物分类学水平由门到属的分析结果显示,样品中游离化DDMZI菌液与固定化DDMZ1小球的微生物群落结构组成差异明显,主要表现为优势菌群的组成和丰度存在较大差异。而固定化DDMZ1小球样品中微生物群落结构组成比较相似,虽然循环使用批次不同会造成优势菌属比例出现不同,但是整体来说固定化小球样品中微生物群落结构比较稳定,这表明固定化技术具有稳定微生物群落结构,从而稳定脱色效果的作用。
3) 固定化样品中除了丰度占显著优势的菌属大肠杆菌-志贺菌(Escherichia-Shigella)外,还富集了兼性厌氧-拟杆菌属(Dysgonomonas),故推测这2种占优势的菌属在固定化DDMZ1小球循环使用高达30批次降解脱色RB5过程中发挥关键作用。
猜你喜欢 脱色菌液菌门 不同浓度深色有隔内生真菌浸种对玉米幼苗生长的影响种子(2022年6期)2022-08-03漆树籽油与蜡脱色工艺条件初探农产品加工(2022年9期)2022-06-17不同强化处理措施对铜污染土壤微生物多样性的影响中国农学通报(2022年14期)2022-06-01大孔吸附树脂对鱼籽多肽脱色工艺食品工业(2022年3期)2022-03-25甲酸和木醋液对苜蓿青贮细菌群落结构的影响中国农学通报(2022年2期)2022-03-07胡麻连作对土壤细菌群落的影响干旱地区农业研究(2022年1期)2022-01-28光合细菌在种植业上的应用研究进展江苏农业科学(2020年8期)2020-06-01不同施肥模式对茶园土壤细菌多样性的影响湖北农业科学(2019年22期)2019-12-23一株结晶紫脱色菌的分离鉴定及脱色性能初步研究安徽农学通报(2018年2期)2018-06-21假单胞菌HYS菌株对油菜种子发芽的影响湖北农业科学(2017年7期)2017-05-13本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0425/589092.html




