【www.zhangdahai.com--其他范文】
耿 雪,张建华,陈 艾
1.西部战区总医院检验科,四川成都 610000;
2.重庆医科大学附属第三医院检验科,重庆 401120
急性髓系白血病(AML)是一组高度异质性、恶性、克隆性血液肿瘤,由骨髓增生异常综合征、骨髓增殖性肿瘤等血液相关疾病及肿瘤相关放化疗引起[1]。AML发病涉及多种基因融合和突变,基因组学改变与AML的发病、发展和预后有明确的相关性[2]。多药耐药基因(MDR1)是调控肿瘤耐药的基因,其表达可促使癌细胞对抗肿瘤治疗产生耐药,导致治疗失败、肿瘤复发转移及预后不良[3]。SOX4是SOX转录因子家族成员,在细胞生长发育,以及恶性肿瘤细胞增殖、扩散中均发挥重要作用[4]。Wilms瘤基因1(WT1)是一种有效的转录调节因子,与肿瘤细胞的生长、侵袭、转移和血管生成相关[5]。本研究拟探讨MDR1、SOX4、WT1在AML中的表达特点,分析其与AML临床特征及预后的关系,现报道如下。
1.1一般资料 选取2020年1月至2021年8月本院收治的149例AML患者作为AML组,其中男89例,女60例;
年龄50~68岁,平均(59.25±4.27)岁;
AML分型:M1型12例,M2型85例,M3型15例,M4型16例,M5型20例,M6型1例。纳入标准:(1)经骨髓细胞形态学检查确诊为AML,符合2016年世界卫生组织制定的造血和淋巴组织肿瘤诊断标准[6];
(2)年龄18岁以上。排除标准:(1)淋巴细胞白血病、慢性髓系白血病、骨髓瘤、淋巴瘤等其他血液系统疾病患者;
(2)合并实体肿瘤患者;
(3)入组前接受过化疗、免疫或靶向治疗的患者。另选取同期于本院行骨髓检查无明显异常的72例轻度贫血(血红蛋白90~120 g/L)患者作为对照组,其中男42例,女30例;
年龄48~69岁,平均(59.07±4.31)岁。AML组和对照组性别、年龄等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究已经获得本院伦理委员会批准,所有患者均知情同意并签署知情同意书。
1.2骨髓MDR1、SOX4、WT1检测方法 取骨髓穿刺获得的骨髓组织标本2~3 mL,分离白细胞,加入红细胞裂解液裂解红细胞。常温下以1 500 r/min离心(离心半径10 cm)5 min,弃上清液。采用Wizard®SV Genomic DNA Purification Kit组织DNA提取试剂盒(美国Promega生物公司)提取RNA,采用cDNA试剂盒(美国赛默飞公司)将RNA反转录为cDNA,取2 μL cDNA样品加入实时荧光定量聚合酶链反应(qRT-PCR)体系,采用CFX96实时定量PCR系统(美国BIO-RAD公司)进行PCR。引物由上海捷瑞公司合成,引物序列如下。MDR1 mRNA上游:5′-GCTGTCAAGGAAGCCAATGCCT-3′;
下游:5′-TGCAATGGCGATCCTCTGCTTC-3′。SOX4 mRNA上游:5′-GTGAGCGAGATGATCTCGGG-3′;
下游:5′-CAGGTT GGAGATGGACTC-3′。WT1 mRNA上游:5′-ACAGGGTACGAGAGCGATAACCA-3′;
下游:5′-CACACGTCGCACATCCTGAAT-3′。β-actin(内参)上游:5′-TGTCCACCTTCCAGCAGATGT-3′;
下游:5′-GCTCAGTAACAGTCCGCCTAGA-3′。反应体系,DNA模板2 μL,上、下游引物各1 μL,Premix Ex Taq DNA 聚合酶25 μL,RNase-Free ddH2O 21 μL。反应条件:95 ℃预变性3 min,98 ℃变性2 s,67 ℃退火15 s,72 ℃延伸20 s,循环30次。采用2-ΔΔCt的方法计算MDR1 mRNA、SOX4 mRNA、WT1 mRNA相对表达水平。
1.3随访 出院后电话随访至2021年10月,统计随访期间总生存情况,总生存时间为自病理确诊到全因死亡或随访结束。

2.1AML组和对照组骨髓组织中MDR1 mRNA、SOX4 mRNA、WT1 mRNA表达水平比较 AML组骨髓组织中MDR1 mRNA、SOX4 mRNA、WT1 mRNA表达水平均高于对照组,差异均有统计学意义(P<0.05),见表1。
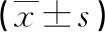
表1 AML组和对照组骨髓组织中MDR1 mRNA、SOX4 mRNA、WT1 mRNA表达水平比较
2.2不同临床特征AML患者骨髓组织中MDR1 mRNA、SOX4 mRNA、WT1 mRNA表达水平比较 白细胞计数≥40×109/L、有器官浸润、治疗后非完全缓解AML患者骨髓组织中MDR1 mRNA、SOX4 mRNA、WT1 mRNA表达水平均高于白细胞计数<40×109/L、无器官浸润及治疗后完全缓解患者,差异均有统计学意义(P<0.05);
不同年龄、性别、AML分型、血小板计数患者MDR1 mRNA、SOX4 mRNA、WT1 mRNA表达水平比较,差异均无统计学意义(P>0.05)。见表2。
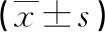
表2 不同临床特征AML患者骨髓组织中MDR1 mRNA、SOX4 mRNA、WT1 mRNA表达水平比较
2.3不同MDR1 mRNA、SOX4 mRNA、WT1 mRNA表达水平AML患者总生存率比较 149例AML患者随访期间失访5例,余144例中死亡48例,MDR1 mRNA、SOX4 mRNA及WT1 mRNA高表达AML患者总生存率均低于MDR1 mRNA、SOX4 mRNA及WT1 mRNA低表达AML患者,差异均有统计学意义(P<0.05),见图1、表3。

注:A为不同MDR1 mRNA表达水平患者生存曲线;
B为不同SOX4 mRNA表达水平患者生存曲线;C为不同WT1 mRNA表达水平患者生存曲线。

表3 不同MDR1 mRNA、SOX4 mRNA、WT1 mRNA表达水平AML患者总生存率比较[n(%)]
2.4影响AML患者预后的单因素Cox比例风险回归分析 以AML患者生存情况作为因变量,纳入年龄、性别、AML分型、白细胞计数、血小板计数、器官浸润、治疗后缓解情况、MDR1 mRNA表达水平、SOX4 mRNA表达水平、WT1 mRNA表达水平作为自变量(表4)。单因素Cox比例风险回归分析(ENTER法)结果显示,有器官浸润、治疗后非完全缓解、MDR1 mRNA高表达、SOX4 mRNA高表达、WT1 mRNA高表达与AML患者预后有关(P<0.05),见表5。将单因素分析中差异有统计学意义的项目纳入多因素Cox比例风险回归分析(ENTER法),结果显示,治疗后非完全缓解、MDR1 mRNA高表达、SOX4 mRNA高表达、WT1 mRNA高表达是AML患者预后不良的危险因素(P<0.05),见表6。

表4 赋值表

表5 影响AML患者预后的单因素Cox比例风险回归分析
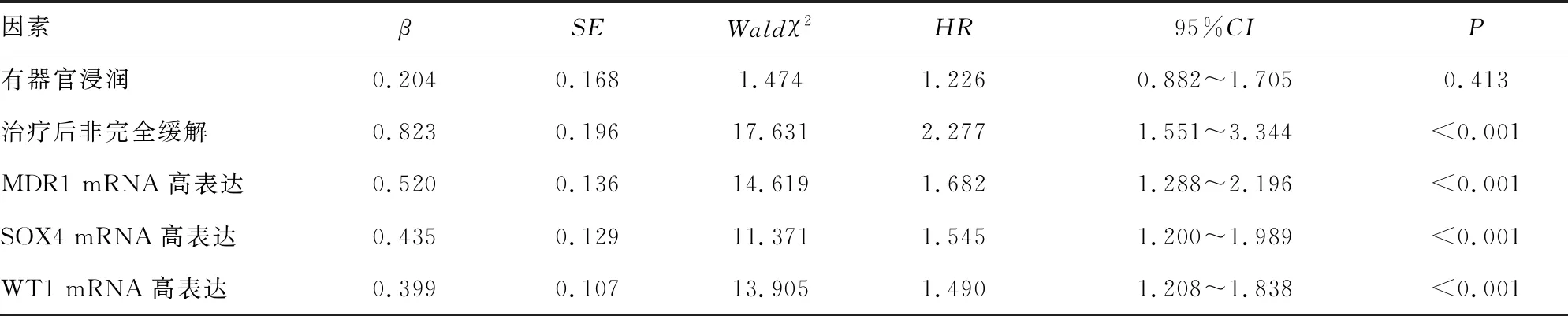
表6 影响AML患者预后的多因素Cox比例风险回归分析
AML是一组高病死率的恶性肿瘤,由骨髓干细胞克隆异常增殖和分化引起,发病机制涉及遗传、环境改变、染色体易位及基因突变等,大多数患者出现白细胞增多伴骨髓衰竭迹象(贫血和血小板减少)及疲劳、厌食和体质量减轻,少数患者可出现淋巴结肿大和器官肿大,如果不及时治疗,通常会在诊断后数月内因感染或出血而死亡[1]。过去40年,AML的治疗一直局限于高剂量细胞毒性化疗,近年来,随着深度测序技术的发展和靶向药物的应用,具有更高疗效的化疗和更低毒性的靶向疗法逐渐应用于临床,但是靶向药物耐药、治疗毒性叠加效应等给治疗带来新的挑战[7],患者预后仍然不是十分理想[8]。
MDR1是一种三磷酸腺苷(ATP)依赖性跨膜转运蛋白,由ABCB1基因编码,位于染色体区域7q21上,在肠道、结肠、胎盘、肝脏、血脑屏障等多种组织中表达,通过减少敏感器官或细胞中异生物质的积累发挥保护作用[9]。MDR1编码的糖蛋白是一种糖基化膜蛋白,属于膜转运蛋白的ATP结合超家族成员,嵌于细胞膜上,作为膜通道可将细胞内底物泵出细胞外,降低细胞内药物浓度,进而产生耐药[10]。MDR1在肿瘤细胞中充当化疗药物外排泵,是癌细胞对化疗耐药的主要机制之一。有研究结果显示,MDR1多态性可改变蛋白质表达或功能,与结直肠癌化疗药物反应性有关[11]。MDR1基因表达增加降低癌细胞中具有细胞毒性的抗癌药物浓度,并导致多药耐药表型,与神经母细胞瘤、乳腺癌等多种癌症化疗后预后不良有关[12]。本研究结果显示,AML患者骨髓中MDR1 mRNA表达水平增加,并且其高表达与白细胞计数增加、有器官浸润、治疗后非完全缓解及预后不良有关,说明MDR1 mRNA高表达与AML进展、治疗反应性差及预后不良有关。KASSEM等[13]在报道中指出,MDR1基因表达水平在AML耐药患者中明显升高,MDR1基因高表达与低完全缓解率和低生存率有关。推测MDR1可能通过诱导AML对抗肿瘤治疗耐药参与其进展过程。
SOX家族由参与细胞和器官发育分化及癌症发生和发展的转录因子组成,SOX4是SOX家族中一种重要的发育转录因子,含474个氨基酸残基,参与骨和心脏等器官发育,与骨质疏松症、癌症等多种疾病有关[14]。目前,已知SOX4在20多种恶性肿瘤中呈高表达,通过与其他转录因子相互作用促进癌细胞存活、上皮间充质转化、癌细胞迁移和转移[15]。有研究显示,SOX4可直接或间接负调节 WNT5a水平,增加膀胱癌细胞侵袭性[16],在晚期前列腺癌中,SOX4通过靶向上调miR-17-92表达水平,下调RB1蛋白表达水平,促使癌细胞增殖[17]。本研究发现,SOX4 mRNA在AML患者骨髓中呈高表达,是AML预后不良的危险因素,表明SOX4在AML中发挥致癌基因作用。LU等[18]研究认为,SOX4是急性白血病发病的重要启动因子,与AML患者预后不良独立相关。SOX4可能通过调控磷脂酰肌醇-3-激酶/蛋白激酶B通路参与AML的发病过程[19],也可能诱导Rho GTPase激活蛋白9表达上调,促使AML细胞增殖,抑制其凋亡,促使癌症进展[20]。
WT1最初被鉴定为Wilms肿瘤的候选基因,进一步研究表明,WT1可调节一系列靶基因和信号途径参与细胞发育、器官形成、组织稳态维持及疾病发病过程[21]。有研究表明,WT1 mRNA在乳腺癌、肺癌、胰腺癌和前列腺癌等多种恶性肿瘤中异常表达,发挥致癌基因作用,在乳腺癌中WT1 mRNA表达水平增加,抑制WT1 mRNA表达水平可降低细胞周期蛋白D1表达,抑制癌细胞增殖,促使癌细胞凋亡[22]。WT1 mRNA在多形性胶质母细胞瘤中呈高表达,发挥促进癌细胞增殖和迁移作用[23]。本研究发现,WT1 mRNA在AML中表达水平增加,WT1 mRNA高表达与AML患者预后有关,证明WT1在AML中发挥致癌基因作用。PANDEY等[24]研究结果显示,WT1 mRNA在急性早幼粒细胞白血病患者骨髓样本中表达水平增加,WT1 mRNA高表达可上调白血病细胞中细胞周期蛋白A1 mRNA表达水平,促进癌细胞增殖。
综上所述,AML患者骨髓组织中MDR1 mRNA、SOX4 mRNA、WT1 mRNA表达水平均增加,Cox比例风险回归分析结果显示,MDR1 mRNA高表达、SOX4 mRNA高表达、WT1 mRNA高表达与AML患者预后不良有关,提示MDR1、SOX4、WT1均参与了AML的发病机制,可为AML病情评估、预后预测及靶向治疗提供参考。本研究局限之处在于随访时间过短,MDR1、SOX4、WT1与AML患者预后的关系尚有待进一步延长随访时间加以证实。
猜你喜欢 骨髓靶向耐药 五指成拳 靶向发力 拓展股权权能 助力富民增收农业知识(2022年9期)2022-10-13骨髓穿刺会大伤元气吗?妇女生活(2022年5期)2022-06-09“六步四环”单元教学靶向课堂提质河南教育·职成教(2022年5期)2022-05-06靶向免疫联合三维适形放疗治疗晚期原发性肝癌患者的疗效观察中国典型病例大全(2022年7期)2022-04-22如何提高医务人员对多重耐药菌感染防控措施执行率中国典型病例大全(2022年7期)2022-04-22最后一个夜晚青年文学家(2020年16期)2020-07-13抗生素耐药后还能再用吗保健与生活(2019年2期)2019-08-01如何理性看待肿瘤靶向治疗幸福家庭(2019年12期)2019-01-07赞美骨髓文苑(2018年18期)2018-11-08沙门氏菌耐药谱分析山西农经(2018年1期)2018-05-14本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0426/589710.html




