【www.zhangdahai.com--其他范文】
周伦 丁源 吕洲
青岛市市立医院骨关节科,青岛 266000
骨关节炎是常见的骨骼疾病,疼痛、僵硬等临床特征严重影响关节的承重能力,我国有80%的患者出现关节活动受限,严重影响患者的生活质量[1]。目前关于该病的研究表明,骨关节炎主要是由于细胞外基质、关节软骨的合成、降解紊乱所造成[2]。当前基于微小RNA(miRNA)治疗多种疾病已有大量研究,同时对于临床具有较大的诊断、治疗潜能,但治疗骨关节炎的研究较少[3]。有研究表明,微小核糖核酸-34a(microRNA-34A,miR-34a)具有调控细胞周期和抗增殖能力,同时表达异常会引起细胞的凋亡、细胞周期停滞等现象[4]。蛋白激酶B(AKT)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路主要对于细胞的调控、自噬具有重要作用,其中通过抑制该通路可以改善机体的炎性反应[5]。目前缺少通过AKT/mTOR 信号通路来调节miR-34a 对骨关节炎的干预效果研究。基于此,本文旨在研究miR-34a 基于AKT/mTOR通路对骨关节炎大鼠的影响及作用机制。
1、研究动物
研究时间为 2020 年 2 月至 2021 年 5 月。选取 43 只 6~9 周龄雄性SD 大鼠作前瞻性研究,体质量200~250 g,由北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2017-0022,喂养标准大鼠饲料,室温(24±3)℃,相对湿度(48±7)%,12 h 光照交替。本次试验操作均参照动物试验伦理要求的相关规定,且经青岛市市立医院伦理委员会批准同意。
2、方法
2.1、骨关节炎大鼠建模[6]选取 43 只大鼠,从中随机选取10 只大鼠为空白组,其余33 只建立骨关节炎模型大鼠,腹腔注射10%水合氯醛(青岛宇龙海藻有限公司,H37022673)麻醉,切开2 cm 双侧膝关节内侧,暴露关节腔,用生理盐水清洗,止血,缝合。在关节中注射碘乙酸钠溶液(上海信裕生物科技有限公司,型号305-53-3),饲养2 周,建模关节出现肿胀及屈伸功能障碍,表示建模成功。成功建模30只。
2.2、分组及干预 选取10 只大鼠为空白组,成功建模的30 只模型大鼠随机分为模型组、上调miR-34a 组、沉默miR-34a 组,各 10 只。通过 Lipofectamine 2000 将 miR-34a inhibitor 转染到上调 miR-34a 组、沉默 miR-34a 组,分别为400 nm 和 200 nm,6 h 后换成含10% 血清的DMEM 培养基(广东环凯生物科技有限公司,货号:XB01XLS),37 ℃,CO2培养箱培养48 h,实时荧光定量PCR(RT-PCR)法检测miR-34a inhibitor 转染效果。模型组、空白组均给予等体积的生理盐水干预,各组均连续干预2周。
2.3、检测炎症指标 采用酶联免疫吸附测定法检测白细胞介素(interleukin,IL)-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-4、IL-10,在干预结束后抽取尾静脉血5 ml,以离心半径5 cm、转速3 000 r/min 离心处理10 min,分离上层血清,-80 ℃保存待检。严格按照说明书进行。酶联免疫吸附试剂盒由上海酶联生物科技有限公司提供。
2.4、病理组织观察 干预50 d 后,处死大鼠,观察关节是否有积液,取4 块胫骨内侧、胫骨外侧为标本,标本使用中性甲醛溶液固定70 h,脱水,包埋,切片,苏木精-伊红(HE)染色,根据Mankin关节软骨病理评分标准进行评估。
2.5、采用实时荧光定量PCR 检测miR-34a 采用Trizol一步法提取总RNA,所有步骤按说明书严格进行。引物设计如下 , miR-34a正 向引物 :5’ -GTGCAGGGTCCGAGGT-3’ , 反 向 引 物 :5’-GCCGCTGGCAGTGTCTTAGCTG-3’;
GAPDH正向引物:5’ -AGCCACATCGCTCAGACA-3’ , 反 向 引 物 :5’-TGGACTCCACGACGTACT-3’。采用 2-△△Ct方法计算出需要检测的miR-34a相对表达量。
2.6、检测磷酸化蛋白激酶B(pAKT)、磷酸化哺乳动物雷帕霉素靶蛋白(pmTOR) 采用蛋白免疫印迹法将标本提取液,根据蛋白浓度取适量进行SDS-PAGE 电泳分离蛋白。其余步骤严格按照说明书进行,结果用LabWorks3.0软件以目的条带β-肌动蛋白(β-actin)的会度值进行分析。重复试验5次。
3、统计学处理
采用SPSS 19.0 统计软件进行分析处理。应用Kolmogorov-SmiRnov 检验数据是否符合正态分布,符合正态分布的计量资料采用均数±标准差()描述,多组间比较采用方差齐性检验,两组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
1、病理组织
如图1 所示,图1A 为空白组:未见明显关节结构破坏,表面光滑没有裂痕,骨细胞排列分布均匀;
图1B 为模型组:表面明显粗糙,有裂隙,骨细胞减少偏平,分布紊乱;
图1C为沉默miR-34a 组:表面较为光滑无裂痕,骨细胞分布均匀,层次分明;
图1D 为上调miR-34a 组:表面粗糙,骨细胞减少,分布较为紊乱。

图1 各组大鼠病理学观察(HE ×400)。A 为空白组大鼠病理图,B 为模型组大鼠病理图,C 为沉默miR-34a 组大鼠病理图,D为上调miR-34a组大鼠病理图
2、miR-34a在各组中的表达水平比较
如表1 所示,与空白组相比,模型组、上调miR-34a 组、沉默miR-34a 组的miR-34a 表达较高,差异均有统计学意义(均P<0.05);
与模型组相比,上调 miR-34a 组、沉默miR-34a组miR-34a表达较低,差异均有统计学意义(均P<0.05);
沉 默 miR-34a 组 与 上调 miR-34a 组相 比,沉 默miR-34a 组miR-34a 表达较低,差异均有统计学意义(均P<0.05)。
表1 miR-34a在各组大鼠中的表达水平比较()

表1 miR-34a在各组大鼠中的表达水平比较()
注:空白组不做处理,模型组建立骨关节炎模型,上调miR-34a组、沉默miR-34a 组建立骨关节炎模型后分别转染400 nm 和200 nm miR-34a inhibitor;
miR-34a 为微小核糖核酸-34a;
与空白组相比,aP<0.05;
与模型组相比,bP<0.05;
与上调miR-34a 组相比,cP<0.05
miR-34a 0.94±0.08 2.39±0.26a 2.12±0.23ab 1.54±0.17abc 25.290 0.001组别空白组模型组上调miR-34a组沉默miR-34a组F值P值n 10 10 10 10
3、各组Makin评分比较
如表2 所示,与空白组相比,模型组、上调miR-34a 组、沉默miR-34a 组的Makin 评分较高,差异有统计学意义(均P<0.05);
与模型组相比,上调miR-34a 组、沉默miR-34a 组的Makin 评分较低,差异有统计学意义(均P<0.05);
沉默miR-34a 组与上调 miR-34a 组相比,沉默 miR-34a 组 Makin评分较低,差异有统计学意义(均P<0.05)。
表2 Makin评分在各组大鼠中的比较(分,)

表2 Makin评分在各组大鼠中的比较(分,)
注:空白组不做处理,模型组建立骨关节炎模型,上调miR-34a组、沉默miR-34a 组建立骨关节炎模型后分别转染400 nm 和200 nm miR-34a inhibitor;
miR-34a 为微小核糖核酸-34a;
与空白组相比,aP<0.05;
与模型组相比,bP<0.05;
与上调miR-34a 组相比,cP<0.05
Makin评分0.35±0.05 4.13±0.19a 3.02±0.16ab 1.15±0.09abc 91.260 0.001组别空白组模型组上调miR-34a组沉默miR-34a组F值P值n 10 10 10 10
4、各组炎性反应比较
如表3 所示,与空白组相比,模型组、上调miR-34a 组、沉默miR-34a组IL-1β、TNF-α较高,IL-4、IL-10较低,差异有统计学意义(均P<0.05);
与模型组相比,上调miR-34a组、沉默 miR-34a 组IL-1β、TNF-α 较低,IL-4、IL-10 较高,差异有统计学意义(均P<0.05);
沉默miR-34a 组与上调miR-34a 组相比,沉默 miR-34a 组 IL-1β、TNF-α 较低,IL-4、IL-10较高,差异有统计学意义(均P<0.05)。
表3 各组大鼠的炎性反应比较()
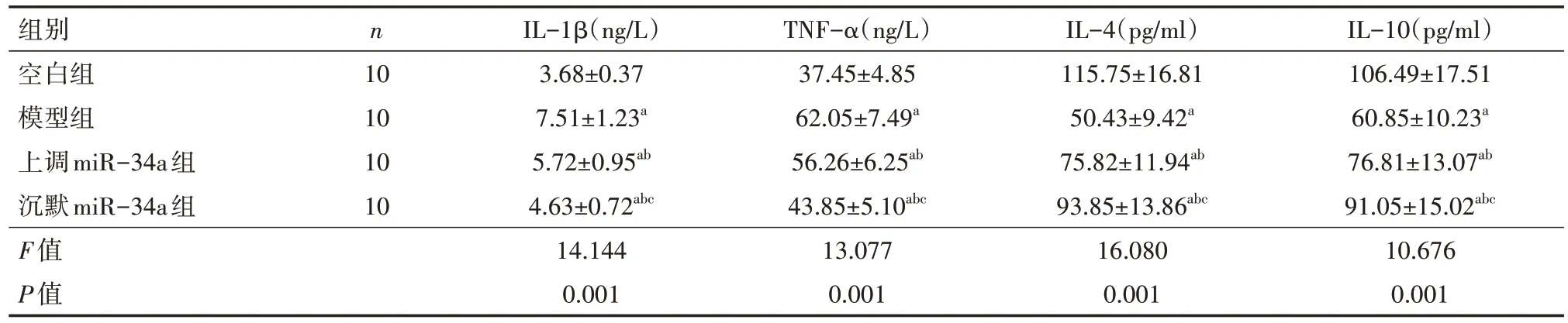
表3 各组大鼠的炎性反应比较()
注:空白组不做处理,模型组建立骨关节炎模型,上调miR-34a 组、沉默miR-34a 组建立骨关节炎模型后分别转染400 nm 和200 nm miR-34a inhibitor;
miR-34a 为微小核糖核酸-34a;
IL 为白细胞介素,TNF-α 为肿瘤坏死因子-α;
与空白组相比,aP<0.05;
与模型组相比,bP<0.05;
与上调miR-34a组相比,cP<0.05
IL-10(pg/ml)106.49±17.51 60.85±10.23a 76.81±13.07ab 91.05±15.02abc 10.676 0.001组别空白组模型组上调miR-34a组沉默miR-34a组F值P值n 10 10 10 10 IL-1β(ng/L)3.68±0.37 7.51±1.23a 5.72±0.95ab 4.63±0.72abc 14.144 0.001 TNF-α(ng/L)37.45±4.85 62.05±7.49a 56.26±6.25ab 43.85±5.10abc 13.077 0.001 IL-4(pg/ml)115.75±16.81 50.43±9.42a 75.82±11.94ab 93.85±13.86abc 16.080 0.001
5、各组AKT/mTOR通路蛋白相对表达量对比
如表4 所示,与空白组相比,模型组、上调miR-34a 组、沉默miR-34a组pAKT、pmTOR较高,差异有统计学意义(均P<0.05);
与模型组相比,上调miR-34a 组、沉默miR-34a 组pAKT、pmTOR 较低,差异有统计学意义(均P<0.05);
沉默miR-34a组与上调miR-34a组相比,沉默miR-34a组pAKT、pmTOR 较低,差异有统计学意义(均P<0.05)。各组大鼠pAKT、pmTOR蛋白免疫印迹图见图2。

图2 空白组、模型组、沉默miR-34a组、上调miR-34a组大鼠pAKT、pmTOR蛋白免疫印迹图
表4 各组大鼠的pAKT、pmTOR蛋白相对表达量对比()

表4 各组大鼠的pAKT、pmTOR蛋白相对表达量对比()
注:空白组不做处理,模型组建立骨关节炎模型,上调miR-34a组、沉默miR-34a组建立骨关节炎模型后分别转染400 nm和200 nm miR-34a inhibitor;
miR-34a 为微小核糖核酸-34a,pAKT 为磷酸化蛋白激酶,pmTOR 为雷帕霉素靶蛋白;
与空白组相比,aP<0.05;
与模型组相比,bP<0.05;
与上调miR-34a组相比,cP<0.05
pmTOR 1.00±0.01 1.89±0.24a 1.56±0.25ab 1.25±0.15abc 17.580 0.001组别空白组模型组上调miR-34a组沉默miR-34a组F值P值n 10 10 10 10 pAKT 1.00±0.01 1.95±0.29a 1.71±0.26ab 1.51±0.26abc 15.525 0.001
骨关节炎是一种退行性疾病,主要是以关节基质破坏、关节软骨细胞减少为特点,严重者可导致患者出现关节畸形、功能丧失等问题,当时该病的发病机制尚未明确[7]。关于该病的治疗目前没有较好的方法,主要是以减轻疼痛、改善关节功能为主要治疗方式,以提高生活质量为主要目的[8]。但是治疗方式不甚理想,因此应更加深入了解病理机制,挖掘防治靶点。
miRNA 是一种普遍存在于生物体的小分子,其可以通过调节别的miRNA 来实现基因的调控,参与多种疾病中,尤其对于人体神经分化、细胞凋亡、增殖具有重大作用,是一重要的调节因子[9-10]。随着对miRNA 的深入了解发现,miR-34a 与骨质疏松症、骨肿瘤、骨关节炎等疾病的发生、发展具有密切关系。主要是因为miR-34a 可调节细胞增殖、凋亡等生理学行为[11-12]。有研究结果显示,通过miR-34a 进行沉默,可以起到保护软骨细胞的作用,同时可以抑制软骨细胞凋亡,延缓关节退变的速度,对于治疗骨关节炎提供了较好的理论支持[13]。本文研究结果显示,在骨关节炎中miR-34a 表达较高,通过沉默miR-34a 可以降低大鼠miR-34a 表达,减轻大鼠的炎性反应,从而影响骨关节炎的发生、发展。主要是因为miR-34a 通过诱导p53 基因,进而导致细胞周期停止、凋亡、衰老等生物学行为,同时通过导致基因的变化对细胞进行较好的干预,因此对骨关节炎造成一定的影响[14]。
IL-1β、TNF-α、IL-4、IL-10 是较为经典的炎性指标,对于骨关节炎的发病机制有一定影响。miR-34a 对于细胞的自噬作用有一定影响,而自噬是机体中较为稳态的一种机制,主要是通过吞噬受损的细胞器、蛋白质,从而释放原料,为机体提供新的能量,因此在炎症、免疫等指标中具有重要作用[15]。由此说明,miR-34a 对于炎症指标有一定影响性。本文研究结果显示,沉默miR-34a 可以使骨关节炎大鼠的IL-1β、TNF-α降低,IL-4、IL-10升高,减轻炎性反应。主要是因为IL-1β 可以诱导软骨产生较多的IL-6、IL-8 等炎症介质[16]。TNF-α 可抑制软骨胶原产生,与病变具有密切关系[17]。IL-10对软骨细胞具有保护作用,充分说明该炎症指标与骨关节炎的发生、发展具有密切的相关性。
mTOR 与细胞的增殖、凋亡、分化具有密切的相关性,同时有学者研究发现,以mTOR 为交点的正向信号通路有AKT/mTOR 通路[18]。同时有研究表明,AKT/mTOR 参与调控细胞的凋亡、自噬,可以影响更多的反向效应分子,从而起到抑制细胞自噬作用[19]。本文研究结果显示,沉默miR-34a可以降低骨关节炎大鼠pAKT、pmTOR 表达。分析原因主要是因为沉默miR-34a 可以通过去磷酸化的三磷酸磷脂酰肌醇抑制AKT 活性,而激活AKT/mTOR 信号通路之后,可以引起一系列反应,包括调控细胞的生长、增殖、自噬[20]。
综上所述,沉默miR-34a 通过AKT/mTOR 信号通路调控,进而改善pAKT、pmTOR 表达,提高大鼠的关节功能,减少炎性反应,为临床骨关节炎靶向治疗提供理论依据。但因样本量较少,在数据统计时可能存在一定的偏倚,存在一定的局限性,且未对其具体作用机制进行深入分析,因此还需后续进一步分析。
利益冲突所有作者均声明不存在利益冲突
猜你喜欢 骨关节炎通路关节 DJ-1调控Nrf2信号通路在支气管哮喘中的研究进展中国现代医生(2022年19期)2022-11-04变应性鼻炎中促炎信号通路与非促炎信号通路的研究进展*按摩与康复医学(2022年19期)2022-09-27AngⅡ激活P38MAPK信号通路在大鼠NSAID相关小肠损伤中的机制研究中国现代医生(2022年19期)2022-08-25膝盖经常咔咔响,小心“关节鼠”家庭医药(2022年1期)2022-01-18适当运动可减少膝关节炎文萃报·周二版(2021年46期)2021-12-18膝盖有异响 警惕“关节鼠”文萃报·周五版(2021年51期)2021-01-04关节才是关键爱你(2019年33期)2019-11-14骨关节炎的早期识别和管理家庭医学(2019年6期)2019-06-27小心膝盖大学生(2017年10期)2017-10-23“忘穿秋裤”会得骨关节炎吗家庭医药(2016年1期)2016-01-20本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0426/589722.html




