【www.zhangdahai.com--其他范文】
李汶航 张 睿 崔欣怡 唐佐青 油红捷 杨 铮 付修文 马 赟 刘文兰
(1 首都医科大学中医药学院,北京,100069;
2 首都医科大学基础医学院,100069,北京)
大量实验研究证实,骨髓干细胞(Bone Marrow Stem Cells,BMSCs)具有治疗肝纤维化的作用,其治疗机制与抑制肝星状细胞(Hepatic Stellate Cells,HSCs)活化有关[1-3]。文献报道Rho三磷酸鸟苷酶(Rho GTPases)可参与多种生物学行为与功能,其中RhoA/ROCK1信号通路与HSCs活化相关,并参与肝纤维化的形成过程[4]。本课题组前期研究发现一贯煎可促进BMSCs募集到肝脏并发挥抗肝纤维化的作用,但具体的治疗机制尚未探明。本实验将进一步研究一贯煎联合BMSCs通过调控RhoA/ROCK1通路治疗肝纤维化的作用机制。
1.1 材料
1.1.1 动物 6周龄Sprague-Dawlay大鼠,雄性,体质量(200±20)g,共72只,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006,伦理号:AEEI-2015-123,饲养于中国食品药品检定研究院实验动物资源研究所无特定病原体(Specific Pathogen Free,SPF)级动物室。
1.1.2 药物 一贯煎组成:北沙参9 g、麦冬9 g、当归9 g、生地黄20 g、枸杞子12 g、川楝子4.5 g,购自北京同仁堂药店。
一贯煎冻干粉制备方法[5-6]:取适宜煎煮容器,加药材量7倍的冷水浸泡1 h,煮沸20 min,滤出药液。随后药渣添加3倍量的水煎煮,煮沸30 min,取前后2次滤液合并、浓缩。将药液静置过夜。加入无水乙醇至70%,待析出沉淀后,过滤,滤液旋转蒸发至无醇味,加入10%甘露醇,于-80 ℃条件下冻存4 h后放入冷冻干燥机冻干48 h以上,待水分全部冻干,研磨粉碎,放入-20 ℃冰箱保存,将所得的冻干粉称重,计算出大鼠给药剂量:高剂量为0.44 g/100 g、中剂量为0.22 g/100 g、低剂量为0.11 g/100 g。
1.1.3 试剂与仪器 秋水仙碱(Colchicine,西双版纳药业有限责任公司,批号:200101);
橄榄油(迈萨维诺特级初榨橄榄油,希腊,批号:67519);
四氯化碳(CCl4,纯度≥99.0%,上海易恩化学技术有限公司,批号:206848);
PVDF膜(罗氏公司,德国,批号:03010040001);
RIPA蛋白裂解液(兰博利德,批号:1090121810)二喹啉甲酸(Bicinchoninic Acid,BCA)蛋白浓度测定试剂盒(江苏碧云天公司,批号:010719190828);
动物组织总RNA提取试剂盒(北京普洛麦格生物公司,批号:0000343931);
SYBR Green Qpcr Master Mix(武汉赛维尔生物,批号:MPC2011005)。抗体RhoA(CST公司,美国,货号:2117S);
Rho相关激酶1(Rho-associated kinase 1,ROCK1)(CST公司,美国,货号:4035S);
α-SMA(CST公司,美国,货号:19245S);
胶原蛋白-1(Collagen I,COL-1)(CST公司,美国,货号:91144S),GAPDH(CST公司,美国,货号:5174S)。
电子天平(Sartorius公司,德国,型号:TE1502S);
冷冻干燥机(CHRIST公司,德国,型号:ALPHA1-2Ldplus);
正置荧光显微镜(Leica公司,德国,型号:DM4000B);
旋转蒸发仪(上海亚荣生化仪器厂,型号:RE-5298A);
全自动多功能酶标仪(Thermo公司,美国,型号:MULTISKAN MK3);
电泳仪(BioRad公司,美国,型号:1659001);
成像系统(Fujifilm株式会社,日本,型号:LAS3000);
低温离心机(Sigma公司,美国,型号:4-16S/4-16KS);
分光光度计(Thermo公司,美国,型号:NANODROP 2000);
PCR仪(BioRad公司,美国,型号:CFX96);
全自动生化仪(日立公司,日本,型号:7600)。
1.2 方法
1.2.1 分组与模型制备 大鼠适应性饲养1周后随机分为8组,即正常对照组、模型对照组、秋水仙碱组、一贯煎高剂量组、一贯煎中剂量组、一贯煎低剂量组、干细胞组、一贯煎+干细胞组,每组9只。肝纤维化模型构建:除正常对照组外,其余7组大鼠腹腔注射四氯化碳溶液(橄榄油、四氯化碳按1∶1配制),初始2周注射剂量为0.2 mL/100 g,2次/周;
随后2周调整剂量为0.1 mL/100 g,2次/周;
最后2周调整剂量为0.05 mL/100 g,2次/周。正常对照组注射等量的橄榄油溶液。
BMSCs的分离、培养:取6周龄雄性SD大鼠,脱颈处死,于超净工作台中取下肢长骨,用完全培养基多次冲洗骨髓腔,过滤。将所得细胞放于37 ℃、5% CO2培养箱中培养,当细胞浓度达到70%~80%后进行传代。当传至第4代时,消化、收集细胞、调整浓度为5×106个/L。
1.2.2 给药方法 干细胞组、一贯煎+干细胞组大鼠经尾静脉注射0.2 mL BMSCs;
其他组注射等量生理盐水。一贯煎高剂量组以一贯煎冻干粉[4.4 g/(kg·d)]灌胃治疗,一贯煎中剂量组、一贯煎+干细胞组以一贯煎冻干粉[2.2 g/(kg·d)]灌胃治疗,一贯煎低剂量组以一贯煎冻干粉[1.1 g/(kg·d)]灌胃治疗。秋水仙碱组以秋水仙碱[0.25 mg/(kg·d)]灌胃治疗,连续4周。正常对照组、模型对照组和干细胞组以等量蒸馏水灌胃。
1.2.3 检测指标与方法
1.2.3.1 阴虚表征观测 于取材前测量大鼠体质量、饮水量、舌面干湿度,记录粪便、尿液情况,并对二便情况进行评分。大便正常干为1分,较干2分,干3分;
小便清为1分,小便白淡黄为2分,黄为3分。
1.2.3.2 组织收集方法 0.1 mL/100 g戊巴比妥溶液腹腔注射麻醉大鼠,固定并腹主动脉采血,所得血液室温静置4 h。使用低温离心机离心10 min,离心半径14.5 cm。离心后分离上清待测。分离肝脏,取肝左叶的相同部位,放于4%多聚甲醛溶液中固定,石蜡包埋。剩余肝组织分装冻存管,液氮冻存后放入-80 ℃冰箱保存。
1.2.3.3 血清生化检测 使用日立7600全自动生化仪检测各组血清谷丙转氨酶(Glutamic-pyruvic Transaminase,GPT)、谷草转氨酶(Glutamic-oxaloacetic Transaminase,GOT)含量。
1.2.3.4 苏木精-伊红(Hematoxylin Eosin,HE)、Masson染色观察肝组织病理改变 取石蜡包埋好组织切片,厚度5 μm,以HE染色后,使用光学显微镜观察肝组织炎症情况;
另取组织切片以Masson染色,观察组织中胶原纤维情况。
1.2.3.5 实时PCR法检测RhoA、ROCK、α-SMA、COL-1 mRNA的表达 使用RNA试剂盒提取总RNA后,将其逆转录成cDNA,完成后对其进行PCR扩增反应。引物序列见表1。

表1 引物序列
1.2.3.6 蛋白质印迹法检测RhoA、ROCK1、α-SMA、COL-1的蛋白表达 取各组大鼠肝组织40 mg,提取总蛋白,以BCA法定量,每组取30 μg/泳道SDS-聚丙烯酰胺凝胶电泳,电泳完成后转移到聚偏二氟乙烯(Polyvinylidenefluoride,PVDF)膜,脱脂牛奶封闭1 h。放入按1∶1 000稀释的一抗中孵育过夜,洗涤缓冲液(Tris Buffered Saline Tween,TBST)洗涤3次,室温下以1∶10 000稀释的二抗孵育1 h,检测各组RhoA、ROCK1、α-SMA、COL-1蛋白表达,以GAPDH作为内参。
1.2.3.7 免疫组织化学检测α-SMA、COL-1的阳性表达面积 石蜡切片脱蜡复水,磷酸盐缓冲液(Phosphate-Buffered Saline,PBS)漂洗、枸橼酸钠抗原修复液加热进行抗原修复。封闭,滴加按1∶200稀释的α-SMA、COL-1一抗液,4 ℃湿盒过夜;
次日漂洗、加入二抗,二氨基联苯胺(3,3′-diaminobenzidine,DAB)显色,苏木精复染,脱水、透明、封片。
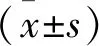
2.1 阴虚表征结果 与正常对照组比较,模型对照组大鼠体质量明显减轻、舌面干湿度显著降低、饮水减少,并出现大便干、小便黄等症状,差异均有统计学意义(均P<0.05),提示模型对照组大鼠出现明显阴虚症状;
与模型对照组比较,一贯煎高剂量组、一贯煎中剂量组、一贯煎低剂量组、干细胞组、一贯煎+干细胞组体质量、饮水量和舌面干湿度增加,血流速度减缓,大便正常、小便淡黄,差异均有统计学意义(均P<0.05)。见表2。

表2 各组大鼠阴虚表征比较
2.2 肝功能检测结果 肝功能检测结果显示,模型对照组血清GPT、GOT含量较正常对照组显著升高,差异均有统计学意义(均P<0.05),提示造模成功。一贯煎高剂量组、一贯煎中剂量组、一贯煎低剂量组、一贯煎+干细胞组血清GPT、GOT含量较模型对照组显著降低,差异均有统计学意义(均P<0.05)。见表3。
2.3 HE、Masson染色结果 与正常对照组比较,模型对照组的肝组织发生显著的坏死和肝纤维改变,肝小叶内有纤维间隔形成,肝小叶结构紊乱;
与模型对照组比较,一贯煎高剂量组、一贯煎中剂量组、一贯煎低剂量组、干细胞组、一贯煎+干细胞组肝组织的炎症坏死和纤维化程度均明显减轻。见表3、图1。

表3 各组大鼠肝功能与肝脏病理比较

图1 各组大鼠肝组织病理学(上HE、下Masson染色,×200)
2.4 实时PCR检测结果 PCR实验结果显示,与正常对照组比较,模型对照组RhoA、ROCK1、α-SMA、COL-1 mRNA的表达显著升高,差异均有统计学意义(均P<0.05);
与模型对照组比较,一贯煎高剂量组、一贯煎中剂量组、一贯煎+干细胞组的RhoA、ROCK1、α-SMA、COL-1 mRNA的表达显著降低,差异均有统计学意义(均P<0.05);
与BMSCs组比较,一贯煎+干细胞组的RhoA、ROCK1、α-SMA、COL-1 mRNA的表达显著降低,差异均有统计学意义(均P<0.05)。见图2。

图2 各组大鼠RhoA、ROCK1、α-SMA、COL-1 mRNA表达
2.5 蛋白质印迹法检测结果 蛋白质印迹法检测结果显示,与正常对照组比较,模型对照组的RhoA、ROCK1、α-SMA、COL-1蛋白表达均显著升高,差异均有统计学意义(均P<0.05);
与模型对照组比较,一贯煎高剂量组、一贯煎中剂量组、一贯煎低剂量组、干细胞组、一贯煎+干细胞组RhoA、ROCK1、α-SMA、COL-1的蛋白表达均显著降低,差异均有统计学意义(均P<0.05),且表达水平随一贯煎的给药剂量升高而降低;
与干细胞组比较,一贯煎+干细胞组RhoA、ROCK1、α-SMA、COL-1的蛋白表达均显著降低,差异均有统计学意义(均P<0.05);
与一贯煎中剂量组比较,一贯煎+干细胞组的ROCK1、α-SMA表达均显著低于一贯煎中剂量组,差异均有统计学意义(均P<0.05)。见图3。
2.4 免疫组织化学染色结果 肝组织免疫组织化学染色显示,与正常对照组比较,模型对照组肝组织切片的α-SMA、COL-1阳性面积显著增加,差异均有统计学意义(均P<0.05)。与模型对照组比较,一贯煎高剂量组、一贯煎中剂量组、一贯煎低剂量组、干细胞组、一贯煎+干细胞组中α-SMA、COL-1的阳性面积显著减少,差异均有统计学意义(均P<0.05)。见图4。

图4 各组大鼠α-SMA、COL-1比较(免疫组织化学染色,400)
肝纤维化在中医无明确名称,临床中常根据患者的实际症状和体征将其归于“腹胀”“癥积”“胁痛”病证进行辨证治疗。肝纤维化主要由细胞外基质(Extracellular Matrix,ECM)不断积累引起,ECM主要由活化的HSCs产生,故HSCs的活化和增殖是肝纤维化进展过程中的重要环节[7-8]。一贯煎临床常用于治疗证属肝肾阴虚的肝纤维化、慢性肝炎、肝损伤等疾病。体外实验研究发现,一贯煎可抑制地活化和增殖达到抗纤维化的作用[9-10]。
BMSCs来源于骨髓,具有自我更新、增殖、多能分化和低抗原性等特点,故常用BMSCs移植进行肝病治疗研究[1-13]。目前,已有临床研究应用BMSCs治疗肝脏疾病并取得了良好效果[14-16]。但有研究发现,注射BMSCs后对肝纤维化的改善效果并不理想,其具体原因尚不明确,定向引导BMSCs移动到受损肝脏并持续发挥治疗作用是当前研究的重要内容[7]。本课题组前期实验证明一贯煎可促进BMSCs迁移到肝损伤部位,并发挥抗肝纤维化的作用,但其中具体机制还未探明[8-19]。
Rho通路在调控细胞功能方面有重要作用,可调节细胞迁移、收缩、活化等生理活动[20]。RhoA是Rho信号通路的启动子,参与肌动蛋白应力纤维的组装;
ROCK1是RhoA的下游分子,可被RhoA信号激活,从而参与HSCs活化与变形等生理过程[4]。RhoA/ROCK1激活后可引起HSCs活化,高表达α-SMA并分泌大量胶原,其中Collagen Ⅰ是肝纤维化过程中的重要因子,且肝脏的纤维化程度与肝组织中CollagenⅠ的沉积量正相关,故α-SMA、CollagenⅠ常作为肝纤维化严重程度的评价指标[21-24]。本研究实时PCR和蛋白质印迹法检测结果显示,模型对照组RhoA、ROCK1、α-SMA、COL-1的mRNA和蛋白表达水平升高,RhoA/ROCK1通路激活,HSCs活化,并产生大量胶原。而一贯煎、干细胞和一贯煎+干细胞等干预方式均可抑制RhoA/ROCK1通路激活,阻止HSCs活化从而减少胶原产生,其中一贯煎联合BMSCs的作用效果优于一贯煎(中剂量)组和干细胞组(P<0.05)。
本实验结果表明:一贯煎与BMSCs可抑制Rho通路的关键分子RhoA、ROCK1的表达从而抑制HSCs活化,二者联合干预作用优于各自单独使用时的效果,本研究为进一步探索一贯煎促进BMSCs抗纤维化提供了基础。
猜你喜欢 低剂量纤维化活化 一种废轮胎热解炭黑活化装置及其使用方法轮胎工业(2022年5期)2022-11-25线粒体自噬在纤维化疾病中作用的研究进展中华实用诊断与治疗杂志(2022年1期)2022-08-31炎性及心肌纤维化相关标志物在心力衰竭中的研究进展中国现代医生(2022年21期)2022-08-22肝纤维化无创诊断研究进展传染病信息(2022年3期)2022-07-15恩替卡韦联合安络化纤丸治疗慢性乙型肝炎肝纤维化的研究中国药学药品知识仓库(2022年9期)2022-05-23肺部疾病应用螺旋CT低剂量扫描技术检查的分析中国典型病例大全(2022年9期)2022-04-19工业遗存的活化——叁伍壹壹的时光与鲜花当代陕西(2022年5期)2022-04-19来那度胺联合环磷酰胺、低剂量地塞米松治疗多发性骨髓瘤的临床疗效探讨健康体检与管理(2022年2期)2022-04-15CT低剂量扫描技术应用于新冠肺炎筛查中的临床价值中国药学药品知识仓库(2022年2期)2022-03-23论非物质文化遗产“活化”传承科学与财富(2021年33期)2021-05-10本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0430/591611.html




