【www.zhangdahai.com--其他范文】
张喜艳,柏鑫,阎一鑫,陈克明,王玲*
(1.中国人民解放军联勤保障部队第九四○医院生殖医学中心,兰州 730050;
2.中国人民解放军联勤保障部队第九四○医院基础医学实验室,兰州 730050;
3.甘肃中医药大学,兰州 730030;
4.甘肃省干细胞与基因药物重点实验室,兰州 730050)
淫羊藿苷是传统中药淫羊藿的主要活性成分,具有广泛的药理和生物活性,包括抗炎、抗抑郁、抗肿瘤活性、抗氧化作用、雌激素活性、心血管保护、促进骨愈合和神经保护、免疫调节和改善性功能[1]。淫羊藿作为治疗男性生殖功能障碍的传统中药已有数千年的历史[2],但很少有研究调查其对生殖功能(如精子发生和睾酮产生)的其他药理活性或其潜在机制。不孕症已成为全球公共卫生问题,影响全球约12%~15%的夫妇[3],在不孕原因中男性因素占50%[4]。男性不育的原因是广泛的,目前研究表明,缺氧是男性不育的主要原因之一,环境性缺氧和病理性缺氧对男性的精液参数、睾丸功能、生殖激素分泌和妊娠结局均产生不利影响[5]。本研究旨在观察淫羊藿苷对模拟高原环境下的大鼠出现的生殖损伤的保护作用,以期为淫羊藿苷的临床药物开发提供实验依据。
一、实验材料
1.实验动物:30只12周龄SPF级雄性Wistar大鼠,体重(220±15)g,购自兰州大学实验动物中心,动物许可证号SCXK(甘)2018-0002。
实验废弃物及动物尸体等按照《医疗废物管理条例》要求进行无害化处理,实验过程严格遵守国家科技部《关于善待实验动物的指导性意见》,尽可能减少对动物的伤害。实验得到了联勤保障部队第九四○医院动物伦理委员会的批准。
2.实验试剂:淫羊藿苷(HI008055298)购自宝鸡市辰光生物科技有限公司;
丙二醛(MDA)和超氧化物歧化酶(SOD)试剂盒购自南京建成科技有限公司;
血清睾酮(T)、卵泡刺激素(FSH)、黄体生成素(LH)的试剂盒购自睿信生物科技有限公司;
精子形态学快速染色液及精子活体染色液购自上海索莱宝生物科技有公司。
3.主要仪器:DYC-3070型模拟高原低压低氧动物实验舱群(贵州风雷航空军械);
光学显微镜(凤凰光学);
TG16-WS台式高速离心机(湖南湘仪实验室仪器开发);
Epoch荧光酶标仪(美国伯腾)。
二、实验方法
1.动物分组与处理:大鼠适应性喂养1周后,随机分为平原对照组、高原模型组和淫羊藿苷实验组,每组10只。平原对照组大鼠饲养于本院SPF级动物实验中心(海拔1 400 m),高原模型组和淫羊藿苷实验组饲养于模拟高原动物实验舱,以5 m/min的速度上升至海拔6 000 m高度[6]。淫羊藿苷实验组每天上午9时给予淫羊藿苷100 mg/kg[7]灌胃,连续30 d,其余两组给予等体积生理盐水灌胃。在实验期间,各组大鼠自由摄食饮水,光照时间8:00~20:00,温度为24℃±1℃。每周称量所有大鼠体质量。
2.组织取材及处理:干预期满后各组大鼠禁食水12 h,麻醉后迅速剪开腹腔,暴露腹部内容物,将其推向一侧,牵拉精索,引出睾丸和附睾,摘取双侧睾丸和附睾;
剔除粘连的血管、脂肪等组织,双侧睾丸组织称重后将左侧睾丸放入4%多聚甲醛溶液中,右侧睾丸放入-80℃冰箱中保存待用。将大鼠腹主动脉暴露完全,寻找最佳穿刺点采集血液,室温下静置30 min后放入4℃冰箱中冷藏30 min以使血清析出,2 000~2 500 r/min离心20 min,将上清液储存于2 ml无菌无酶的 EP管中,-20℃保存备用。睾丸指数=睾丸重量/体质量。
3.睾丸组织病理学检测:取固定于4%多聚甲醛溶液中的左侧睾丸组织,常规梯度乙醇脱水、二甲苯处理、石蜡包埋、切片以及HE染色处理。
4.精子悬液指标及精子质量评估:取双侧附睾置于生理盐水中,剪碎并待精子释放制备成精子悬液。取一滴精子悬液滴入载玻片,计数每毫升悬液中精子浓度(107/ml),并在40倍镜下观察,计数200个精子,依精子活动状态分为前向运动(PR)、非前向运动(NP)、及不活动(IM)。精子活动率(%)=(PR+NP)/(PR+NP+IM)。取精子悬液于载玻片涂片后进行Diff-Quik染色,于100倍镜下观察,计数畸形的精子(头部畸形、尾部畸形、其他形态异常)所占比例,每张涂片计数200个以上的精子。取精子悬液于载玻片涂片后采用伊红-苯胺黑染液染色,于100倍镜下观察,计数染色精子和非染色精子(染色为死精子,非染色精子为活精子),每张涂片计数200个以上的精子。
5.睾丸组织氧化应激指标测定:取右侧睾丸组织,按照1∶9的质量比例加入低温生理盐水后机械匀浆,4℃条件下3 500 r/min离心10 min,取上清,按照试剂盒说明书进行SOD活力和MDA水平测定。
6.生殖激素检测:使用酶联免疫分析法(ELISA)测定大鼠血清T、LH、FSH含量,具体操作按试剂盒说明书要求进行。
三、统计学方法
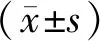
一、各组大鼠的一般情况比较
与平原对照组相比,高原模型组与淫羊藿苷实验组体重均显著下降(P<0.05),而淫羊藿苷实验组与高原模型组体重无显著性差异(P>0.05);
高原模型组睾丸指数显著低于平原对照组与淫羊藿苷实验组(P<0.05),而淫羊藿苷实验组的睾丸指数与平原对照组无显著性差异(P>0.05)(图1)。

A:大鼠体重逐周变化情况;
B:各组的睾丸指数。与其他两组比较,*P<0.05。图1 各组大鼠体重变化情况及睾丸指数比较
二、各组大鼠睾丸组织的病理学结果
HE染色结果显示:平原对照组大鼠的睾丸组织形态完好,生精上皮结构完整,由排列有序的各级生精细胞和成熟的支持细胞组成,上皮下的基膜明显,管腔内精子丰富,间质细胞成群分布于生精小管之间;
高原模型组的大鼠睾丸组织结构异常,生精小管管腔不规则,且大小不一,生精上皮有1~2层生精细胞,且结构紊乱,生精细胞变性坏死脱落至管腔,支持细胞可见大量空泡,上皮下基膜变薄甚至断裂缺失,管腔正常形态结构消失,管腔内空洞化,无可见的长梭形的精子,间质细胞数量减少,充血水肿,且有大量红细胞;
淫羊藿苷实验组睾丸组织生精小管形态大小较均一,内约有3~4层排列相对规则的各级生精细胞,偶有脱落坏死的生精细胞,支持细胞有数量较少的空泡,基膜较阳性对照组增厚,管腔较规则,内有大量精子,间质细胞较丰富,偶见炎症细胞(图2)。

A:平原对照组;
B:高原模型组;
C:淫羊藿苷实验组;
红色箭头示生精细胞。图2 睾丸组织的病理学结果比较(HE ×200)
三、各组大鼠的附睾精子质量比较
与高原模型相比,平原对照组及淫羊藿苷实验组的精子数量、精子存活率和精子总活动率均显著上升(P<0.01),精子畸形率显著下降(P<0.01);
平原对照组和淫羊藿苷实验组间的精子质量参数无显著性差异(P>0.05)(图3)。
四、各组大鼠的血清性激素水平比较
与平原对照组相比,高原模型组大鼠血清T、FSH和LH水平均显著下降(P<0.01),而淫羊藿苷实验组的大鼠血清性激素水平无显著性变化(P>0.05);
与高原模型组相比,淫羊藿苷实验组的性激素水平均显著升高(P<0.01)(图4)。

与其他两组比较,**P<0.01。图3 各组大鼠附睾精子质量情况比较

与其他两组比较,**P<0.01。图4 各组大鼠的血清性激素水平
五、各组大鼠睾丸氧化应激指标的比较
与平原对照组相比,高原模型组大鼠睾丸组织SOD活性显著下降(P<0.01),MDA水平显著上升(P<0.01),淫羊藿苷实验组睾丸组织氧化应激指标无显著性变化(P>0.05);
与高原模型组相比,淫羊藿苷实验组睾丸组织水平SOD活性显著上升(P<0.01),MDA水平显著下降(P<0.01)(图5)。

与其他两组比较,**P<0.01。图5 各组大鼠的睾丸组织SOD和MDA的水平
有研究表明,缺氧暴露环境导致体重下降可能与缺氧暴露能提高身体新陈代谢降低食欲有关[7]。Chen等[8]研究发现,平原环境中淫羊藿苷治疗的大鼠体重未发生显著变化,而本次研究结果显示模拟高原环境会导致大鼠体重增长缓慢,淫羊藿苷给药后大鼠的体重无显著性变化,但淫羊藿苷给药后能够使大鼠睾丸指数与平原环境下相近,且显著高于高原模型组,初步说明淫羊藿苷能够对大鼠睾丸起到一定的保护作用。
睾酮对于性别分化、维持精子发生和男性第二性征的表达至关重要。有研究表明,睾酮在睾丸的形态发育和生殖功能中都起着重要作用[9]。淫羊藿苷在平原环境中对雄性大鼠生殖系统的相关实验研究结果表明,成年大鼠口服淫羊藿苷显著提高睾酮水平,并上调睾丸生成基因的表达,如苯二氮卓类受体和类固醇源性急性调节蛋白,改善雄性大鼠的生殖功能[6]。本实验研究中发现高原环境中血清睾酮水平、FSH水平、LH水平和精子数量较平原对照组降低,在模拟高原环境中给予淫羊藿苷干预后睾酮水平得到好转,与常德辉等[10]的研究结果一致。缺氧诱导因子-1(HIF-1)是参与细胞对缺氧反应的关键转录因子,HIF-1 在男性睾丸组织的生殖细胞中稳定表达。胆固醇是合成睾酮的原料[11],类固醇急性调节蛋白(StAR)介导的胆固醇转移是睾酮合成的限速步骤,而StAR 是该过程的限速蛋白[12]。Wang等[13]在HIF-1对StAR转录调控以及对睾丸细胞合成和分泌睾酮的影响研究中表明,在缺氧条件下,HIF-1水平升高,机体睾酮分泌量降低,HIF-1对StAR的转录抑制是缺氧条件下睾酮减少的一种机制。在另一项研究中发现,淫羊藿苷有影响HIF-1表达的潜力[14],这为以后进一步研究中药淫羊藿苷的药用价值提供新思路。
目前研究表明睾丸组织的过氧化损伤是导致睾丸功能受损的重要原因[15]。MDA水平经常被用作组织氧化应激的关键指示指标,它是由自由基对细胞膜成分的损伤造成[16]。SOD酶是对抗氧化应激的重要抗氧化防御指标,在细胞中,SOD酶将超氧阴离子(•O2-)转化为过氧化氢(H2O2),进而谷胱甘肽过氧化物酶可以将H2O2分解为水[17]。在本研究中,模拟高原低压低氧环境致使大鼠睾丸组织SOD酶活性降低,而睾丸组织MDA水平升高;
然而,高原模拟环境中淫羊藿苷的干预提高了睾丸组织SOD酶的活性,抑制MDA水平。结果表明,由高原低压低氧环境引起的睾丸组织的氧化应激在淫羊藿苷的干预下得以减轻,提示淫羊藿苷可能具有针对环境性缺氧所介导的生殖毒性的保护作用,其具体保护机制有待进一步研究。
精子质量是评估男性生育能力的重要指标。成熟且有功能的精子发生于睾丸生精小管并储存于附睾中,慢性低氧导致睾丸生精上皮空泡化、生殖细胞变形或生成减少,从而导致精子数量减少以及精子畸形率增加,精子存活率下降以及精子活力下降[18]。有研究报道,雄性大鼠给予淫羊藿苷处理增加附睾精子数量且对睾丸组织形态学无不利影响[6]。本研究中,高原环境中淫羊藿苷干预能够改善雄性大鼠精子质量,且睾丸组织病理学形态趋向正常,淫羊藿苷对模拟高原环境所致雄性生殖系统损伤的保护作用机制可能是通过减轻睾丸组织中氧化应激损伤的途径保护睾丸生精小管,并且与提高生殖激素水平有关,但所涉及的分子水平机制还有待进一步探讨。
综上所述,高原环境中给予淫羊藿苷干预有逆转生殖毒性损伤的趋势,表明淫羊藿苷对持续缺氧环境所导致的生殖系统损伤具有保护作用,可能与淫羊藿苷提高血液中的睾酮浓度及增强抗氧化酶的活性,使睾丸组织生精小管免受缺氧应激损伤有关。但本研究中对相应的具体分子机制及雄性生殖系统细胞和基因水平上的研究有所不足,仍有待进一步研究。
猜你喜欢 睾酮睾丸精子 浅谈睾酮逃逸现代泌尿生殖肿瘤杂志(2022年1期)2022-11-21得了无精子症,还能治愈吗人人健康(2022年18期)2022-10-10男性睾酮低的8种症状保健与生活(2021年10期)2021-05-17没遇上卵子的精子去哪了祝您健康·文摘版(2019年1期)2019-05-14精子存活率低怎么办?妇女生活(2018年4期)2018-04-20孩子睾丸多大算正常家庭用药(2016年9期)2016-12-03正说睾酮大众健康(2016年3期)2016-05-31雄鸟嘹亮的歌声怎么来的大科技·百科新说(2014年2期)2014-03-03睾丸小是否会引起不孕现代家庭(1999年7期)1999-06-14警惕睾丸扭转祝您健康(1991年1期)1991-12-30本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0602/605999.html




