【www.zhangdahai.com--其他范文】
许鹏宇,李冬秀△,程立立,张 敏
1.河北医科大学第三医院,河北石家庄050051;
2.白求恩国际和平医院,河北石家庄050051
卵母细胞的发育和成熟是一个复杂的过程,促卵泡生成素(FSH)、促黄体生成素(LH)、雌二醇(E2)、睾酮(T)、孕激素(P)、褪黑素等与卵母细胞的生长发育密切相关,为卵母细胞核及胞浆的同步成熟提供内环境的卵泡液至关重要,因此卵泡液及其对卵母细胞的发育成为辅助生殖领域的研究热点[1-2]。在体外受精胚胎移植过程中胚胎实验室会获得不同成熟度的卵母细胞,尤其在多囊卵巢综合征患者中,未成熟卵母细胞体外成熟培养受到越来越多胚胎学家的重视。但是,目前没有一种未成熟卵体外培养体系能够获得满意的实验室结局。本研究通过测定不同成熟度的卵母细胞卵泡液的生殖激素水平,观察不同卵泡大小来源的第二次减数分裂中期卵(MⅡ)实验室结局,探讨生殖激素和卵泡大小与控制性超促排卵(COH)过程中卵母细胞发育潜能的关系,为完善未成熟卵体外培养体系提供理论依据。现报道如下。
1.1一般资料 选取2015年7月至2016年4月接受胞浆内单精子注射(ICSI)助孕患者作为研究对象。纳入标准:(1)女性年龄22~35岁;
(2)体重指数(BMI):18~25 kg/m2;
(3)基础激素正常;
(4)无其他内分泌疾病;
(5)因女方输卵管因素或男方因素行ICSI助孕;
(6)采用《辅助生殖促排卵药物治疗专家共识》里标准的长方案促排卵[3]。排除标准:(1)高泌乳素血症;
(2)多囊卵巢综合征;
(3)子宫内膜异位症;
(4)甲状腺功能亢进症或甲状腺功能低下症。本研究均经河北医科大学第三医院伦理委员会批准且研究对象签署知情同意书。
1.2COH方案 患者排卵后给予皮下注射醋酸曲普瑞林(法国益普生)0.1 mg/d降调节,至月经第2天或第3天起检测血清FSH、LH、E2、P及B超监测研究对象降调节情况。达到降调节(FSH<5 mIU/mL、LH<5 mIU/mL、E2<50 pg/mL,子宫内膜厚度<5 mm)标准后开始皮下注射醋酸曲普瑞林0.05 mg/d直至人绒毛膜促性腺激素(hCG)日,应用醋酸曲普瑞林至18 d时给予促性腺激素(Gn) 75~300 IU/d直至hCG日,根据超声监测的卵泡情况及血清激素水平调整Gn用量。当B超提示出现 3 个及以上主导卵泡直径≥18 mm 时,肌肉注射绒毛促性腺激素5 000~10 000 U,36~38 h后经阴道超声引导下取卵。
1.3卵泡液标本收集 取卵日,采用单腔取卵针取卵(美国库克)。记录每个穿刺卵泡的直径,一一对应收集研究对象卵泡液,将混有血块或者红细胞污染的卵泡液丢弃。将搜集的无血液污染的卵泡液200×g离心10 min,取上清液3 mL置于5 mL的EP管内,标记后置于-80 ℃冰箱中保存储备。
1.4体外受精-胚胎培养 胚胎实验室将获得的每个卵丘复合物单独置于微滴中培养2~4 h后拆蛋,观察卵母细胞成熟度。卵胞浆内可见生发泡,卵周间隙未见第一极体为生发泡期(GV);
卵胞浆内未见生发泡,卵周间隙未见第一极体为第一次减数分裂中期(MⅠ);
卵周间隙可见第一极体为第二次减数分裂中期(MⅡ)。按卵母细胞成熟度进行分组:GV组、MⅠ组和MⅡ组,并根据卵泡直径将MⅡ卵分为大卵泡组(直径≥18 mm)、中卵泡组(14 ~<18 mm)和小卵泡组(直径<14 mm)。
对MⅡ卵行ICSI,受精后的卵置于卵裂胚培养液做成的微滴中。18~20 h观察受精情况并记录,观察到两个极体算正常受精。68~70 h进行卵裂胚评分。卵裂胚评分如下:Ⅰ级,碎片 <10%,卵裂球均匀;Ⅱ级,碎片10%~<25%,卵裂球均匀或略不均匀;Ⅲ级,碎片25%~<50%,卵裂球不均匀;Ⅳ级,碎片50%~≤100%,卵裂球不均匀。7~9细胞Ⅰ/Ⅱ级胚胎定义为优质胚胎,6~10细胞Ⅲ级及以上胚胎为可利用胚胎。实验室结局中各组双原核(2PN)受精率、优质胚胎率、可利用胚胎率计算方法如下:2PN受精率=2PN卵子数/注射MⅡ卵子总数×100%,优质胚胎率=优质胚胎数/正常受精胚胎总数×100%,可利用胚胎率=可利用胚胎数/卵裂胚胎数×100%。
1.5实验室方法 卵泡液中FSH、LH、E2、T水平测定采用化学发光法测定,使用德国罗氏公司的ELECSYS试剂,严格按照试剂盒说明书操作。

2.1研究对象一般情况 本研究共纳入48例患者作为研究对象,平均年龄为(28.23±3.43)岁,平均体重指数(BMI)为(21.43±1.76)kg/m2,基础FSH为(5.94±1.03)mIU/mL,LH为(4.15±0.84)mIU/mL,E2为(43.60±5.55)pg/mL,T为(1.06±0.22)nmol/L。穿刺卵泡688个,共获卵636枚,其中大卵泡获卵379枚,中卵泡获卵143枚,小卵泡获卵114枚。拆蛋后观察卵母细胞成熟度:GV卵79枚,MⅠ卵113枚,MⅡ卵444枚。将444枚MⅡ卵行ICSI治疗,其中小卵泡来源20枚,中卵泡来源69枚,大卵泡来源355枚。
2.2GV组、MⅠ组、MⅡ组激素水平比较 MⅡ组FSH水平显著高于GV组和MⅠ组,差异有统计学意义(P<0.05);
GV组FSH水平与MⅠ组比较,差异有统计学意义(P<0.05)。MⅡ组LH水平显著高于GV组和MⅠ组,差异有统计学意义(P<0.05);
GV组LH水平与MⅠ组比较,差异无统计学意义(P>0.05)。各组E2水平比较差异无统计学意义(P>0.05)。MⅡ组T水平显著高于GV组和MⅠ组,差异有统计学意义(P<0.05);
GV组T水平与MⅠ组比较,差异无统计学意义(P>0.05)。见表1。
2.3MⅡ卵各组激素水平比较 大卵泡组、中卵泡组和小卵泡组FSH、LH、E2、T水平比较,差异无统计学意义(P>0.05)。见表2。
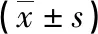
表1 GV组、MⅠ组、MⅡ组激素水平比较
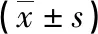
表2 MⅡ卵各组激素水平比较
2.4各组2PN受精率、优质胚胎率、可利用胚胎率比较 从受精率看,大卵泡组2PN受精率高于小卵泡组和中卵泡组,差异有统计学意义(P<0.05);
而小卵泡组2PN受精率与中卵泡组比较,差异无统计学意义(P>0.05)。大卵泡组可利用胚胎率高于小卵泡组和中卵泡组,差异有统计学意义(P<0.05);
而小卵泡组可利用胚胎率与中卵泡组比较,差异无统计学意义(P>0.05)。大卵泡组优质胚率略高于小卵泡和中卵泡组,但两两比较差异无统计学意义(P>0.05)。见表3。

表3 各组2PN受精率、优质胚胎率、可利用胚胎率比较[%(n/n)]
3 讨 论
在卵泡早期FSH可以诱发颗粒细胞逐渐产生LH受体,随着卵母细胞的发育,颗粒细胞中LH受体增多,当卵泡成熟最后阶段,产生的E2对LH形成正反馈,LH达峰值,LH同时促进卵泡膜细胞产生T,与FSH共同促进卵母细胞的成熟[4]。
FSH、LH自垂体分泌后经血液运输作用于颗粒细胞及卵泡膜细胞。FSH在卵泡早期的募集发挥重要作用,随着卵母细胞成熟度的增加,本研究发现,MⅡ组FSH水平显著高于GV组和MⅠ组,GV组FSH水平与MⅠ组比较差异有统计学意义(P<0.05)。GV组LH水平与MⅠ组比较,差异无统计学意义(P>0.05),但是MⅡ组LH水平显著高于GV组和MⅠ组,差异有统计学意义(P<0.05)。这可能是在LH峰发生前环磷酸腺苷(cAMP)和环磷酸鸟苷(cGMP)抑制细胞成熟因子(MPF)的活性,当LH水平增加时,卵母细胞内及卵泡内细胞的cAMP和cGMP急剧降低,对MPF的抑制作用减弱从而促使减数分裂继续,促进卵母细胞成熟[5]。本研究结果显示,不同卵母细胞的卵泡液中E2水平并无显著增加,甚至随着卵母细胞成熟度增加略有下降,这可能与卵泡后期卵泡液体积增大对E2起到稀释作用有关,WALTERS等[6]研究同样发现这一现象。有研究认为左右卵巢的E2水平存在显著差异,但是不同卵母细胞之间E2水平无显著差异[7]。本研究还发现,MⅡ组T水平显著高于GV组和MⅠ组,这与周易等[8]研究结果一致。随着卵母细胞的成熟,颗粒细胞LH受体的增加,T的生成增加。T通过 PI3K/AKT/Foxo3a 信号通路上调始基卵泡中卵母细胞的胰岛素样生长因子-1受体促进始基卵泡的激活,同时T与 FSH 协同作用,增强 cAMP 介导的信号通路活性,从而促进颗粒细胞的增殖和窦前卵泡发育[9-10]。有研究显示,给予T可显著增加窦前和小窦状卵泡的数目,减少了卵泡的闭锁,促进卵泡的发育[11]。但是过量的T,会激活缺氧诱导因子1促进血管内皮生长因子表达,导致卵巢人血管内皮细胞及平滑肌细胞的增殖,进而导致卵巢胶原纤维合成过度,间质弥漫性增生,抑制排卵[12-13]。这在多囊卵巢综合征与非多囊卵巢综合征患者的卵泡液比较中得到验证[14]。
卵泡大小与卵母细胞成熟度及发育潜能的关系一直存在争议。有学者认为卵母细胞的成熟及卵裂能力与卵泡大小无关[15],也有学者持相反观点[16]。本研究发现:大卵泡组、中卵泡组和小卵泡组FSH、LH、E2、T水平比较,差异无统计学意义(P>0.05)。但是大卵泡组受精率、可利用胚胎率显著高于小、中卵泡组。大卵泡组优质胚率略高于小卵泡和中卵泡组,但两两比较差异无统计学意义(P>0.05)。国外有学者同样发现卵泡直径大具有更高的胚胎利用率,而随卵泡直径减小,卵母细胞成熟度和受精率降低,胚胎质量下降[17]。不完全的细胞质成熟可能是造成临床结局差异的原因之一,这也是研究者进行未成熟卵母细胞体外培养成熟(IVM)后行ICSI治疗结局不太理想的主要原因。本研究MⅡ组FSH、LH、T水平显著高于其余两组,因此笔者认为在对GV、MⅠ卵行IVM时应适当添加这3类激素可以促进卵母细胞的成熟。
综上所述,激素与卵泡的发育成熟密切相关,直径≥18 mm的卵泡获取MⅡ卵行ICSI助孕的实验室结局优于直径<18 mm的卵泡。在超促排卵获取较大直径的卵泡中,提高卵母细胞细胞核与胞浆成熟的同步化是IVM获取优质胚胎的重要因素,对于IVM时各种激素的适宜浓度仍需大样本、多中心的研究。
猜你喜欢 受精率卵母细胞成熟度 外源因子调控卵母细胞体外成熟的研究进展中国畜牧杂志(2022年9期)2022-09-14夏季雅士勇对蛋用种鸡受精率及孵化成绩的影响国外畜牧学·猪与禽(2022年1期)2022-04-23外源褪黑素对猪卵母细胞体外成熟及多精受精的影响中国畜牧杂志(2022年4期)2022-04-15cAMP 调节剂对卵母细胞体外成熟效果的调节机制研究进展中国畜牧杂志(2021年5期)2021-12-05褪黑素抑制氧化应激促进牦牛卵母细胞体外成熟的研究青海畜牧兽医杂志(2021年3期)2021-07-27产品制造成熟度在型号批生产风险管理中的应用航天工业管理(2020年9期)2020-12-28国内外技术成熟度评价相关标准规范对比分析研究军事运筹与系统工程(2020年1期)2020-09-11整机产品成熟度模型研究与建立航天工业管理(2020年1期)2020-04-20刚好够吃6天的香蕉学苑创造·B版(2018年12期)2018-03-04浅谈提高鸡的人工受精率的措施科教导刊·电子版(2016年24期)2016-10-29本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0603/606607.html




