【www.zhangdahai.com--其他范文】
冯传涛,唐军伟
(1.宝鸡市中医医院麻醉手术科,陕西 宝鸡 721000;
2.宝鸡市中医医院疼痛科,陕西 宝鸡 721000)
糖尿病病理性神经性疼痛(Diabetic pathologic neuropathic pain,DNP)是糖尿病多发的慢性并发症[1],近年随着糖尿病发病率的升高DNP发病率亦逐年升高。DNP患者临床多表现为痛觉过度、诱发性疼痛和自发性疼痛,对DNP患者的日常生活质量造成了严重的负面影响[2]。DNP的发病机制复杂且尚未完全阐明,持续高糖微环境致使微血管损伤,微血管损伤可继发导致营养缺失和能量缺失,进而致使神经细胞凋亡水平升高并诱发外周神经损伤[3]。研究发现[4],外周神经损伤发生后可继发激活炎性细胞释放更多促炎因子并导致神经元异位放电增多和疼痛阈值降低。故炎症反应假说认为外周炎症水平的升高与DNP病情密切相关[5]。此外近期有证据表明,神经性疼痛患者存在明显的细胞免疫功能缺陷,其机制可能与免疫反应过度激活可促使痛觉过敏产生有关[6]。右美托咪定是高选择性的α2-肾上腺素受体激动剂,在临床术后镇痛、麻醉中得到了广泛的应用[7]。多项证据显示[8-9],右美托咪定可通过调节免疫功能、抑制炎性因子的分泌进而发挥良好的镇痛效果。然而,现阶段右美托咪定是否可通过调节免疫功能和抑制炎症反应水平,进而改善DNP患者疼痛阈值进而促进病情转归仍未见系统证据。基于此背景,本研究拟通过构建DNP大鼠模型,并采用右美托咪定进行干预,旨在为后续DNP的干预治疗提供新思路。
1.1 实验材料 健康SPF级成年雄性SD大鼠32只,体重(220±20)g,8~10周龄。采用随机数字表法将所有大鼠分为四组。空白对照组(8只,不做处理,NC组),右美托咪定组(8只,采用右美托咪定干预,NC+DD组)、糖尿病神经痛组(8只,仅构建模型,DNP组)和糖尿病神经痛+右美托咪定组(8只,构建模型联合右美托咪定干预,DNP+DD组)。
1.2 糖尿病神经痛大鼠模型建立[10]采用腹腔注射链脲佐菌素60 mg/kg的方式构建糖尿病神经痛大鼠模型,造模后1、7、14 d观察模型组大鼠是否存在自发性疼痛行为,主要包括自残、抗重力行为、舔脚、抬脚等行为且血糖≥16.7 mmol/L,若存在则可视为造模成功。模型组在链脲佐菌素注射完成14 d后进行右美托咪定注射干预,方法为背部消毒后采用30 G针头在第4和5腰椎间做穿刺,并在观察大鼠有抬足反应后进行右美托咪定注射1.5 μg/kg,糖尿病神经痛组注射等量生理盐水。
1.3 观察指标
1.3.1 大鼠行为学测定:①热辐射刺激:造模成功后14 d对大鼠进行热辐射热刺激试验,每次30 s,每日重复3次,每两次间间隔5 min,并记录大鼠后肢抬脚的潜伏期。②冷板试验:在热辐射刺激相同时间进行,冷板温度为4 ℃,每次30 s,每日重复3次,每两次间间隔5 min,并记录5 min内总缩腿次数和大鼠足趾缩腿反应潜伏期。③触觉过敏试验:在热辐射刺激相同时间进行,选取清洁的铁网并在铁网下放置Semmes-Weinstein Monofilaments A835仪器,采用不同压力对大鼠足底进行刺激,每次30 s,每日重复3次,每两次间间隔5 min,记录最小能诱发其缩腿的阈值。
1.3.2 机械痛阈的测定:分别于右美托咪定注射后1、7、14 d采用Von Frey电子测痛仪,对大鼠疼痛阈值进行测定。方法为:由Von Fery灯丝施加压力,以0.13 g作为压力起点,使压力呈线性增强直至大鼠力达到 20.1 g(终止值)或大鼠发生撤退反应。经1 mm的锥形塑料尖端将压力传递至后爪背面,并采用相同方法进行压力的施加,以采集大鼠锥形塑料尖端。所有测试均重复3次,结果取平均值。当大鼠机械痛阈<4 g为出现痛觉超敏反应。
1.3.3 免疫功能检测:取20 μl血样加入红细胞裂解液震荡后静置15 min,静置完成后进行离心操作,离心7 min后,吸弃上清并加入1 ml PBS并再次重复上述离心操作,离心持续7 min。随后对大鼠CD4抗体、CD3抗体和CD8a抗体进行标记,分别采用PE、PerCP、FITC进行标记,均为0.2 μl。随后在震荡混匀,并在避光条件下进行染色(染色环境为:4 ℃,时间持续30~40 min),随后采用流式细胞仪检测全血T淋巴细胞CD4+、CD3+和CD8+的表达水平,并计算CD4+/CD8+比值。
1.3.4 炎症反应指标检测:采用脊柱脱臼法处死大鼠后,采集2 ml血样,并采用ELISA法检查所有大鼠外周血中肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、白介素-18(IL-18)。所有检查均严格按照ELISA试剂盒操作进行。

2.1 各组大鼠行为学测定 与NC组比较,NC+DD组爪子对冷刺激的消退潜伏期、爪子对热刺激的消退潜伏期、爪子机械刺激退缩反应更低(均P<0.05),DNP组和DNP+DD组冷刺激的消退潜伏期、爪子对热刺激的消退潜伏期、爪子机械刺激退缩反应高于NC组和NC+DD组(均P<0.05),且DNP组高于DNP+DD组(P<0.05)。见表1。
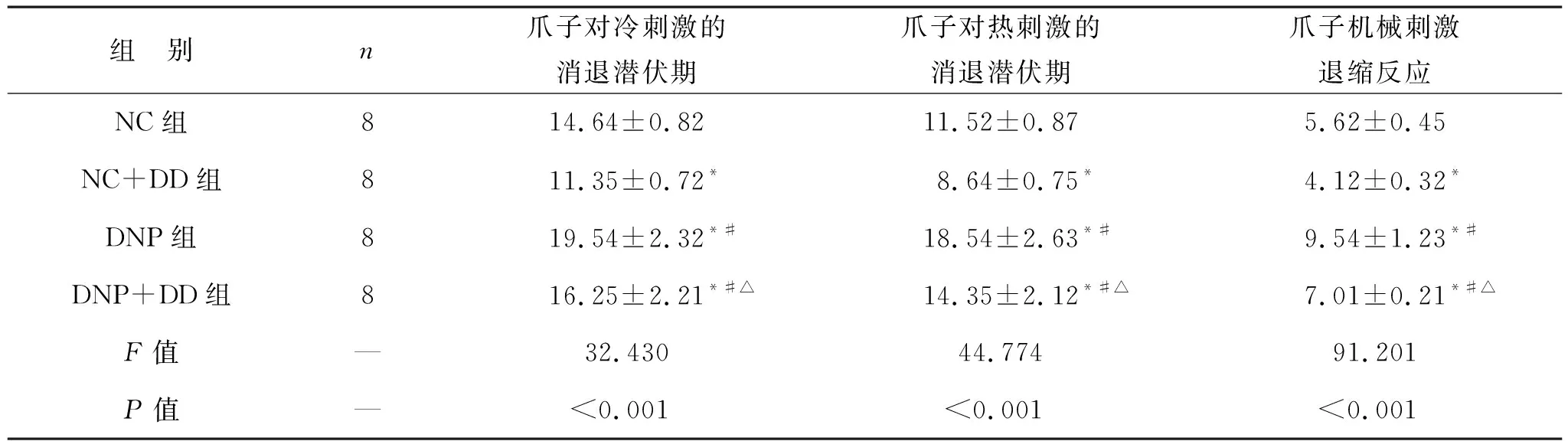
表1 各组大鼠行为学测定(s)
2.2 各组大鼠机械撤退阈值 1、7和14 d与NC组比较,NC+DD组机械撤退阈值明显更高(均P<0.05),DNP组和DNP+DD组机械撤退阈值明显低于NC组和NC+DD组(均P<0.05),且DNP组显著低于DNP+DD组(P<0.05)。见表2。

表2 各组大鼠机械撤退阈值比较(g)
2.3 各组大鼠免疫功能比较 与NC组比较,NC+DD组CD3+、CD4+、CD8+、CD4+/CD8+明显更高(P<0.05),DNP组和DNP+DD组CD3+、CD4+、CD8+、CD4+/CD8+明显低于NC组和NC+DD组(均P<0.05),且DNP组显著低于DNP+DD组(P<0.05)。见表3。
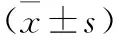
表3 各组大鼠免疫功能比较
2.4 各组大鼠炎症反应指标比较 与NC组比较,NC+DD组TNF-α、IL-1β、IL-18明显更低(均P<0.05),DNP组和DNP+DD组TNF-α、IL-1β、IL-18明显高于NC组和NC+DD组(均P<0.05),且DNP组显著高于DNP+DD组(P<0.05)。见表4。
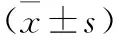
表4 各组大鼠炎症反应指标比较
DNP起病机制复杂,紊乱的神经细胞微环境被认为是DNP病情进行性发展的中心靶点[11]。高糖微环境致使渗透压、氧化还原状态和代谢系统功能紊乱是神经细胞凋亡水平升高的关键,亦是继发导致神经元出现不可逆损伤的重要诱因[12]。本次研究采用腹腔注射链脲佐菌素的方法构建了DNP大鼠模型,注射后大鼠出现明显的自残、抗重力行为、舔脚、抬脚等行为且血糖明显升高,表明DNP大鼠模型构建成功。
中枢神经系统中脊髓小胶质细胞重要的免疫效应细胞生理稳态被打破后,小胶质细胞的形态、数量和功能受到影响并出现一系列变化,进而在神经元和神经系统损伤中扮演重要的桥梁作用[13]。近年来多项动物实验证实[14],脊髓中小胶质细胞的激活与外周神经系统损伤密切相关,而损伤的外周神经系统被证实是DNP的重要病理诱因。小胶质细胞作为中枢神经系统的常驻巨噬细胞,其介导免疫功能和炎症反应机制被证实在多种神经系统疾病中发挥着重要作用[15]。Tsuda等[16]认为,不同于生理性疼痛的是,病理性疼痛不依赖于组织损伤的刺激,而脊髓小胶质细胞的活化在神经性疼痛病情的进展尤为重要。有观点认为,小胶质细胞异常激活后神经系统的免疫功能受损,且促炎因子表达升高进而导致神经性疼痛疾病的病情进展[17]。T淋巴细胞亚群是机体细胞免疫的重要组成。DNP发生后脑部微血管存在明显的损伤,而血管通透性的增加和血管扩张可导致白细胞外溢并促使更多的巨噬细胞向病变处募集,而逐渐积累的巨噬细胞可招募T淋巴细胞向病变处,最终过度聚集的T淋巴细胞可导致免疫功能紊乱。CD3+、CD4+、CD8+、CD4+/CD8+是评估机体T淋巴细胞亚群功能的重要因子。TNF-α、IL-1β、IL-18是机体重要的促炎因子。IL-1β、IL-18受NLRP3炎症小体表达的调控,并在机体免疫-炎症机制的激活中发挥着重要的桥梁作用。研究表明[18],巨噬细胞被激活后可促进下游TNF-α、IL-1β、IL-18因子的表达并激活神经系统炎症。本次研究结果显示,右美托咪定可有效抑制DNP大鼠炎症反应和调节T细胞免疫功能,提示右美托咪定可通过介导炎症和免疫机制改善DNP症状。小胶质细胞介导的神经炎症激活是促进老年痴呆、认知功能障碍等慢性神经疾病发生、发展的关键,NLRP3/Caspase-1炎症小体信号通路是神经系统免疫-炎症激活的关键信号轴,Caspase-1的表达上调可IL-1β、IL-18的表达,进而促进炎症反应水平的升高,右美托咪定可靶向调节免疫功能水平,并抑制神经系统炎症,其机制与调节NLRP3/Caspase-1炎症小体信号通路的表达有关。Meng等[19]研究发现,小胶质细胞诱导的炎症反应激活是导致神经元细胞死亡的重要诱因,采用右美托咪定可靶向上调sirt1的表达进而抑制炎症反应水平升高发挥神经元细胞保护作用。Bao等[20]研究发现,NF-κB被认为是神经系统炎症激活的关键,右美托咪定的应用可有效逆转NF-κB参与激活的神经系统炎症并发挥脑保护作用。本研究结果显示,DNP大鼠采用右美托咪定干预后疼痛阈值明显升高且疼痛相关行为亦明显好转,证实右美托咪定可改善DNP大鼠病情。考虑糖尿病起病后持续的高血糖微环境造成微血管损伤,随着微血管损伤的进行性发展神经系统的小胶质细胞被激活并招募T淋巴细胞向病变处募集,同时可直接促进下游促炎因子的表达,最终表现为导致神经细胞凋亡水平升高,而右美托咪定靶向抑制炎症因子的表达和调节细胞免疫功能有效改善了下游神经细胞凋亡水平,进而促进DNP患者病情转归。
综上所述,炎症反应激活和免疫功能紊乱与DNP大鼠病情密切相关,采用右美托咪定干预可有效抑制炎症因子的表达,并调节免疫功能,进而促进DNP大鼠疼痛水平转归。临床可进一步设计相关随机试验以阐明DNP患者采用右美托咪定进行干预,对逆转神经系统炎症和调节T细胞免疫功能的价值,进而为DNP患者病情的控制和促进病情转归提供新思路。
猜你喜欢 咪定美托阈值 小波阈值去噪在深小孔钻削声发射信号处理中的应用制造技术与机床(2019年9期)2019-09-10基于CS-TWR的动态阈值贪婪算法成像研究成都信息工程大学学报(2019年5期)2019-05-21基于自适应阈值和连通域的隧道裂缝提取西南交通大学学报(2018年6期)2018-12-18胺碘酮联合美托洛尔治疗老年冠心病中国继续医学教育(2015年1期)2016-01-06基于迟滞比较器的双阈值稳压供电控制电路探测与控制学报(2015年4期)2015-12-15右美托咪定的临床研究进展中国当代医药(2015年23期)2015-03-01右美托咪定在颅内肿瘤手术中的临床应用观察中国卫生标准管理(2015年13期)2015-01-26右美托咪定在重型颅脑损伤中的应用研究西南军医(2015年5期)2015-01-23右美托咪定联合咪唑安定镇静在第三磨牙拔除术中的应用西南军医(2015年2期)2015-01-22本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0808/636944.html




