【www.zhangdahai.com--其他范文】
韩 雪,江 波,郭术俊,华梦晴,尹梅花,宋传旺,桑道乾
(蚌埠医学院 1.检验医学院免疫学教研室;
2.第一附属医院神经内科;
3.感染与免疫安徽省重点实验室;
4.慢性疾病免疫学基础与临床安徽省重点实验室;
5.检验医学院,安徽 蚌埠 233030)
吉兰-巴雷综合征(GBS)是急性多神经根病变的自身免疫病[1],以进行性肌无力为特征,最终导致呼吸衰竭[2]。调节性B细胞(Regulatory B cells,Bregs)是机体调节炎症等免疫学反应[3]的重要免疫调节细胞,人外周血中Bregs具有CD19+CD24hiCD38hi的表型[4]。Bregs是免疫抑制细胞,抑制过度炎症反应[5],通过产生IL-10、IL-35和TGF-β1等抑炎性细胞因子发挥作用[6-7]。
在系统性红斑狼疮、类风湿性关节炎等自身免疫病中,Bregs在数量和功能上均受损[8]。然而,Bregs和血清抑炎性细胞因子在GBS发病中的作用有待进一步明确。因此,本研究比较了40例新诊断的GBS患者与40例健康对照组的外周血Bregs、记忆性B细胞、浆细胞的数量和血清抑炎性细胞因子IL-10、IL-35、TGF-β1的水平。
1.1 病人和健康对照组本研究在蚌埠医学院第一附属医院进行GBS患者标本采集,标本采集时间为2019年11月至2021年1月。根据2019年中国GBS诊断标准进行GBS诊断。诊断标准如下:(1)多有前期感染史,起病急,进行性加重,多在4周内达到高峰;
(2)严重GBS患者的四肢对称、延髓支配肌肉、面肌无力、呼吸肌无力;
(3)可伴有感觉异常和自主神经功能障碍;
(4)脑脊液中的蛋白质-细胞分离;
(5)电生理检查提示周围神经脱髓鞘,如潜伏期延长、F波异常、传导阻滞、波形弥散异常等。
GBS患者和健康成年志愿者的纳入和排除标准如下:(1)为了避免因为免疫系统发育不成熟影响研究结果,本研究均选取年龄≥18岁的成年人为研究对象;
(2)研究对象的性别根据临床患者性别情况及知情同意情况进行选取,健康对照组性别与GBS患者性别一致;
(3)根据GBS起病急,进行性加重,多在4周内达到高峰的诊断标准,所有患者均为新确诊,参与研究时均处于GBS急性期;
(4)由于药物治疗会影响研究结果,所有参与研究的GBS患者及健康对照组均未接受静脉注射免疫球蛋白治疗。
本研究对40名GBS患者(26名男性和14名女性)进行研究,同时以40名健康成年志愿者(26名男性和14名女性)作为健康对照组。两组研究对象均按照上述纳入和排除标准进行选择。本研究经蚌埠医学院伦理委员会批准,所有GBS患者都签署了知情同意书。
1.2 标本采集每名GBS患者和健康对照组人员采集5 mL外周静脉血,肝素抗凝。吸取1 mL外周静脉血用于流式细胞术实验(详见1.3)。剩余4 mL外周静脉血低速离心(1 847×g)10 min,分离血清用于检测IL-10、IL-35和TGF-β1含量。
1.3 B细胞亚型的数量检测全血与荧光抗体在4 ℃孵育30 min。所用荧光抗体分别为异硫氰酸荧光素(FITC)标记的抗CD24抗体、藻红蛋白(PE)标记的抗CD19抗体、PEcy5标记的抗CD27抗体和APC标记的抗CD38抗体(抗体均来自eBioscience, San Diego, CA, USA)。
然后用3 mL 0.83%氯化铵在22 ℃恒温水浴中裂解红细胞10 min,低速(1 847×g)离心5 min。弃上清液,用2 mL PBS 重悬细胞,再次低速(1 847×g)离心5 min,弃上清液后加入400 μLPBS。用流式细胞仪(BD FACSVerse;
BD Biosciences, San Jose, CA, USA)检测CD19+B淋巴细胞,具体检测CD19+CD24hiCD38hiBregs、CD19+CD27+CD24hi记忆性B细胞和CD19+CD27hiCD38hi浆细胞的数量。
1.4 血清IL-10、IL-35和TGF-β1检测从GBS患者和健康对照组人员外周静脉血中分离的血清以500 μL/管进行分装,使用商品试剂盒(CUSABIO,中国湖北武汉)按照说明书进行IL-10、IL-35和TGF-β1的酶联免疫吸附检测,本实验采用定量酶免疫分析技术。所用商品试剂盒已将IL-10、IL-35和TGF-β1特异性抗体预包被于微孔板上。将标准品和血清样品移加入各孔中,包被的特异性固相化抗体结合血清标本中的IL-10、IL-35和TGF-β1。洗去所有未结合物质后,向孔中加入抗IL-10、IL-35和TGF-β1的生物素标记抗体。洗涤后,将亲和素结合的辣根过氧化物酶(HRP)加入各孔中。洗涤去除任何未结合的亲和素酶试剂后,向孔中加入底物溶液,显色颜色深浅与初始步骤中所结合的IL-10、IL-35和TGF-β1的量成正比。终止显色后,用酶标仪检测各孔450 nm处的吸光度值。
1.5 统计学分析采用SPSS 16.0软件对数据进行分析,计量数据以“均数±标准差”表示。组间结果采用t检验进行比较,P<0.05为有统计学意义。所有实验均独立重复3次。
2.1 GBS患者外周血CD19+CD24hiCD38hiBregs占总B细胞的比例降低流式细胞术结果发现,与健康对照组相比,GBS患者外周血中CD19+CD24hiCD38hiBregs占总B细胞的比例显著降低(P<0.01,见图1)。GBS患者和健康对照组相比较,外周血CD19+CD27+CD24hi记忆性B细胞和CD19+CD27hiCD38hi浆细胞占外周血总B细胞的比例无显著差异(见图2和图3)。

图1 GBS患者外周血CD19+CD24hiCD38hiBregs占总B细胞比例
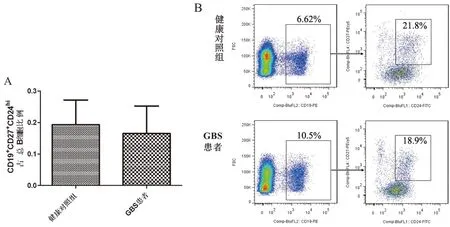
图2 GBS患者外周血CD19+CD27+CD24hi记忆性B细胞占总B细胞比例

图3 GBS患者外周血CD19+CD27hiCD38hi浆细胞占总B细胞比例
2.2 GBS患者血清中IL-10、IL-35和TGF-β1水平升高与健康对照组相比,GBS患者血清中IL-10、IL-35和TGF-β1水平均升高(图4)。
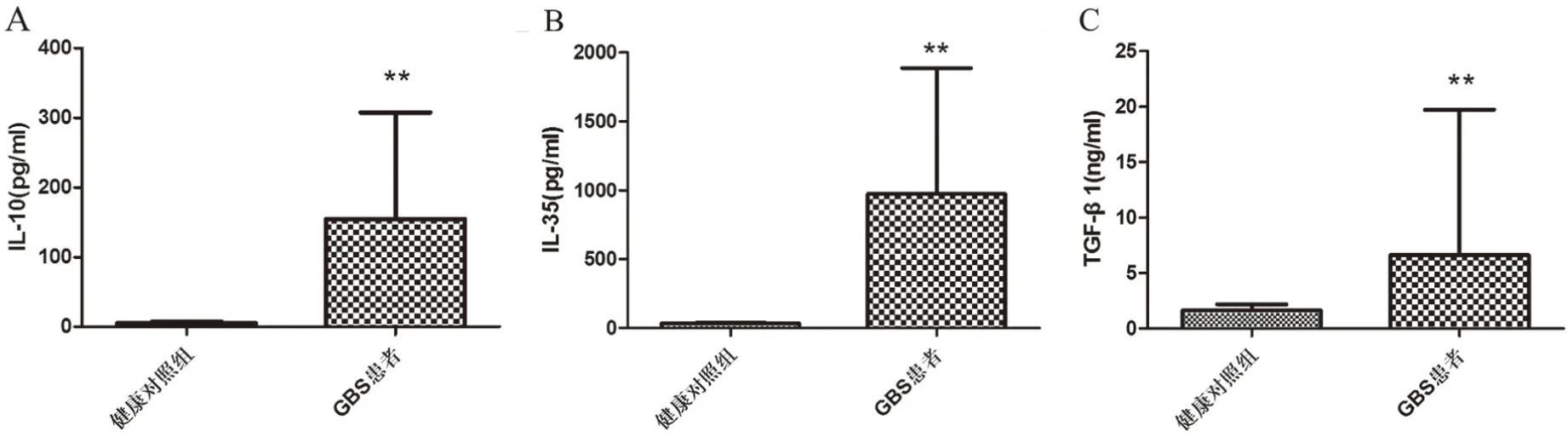
图4 GBS患者血清IL-10、IL-35和TGF-β1的ELISA结果
在全球范围内,GBS是非脊髓灰质炎病毒急性弛缓性麻痹最常见的病因[9]。预先感染病原体通常是GBS的触发因素[10]。GBS的发病机制涉及分子模拟,一些病原体有类似于周围神经髓鞘和/或轴突表位的抗原。空肠弯曲杆菌、巨细胞病毒、Epstein-Barr病毒、肺炎支原体、流感嗜血杆菌、乙型肝炎病毒[11]、戊型肝炎病毒、SARS-CoV和MERS-CoV与GBS的发生有关。目前,在Zika病毒大流行和COVID-19大流行期间,GBS发病率有所上升[12]。
Bregs是实现自身免疫的关键参与者,是负向调节免疫的细胞。在自身免疫性疾病中,包括系统性红斑狼疮、类风湿性关节炎、多发性硬化症、免疫性血小板减少症和Graves病,CD19+CD24hiCD38hiBregs数量减少[8]。GBS是外周神经自身免疫性疾病,我们研究发现GBS患者外周血CD19+CD24hiCD38hiBregs占总B细胞的比例降低,这与上述研究[8]一致。
考虑到有研究表明记忆性B细胞和浆细胞在自身免疫性疾病的发病机制中发挥重要作用[13],我们同时也检测了外周血CD19+CD27+CD24hi记忆性B细胞和CD19+CD27hiCD38hi浆细胞占总B细胞的比例。本研究的创新点在于首次对GBS患者外周血CD19+CD27+CD24hi记忆性B细胞数量和CD19+CD27hiCD38hi浆细胞数量进行了分析,为阐明GBS疾病进展及发病机制提供部分依据。记忆性B细胞迅速分化为效应细胞,因此它们在自身免疫性疾病中的作用不容忽视。研究发现GBS患者外周血CD19+CD27+CD24hi记忆性B细胞数量与健康对照组相比无显著差异。缺乏差异可以反映GBS患者疾病处于早期阶段。如果抗体在疾病的发展中发挥重要作用,那么外周血的CD19+CD27hiCD38hi浆细胞的数量将与健康对照组不同。然而,我们发现在GBS患者和健康对照组中CD19+CD27hiCD38hi浆细胞的比例并没有显著差异,这表明抗体的功能可能在GBS发病机制中不占主导地位。
免疫应答的调节机制复杂,包括Bregs分泌的抑炎性细胞因子IL-10、IL-35和TGF-β1。因此,检测GBS患者血清中IL-10、IL-35和TGF-β1的水平对阐明GBS的发病机制具有重要意义。IL-10的分泌促进Bregs对自身抗原的耐受及其抗炎活性和对自身免疫反应的抑制[4,6],研究认为IL-35和TGF-β1也是免疫抑制/抗炎性细胞因子[7]。与这些观点不一致的是,我们发现与健康对照组相比,新发GBS患者血清中IL-10、IL-35和TGF-β1的表达却均升高。
调节性T细胞(regulatory T cells,Tregs)抑制B细胞的活化、增殖和分化[13]。在系统性红斑狼疮中,浆细胞样树突状细胞(plasmacytoi dsdendritic cells,pDCs)和Bregs之间存在异常反馈调节。狼疮动物模型中,骨髓源性抑制细胞(myeloids-derived suppressorc ells,MDSCs)作为一种免疫抑制细胞,通过诱导型一氧化氮合酶(nitric oxide synase,iNOS)发挥Bregs效应,从而抑制自身免疫反应。综上所述,Tregs、pDCs和MDSCs也可能参与了自身免疫性疾病GBS的发病。在自身免疫性疾病的发病机制中,T细胞和单核细胞也可能产生和释放IL-10、IL-35和TGF-β1[14]。据此分析,在自身免疫性疾病患者中,Bregs来源的抑炎性细胞因子可能仅占体内IL-10、IL-35和TGF-β1的一部分。本研究中,GBS患者外周血Bregs减少,而血清中IL-10、IL-35和TGF-β1的表达均增加。根据上述研究基础,我们推测可能是其他免疫调节性细胞(如Tregs、pDCs和MDSCs)对GBS患者血清中这些抑炎性细胞因子的分泌进行了代偿。因此,GBS患者外周血Bregs与其他免疫调节性细胞之间的关系有待进一步研究。
我们的研究发现,与健康对照组相比,GBS患者外周血CD19+CD24hiCD38hiBregs占总B细胞的比例降低,而外周血CD19+CD27+CD24hi记忆性B细胞和CD19+CD27hiCD38hi浆细胞占总B细胞的比例无显著差异。与健康对照组相比,GBS患者血清IL-10、IL-35和TGF-β1水平显著上调。
综上所述,Bregs在GBS中是重要的负性自身免疫调节细胞,这增加了我们对GBS发病机制的认识。本研究的重要意义在于,联合检测分析外周血中CD19+CD24hiCD38hiBregs占总B细胞比例以及血清中抑炎性细胞因子IL-10、IL-35和TGF-β1水平,可以作为揭示GBS临床特征及探讨发病机制的重要方法。
猜你喜欢 记忆性浆细胞外周血 骨髓涂片联合活组织检查浆细胞数量对浆细胞骨髓瘤的诊断价值中国临床医学(2022年3期)2022-07-08不同方法诱导小鼠产生CD8+记忆性T细胞的研究浙江医学(2022年8期)2022-05-21外周血B细胞耗竭治疗在狼疮性肾炎中的应用进展现代临床医学(2022年2期)2022-04-19以喉炎为首发临床表现的原发性浆细胞白血病1例并文献复习天津医科大学学报(2021年3期)2021-07-21器官移植中记忆性T细胞的研究进展微创医学(2020年6期)2020-03-09黏膜记忆性T 细胞功能中国畜禽种业(2018年5期)2018-01-18记忆性B细胞体外扩增影响因素的研究进展①中国免疫学杂志(2017年1期)2017-01-17浆细胞唇炎1例中国中西医结合皮肤性病学杂志(2016年4期)2016-07-18白血病外周血体外诊断技术及产品中国科技信息(2015年2期)2015-11-16雷利度胺联合方案治疗恶性浆细胞肿瘤的临床疗效观察医学研究杂志(2015年5期)2015-06-10本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0823/643674.html




