【www.zhangdahai.com--其他范文】
罗荣耀,张颖帆,陈德坤,,张莎,旷敏,彭伟伟,黄琪,*,邹振兴*(.大理大学药学院,云南 大理 67000;
.中南大学湘雅药学院,长沙 400;
.中南大学湘雅医院,长沙 40008)
植物内生真菌是与健康植物共生的一类微生物群落,同时也是天然药用资源研究与开发的一大热点[1]。研究表明植物内生真菌的次级代谢产物种类繁多且具有丰富多样的生物活性,其在发现新药或药物先导化合物的研究中具有广阔的应用前景[2]。
香青(Anaphalis sinicaHance)是菊科香青属多年生草本植物,以全草入药,具有祛痰、镇咳、平喘、止痢的功效,常用于外感咳嗽、支气管炎、肠炎、痢疾等症[3-4]。目前香青属植物主要见于植物化学及中医药利用,而对其内生真菌的研究还比较薄弱。为了进一步开发利用香青内生真菌资源,本研究从香青叶片组织中分离得到一株真菌XQ-4,依据菌种ITS 测序并与GenBank 数据库比对分析鉴定为Metapochonia bulbillosaXQ-4。内生真菌Metapochonia bulbillosaXQ-4 隶属于麦角菌科泛普可尼亚菌属,该菌为首次从香青中分离得到[5],且国内外目前尚未有针对其次级代谢产物的相关报道。香青对葡萄球菌和植物病原真菌有一定的抑制作用[6-8],本研究基于香青的抗菌活性,选取其内生真菌Metapochonia bulbillosaXQ-4 为研究对象,以期探索该真菌的次级代谢产物中是否有结构新颖、抗菌活性优良的先导化合物。采用色谱技术从该菌大米发酵产物乙酸乙酯萃取部位分离得到8 个化合物(见图1),经分析波谱数据后鉴定为sescandelin B(1)、diorcinol(2)、cordyol E(3)、5-羟基-2,3-二甲基-7-甲氧基色原酮(4)、(-)-terpestacin(5)、对-羟基苯甲醛(6)、2,10,12-十三碳三烯-6,7-二元醇(7)、十八碳二烯酸单甘油酯(8),并初步对它们的肿瘤细胞毒活性和抗菌活性进行评价。

图1 化合物1~8 的化学结构示意图Fig 1 Chemical structures of compounds 1~8
核磁共振波谱仪(Bruker AV-600,Bruker 公司);
Agilent 6500 系列Q-TOF 质谱仪(Agilent 1290 UPLC-6545 accurate mass Q-TOF、分析型高效液相色谱仪(Agilent 1200/1100 series,配备DAD 紫外检测器);
YMC-Pack ODS A 色谱柱(250 mm×4.6 mm,5 μm)、半制备型高效液相色谱仪(Agilent 1100 series,配备VWD 紫外检测器)(Agilent 科技公司);
Autopol IV-T 全自动旋光仪(美国鲁道夫公司);
ODS 反相C18填料(日本 YMC 公司);
柱色谱用硅胶(200~300 目、80~100 目,青岛永海硅胶有限公司);
Sephadex LH-20 葡聚糖凝胶(美国GE 公司);
HPD-100 型大孔吸附树脂(沧州宝恩吸附材料科技有限公司);
薄层色谱用硅胶(青岛海洋化工厂);
EYELA NN-1100S-W 型旋转蒸发仪(上海亚荣生化仪器);
乙腈为色谱纯,其他试剂均为分析纯。抗菌活性实验菌株Staphylococcus aureus(S.aureus)(ATCC29213)、Enterococcus faecalis(E.faecalis)(ATCC29212)、Escherichia coli(E.coli)(ATCC25922)及Pseudomonas aeruginosa(P.aeruginosa)(ATCC27853)均来源于中南大学湘雅二医院;
细胞毒活性实验人源肝癌细胞HepG2 和SMMC-7721 来源于中国医学科学院基础医学研究所细胞资源中心。
香青植株于2019 年8 月采自湖南省常德市石门县壶瓶山峰顶,经中南大学湘雅药学院徐康平副教授鉴定。实验目标菌株分离自香青叶片组织,委托擎科生物有限公司进行ITS 测序,将DNA 测序结果与GenBank 数据库比对,鉴定为Metapochonia bulbillosaXQ-4,GenBank 登录号为No.7X9904XT013。目前菌种保存于中南大学湘雅药学院天然药物化学实验室。
2.1 菌株发酵
在酵母浸出粉胨葡萄糖琼脂液体培养基(YPD 培养基)中植入XQ-4 菌株,于25℃、180 r·min-1振荡培养7 d 后得到真菌种子液,平均倒入20 瓶装有固体培养基的500 mL 锥形瓶(每瓶加入250 g 大米,250 g 超纯水,121℃高压蒸汽灭菌25 min,冷却至室温后即得固体培养基),密封后于28℃恒温下静置培养28 d。
2.2 发酵产物的分离纯化
待XQ-4 菌株在5 kg 固体培养基发酵28 d后,用乙酸乙酯冷浸萃取菌丝体和固体发酵物并减压浓缩得到45.8 g 浸膏,采用大孔树脂色谱柱以20%、80%和100%乙醇三个梯度进行洗脱。80%乙醇洗脱部位采用硅胶柱色谱(200~300目),以石油醚-乙酸乙酯体系梯度洗脱,经TLC点板监测合并,共得到8 个流分(Fr.1~Fr.8)。其中Fr.2 经ODS 色谱柱,以甲醇-水体系梯度洗脱,得到4 个流分(Fr.2-1~Fr.2-4)。Fr.2-1 经半制备高效液相色谱(以乙腈-纯水为流动相,20%~40%乙腈洗脱30 min,3 mL·min-1)制备得到化合物6(7.2 mg),Fr.2-2 经半制备高效液相色谱(以乙腈-纯水为流动相,30%~60%乙腈洗脱30 min,3 mL·min-1)制备得到化合物2(5.1 mg),Fr.2-3 经Sephadex LH-20 柱色谱,以甲醇为洗脱剂纯化,最后经半制备高效液相色谱(以乙腈-纯水为流动相,30%~70%乙腈洗脱40 min,3 mL·min-1)制备得到化合物3(4.3 mg)、4(4.7 mg)和7(8.0 mg)。Fr.6 采用硅胶柱色谱(300~400 目)分离,以二氯甲烷-甲醇体系梯度洗脱,TLC 点板监测合并,得到6 个流分(Fr.6-1~Fr.6-6),其中Fr.6-6 经半制备高效液相色谱(以乙腈-纯水为流动相,60%~95%乙腈洗脱30 min,3 mL·min-1)制备得到化合物8(5.1 mg)。Fr.7 经ODS 色谱柱,以甲醇-水体系梯度洗脱,得到4 个流分(Fr.7-1~Fr.7-4)。Fr.7-3 经Sephadex LH-20 柱色谱,以甲醇为洗脱剂纯化,最后经半制备高效液相色谱(以乙腈-纯水为流动相,50%~95%乙腈洗脱30 min,3 mL·min-1)制备纯化得到化合物1(5.8 mg),Fr.7-4 经Sephadex LH-20 柱色谱,以甲醇为洗脱剂纯化,最后经半制备高效液相色谱(以乙腈-纯水为流动相,50%~95%乙腈-水洗脱30 min,3 mL·min-1)制备纯化得到化合物5(5.8 mg)。
2.3 结构鉴定
化合物1:棕色固体,易溶于甲醇。1H-NMR(600 MHz,DMSO-d6)δH:2.30(3H,s,H-9),4.42(2H,s,H-10),6.32(1H,s,H-7),6.63(1H,s,H-5);
13C-NMR(150 MHz,DMSO-d6)δC:17.1(C-9),56.4(C-10),98.5(C-8a),101.7(C-7),102.0(C-5),113.7(C-4),140.1(C-4a),152.9(C-3),163.4(C-8),165.5(C-1),166.6(C-6)。以上数据与文献[9]报道基本一致,故化合物1 鉴定为sescandelin B。
化合物2:棕色固体,易溶于甲醇。HRESI-MS 显示m/z[M+H]+231.1017(Calcd.for C14H15O3,231.1016),推测分子式为C14H14O3;
1H-NMR(600 MHz,DMSO-d6)δH:2.18(6H,t,J=1.8 Hz,H-7,H-7"),6.16(2H,s,H-2,H-2"),6.24(2H,s,H-4,H-4"),6.34(2H,s,H-6,H-6"),9.48(2H,s,3-OH,3"-OH);
13C-NMR(150 MHz,DMSO-d6)δC:21.6(C-7,C-7"),103.4(C-2,C-2"),110.5(C-6,C-6"),111.6(C-4,C-4"),140.5(C-5,C-5"),158.1(C-3,C-3"),158.9(C-1,C-1")。以上数据与文献[10]报道基本一致,故化合物2 鉴定为diorcinol。
化合物3:棕色固体,易溶于甲醇。HRESI-MS 显示m/z[M+H]+245.1174(Calcd.for C15H17O3,245.1172),推测分子式为C15H16O3;
1H-NMR(600 MHz,DMSO-d6)δH:2.18(3H,s,H-7"),2.24(3H,s,H-7),3.71(3H,s,H-8),6.16(1H,t,J=1.8 Hz,H-2"),6.24(1H,brs,H-4"),6.34(1H,brs,H-2),6.36(1H,brs,H-6,H-6"),6.53(1H,brs,H-4);
13C-NMR(150 MHz,DMSO-d6)δC:21.6(C-7),21.7(C-7"),55.6(C-8),102.6(C-2),103.3(C-2"),110.2(C-4),110.3(C-4"),111.7(C-6"),112.0(C-6),140.6(C-5"),140.8(C-5),158.0(C-1,C-3"),159.0(C-1"),160.9(C-3)。以上数据与文献[11]报道基本一致,故化合物3 鉴定为cordyol E。
化合物4:棕色固体,易溶于二氯甲烷。HRESI-MS 显示m/z[M+H]+221.0810(Calcd.for C12H13O4,221.0808),推测分子式为C12H12O4;
1H-NMR(600 MHz,DMSO-d6)δH:1.93(3H,s,H-10),2.40(3H,s,H-11),3.84(3H,s,H-12),6.34(1H,d,J=1.8 Hz,H-2),6.56(1H,d,J=1.8 Hz,H-4);
13C-NMR(150 MHz,DMSO-d6)δC:9.3(C-11),18.7(C-10),56.4(C-12),92.3(C-4),98.1(C-2),104.2(C-6),114.9(C-8),157.6(C-7),161.6(C-5),164.2(C-1),165.3(C-3),181.7(C-9)。以上数据与文献[12]报道基本一致,故化合物4 鉴定为5-羟基-2,3-二甲基-7-甲氧基色原酮(5-hydroxy-2,3-dimethyl-7-methoxychromone)。
化合物5:白色固体,易溶于二氯甲烷。HRESI-MS 显示m/z[M+H]+403.2853(Calcd.for C25H39O4,403.2843),推测分子式为C25H38O4,比旋光度为-17.674(c0.17,MeOH);
1H-NMR(600 MHz,DMSO-d6)δH:0.85(3H,s,H-19),1.16(3H,d,J=5.4 Hz,H-25),1.46(3H,s,H-22),1.49(2H,m,H-10),1.58(6H,s,H-20,H-21),1.63,2.18(2H,m,H-2),1.65,1.97(2H,m,H-9),1.80,2.30(2H,m,H-14),1.97,2.23(2H,m,H-5),2.17,2.23(2H,m,H-6),2.50(1H,m,H-23),2.62(1H,brd,J=11.4 Hz,H-15),3.48,3.60(2H,dd,J=7.8,9.0 Hz,H-24),3.81(1H,m,H-11),5.11(1H,m,H-7),5.22(1H,m,H-13),5.26(1H,m,H-3);
13C-NMR(150 MHz,DMSO-d6)δC:10.8(C-22),14.7(C-25),16.5(C-19),16.1(C-21),15.5(C-20),23.8(C-6),29.0(C-14),30.7(C-10),34.9(C-9),37.8(C-23),39.5(C-2),40.5(C-5),48.5(C-15),49.0(C-1),64.3(C-24),74.7(C-11),122.6(C-3),123.8(C-7),127.5(C-13),132.9(C-8),137.0(C-4),137.2(C-12),147.7(C-17),150.9(C-16),207.7(C-18)。以上核磁和旋光数据与文献[13]报道基本一致,故化合物5 鉴定为(-)-terpestacin。
化合物6:白色固体,易溶于二氯甲烷。HR-ESI-MS 显示m/z[M+H]+123.0449(Calcd.for C7H7O2,123.0441),推测分子式为 C7H6O2;
1H-NMR(600 MHz,D2O)δH:7.01(2H,d,J=8.4 Hz,H-3,H-5),7.84(2H,d,J=9.0 Hz,H-2,H-6),9.70(1H,s,H-7);
13C-NMR(150 MHz,D2O)δC:118.9(C-3,C-5),131.4(C-1),136.0(C-2,C-6),165.6(C-4),197.7(C-7)。以上数据与文献[14]报道基本一致,故化合物6 鉴定为对-羟基苯甲醛(p-hydroxybenzaldehyde)。
化合物7:白色固体,易溶于二氯甲烷。HRESI-MS 显示m/z[M+H]+211.1686(Calcd.for C13H23O2,211.1693),推测分子式为 C13H22O2;
1H-NMR(600 MHz,DMSO-d6)δH:1.61(3H,d,J=5.4 Hz,H-1),1.64~1.55(1H,m,H-5a),1.35~1.24(1H,m,H-5),2.20~2.26(2H,m,H-9),5.10,4.96(2H,dd,J=16.8,10.2 Hz,H-13),5.40(1H,dq,J=16.0,7.0 Hz,H-2),5.42(1H,dq,J=16.0,7.0 Hz,H-3),5.77(1H,m,H-10),6.07(1H,dd,J=15,10.2 Hz,H-11),6.31(1H,ddd,J=16.8,10.2,6.6 Hz,H-12);
13C-NMR(150 MHz,DMSO-d6)δC:18.3(C-1),28.9(C-9),32.8(C-8),33.3(C-5),73.6(C-7),73.7(C-6),115.3(C-13),124.5(C-2),131.1(C-11),132.2(C-3),136.3(C-10),137.8(C-12)。以上数据与文献[15]报道基本一致,故化合物7 鉴定为2,10,12-十三碳三烯-6,7-二元醇(2,10,12-triene-6,7-diol)。
化合物8:黄色油状物,易溶于二氯甲烷。1H-NMR(600 MHz,DMSO-d6)δH:0.86(3H,t,J=6.6 Hz,H-18),1.26(8H,m,H-4~7,H-15~17),1.51(2H,m,H-3),2.02(2H,m,H-8,H-14),2.28(2H,t,J=7.8 Hz,H-2),2.74(2H,t,J=6.6 Hz,H-11),3.63,3.90(2H,m,H-3"),4.03(2H,m,H-2"),4.85,4.61(2H,m,H-1"),5.34(4H,m,H-9,10,12,13);
13C-NMR(150 MHz,DMSO-d6)δC:14.4(C-18),22.4(C-17),24.9(C-3),25.7(C-11),27.1(C-8),27.1(C-14),28.9(C-4),29.0(C-5),29.1(C-15),29.2(C-6),29.5(C-7),31.4(C-16),33.9(C-2),63.1(C-1"),66.0(C-3"),69.8(C-2"),128.2(C-10),128.2(C-12),130.2(C-9),130.2(C-13),173.4(C-1)。以上数据与文献[16]报道一致,故化合物8 鉴定为十八碳二烯酸单甘油酯(glycerol-1-linoleate)。
2.4 生物活性评价
2.4.1 细胞毒活性 将两株人源性肝癌细胞系HepG2 和SMMC-7721 植入含10%胎牛血清及100 U·mL-1青霉素/链霉素的RPMI-1640 培养基、37℃下培养,制成1×105个·mL-1细胞悬浮液接种于96 孔板中(100 μL·孔-1),于培养箱中37℃、5% CO2条件下孵育24 h 后,用1.25~80 μmol·L-1的目标化合物和1.25~80 μmol·L-1的阳性对照药索拉非尼处理细胞。继续培养48 h后每孔加入50 μL MTT(2 mg·mL-1),37℃下反应4 h 后加入200 μL 二甲基亚砜(DMSO)溶解甲瓒晶体,在450 nm 处测定吸光度值(OD450),平行测定3 次,取平均值[17]。计算化合物对肿瘤细胞的增殖抑制率,抑制率(%)=[1-(OD实验孔-OD空白孔)/(OD对照孔-OD空白孔)]×100%,并采用非线性回归模型绘制S 型剂量-抑制率曲线,计算各化合物的IC50值。结果显示化合物8 对SMMC-7721、HepG2 细胞增殖具有抑制活性[IC50值分别为(58.01±1.62)和(53.30±2.97)μmol·L-1],具体结果见表1。
表1 部分化合物细胞毒活性(±s,n=3)Tab 1 Cytotoxicities of compounds against two human tumor cell lines(±s,n=3)

表1 部分化合物细胞毒活性(±s,n=3)Tab 1 Cytotoxicities of compounds against two human tumor cell lines(±s,n=3)
化合物IC50 /(μmol·L-1)HepG2SMMC7721化合物1--化合物3--化合物4--化合物6--化合物7--化合物853.30±2.9758.01±1.62索拉非尼(阳性对照) 2.19±0.04 4.80±0.08
2.4.2 抗菌活性 将4 种致病菌株分别植入Mueller-Hinton 肉汤培养基(MHB),37℃下培养,制成1×106CFU·mL-1的菌液接种于96 孔板(50 μL/孔),用1~64 μg·mL-1的目标化合物及相同浓度梯度的阳性对照药万古霉素、硫酸阿米卡星处理后,再于各孔中加入50 μL 刃天青显色液,35℃下培养8 h 后目视观察法读取结果。结果显示化合物1、3、4、6、7、8 对S.aureus和P.aeruginosa具有抑制活性,对P.aeruginosa的MIC值均为64 μg·mL-1,对S.aureus的MIC值分别为16、16、4、16、32、4 μg·mL-1。所有被测化合物在最大浓度64 μg·mL-1下对E.faecalis和E.coli均未显示抑菌活性,结果见表2。
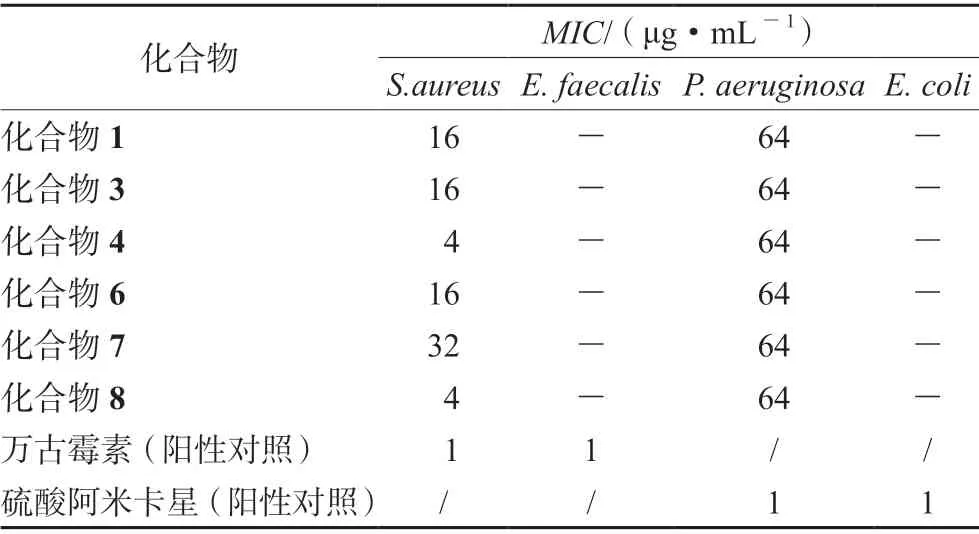
表2 部分化合物抗菌活性Tab 2 Antimicrobial activities of compounds against 4 pathogenic bacteria
药用植物内生真菌是与植物共生的一类种群庞大的微生物群体,能够产生结构丰富及活性多样的次级代谢产物,如萜类、生物碱类、黄酮类、苯丙素类和肽类等,具有优良的抗菌、抗肿瘤等生物活性。近年来,国内外学者已陆续在药用植物内生真菌的次级代谢产物中发现了紫杉醇等与宿主植物相同或相似的活性物质。药用植物香青中主要含有黄酮类、糖苷类及甾体类等化学成分,其中槲皮素、山柰酚等黄酮类物质具有明显的抗肿瘤活性[17-18];
亦含有萜类及薁型衍生物等丰富的挥发油成分,其中α-葎草烯、α-蒎烯等多种萜类物质具有明显的抗菌、抗肿瘤、抗炎及镇咳祛痰等作用,薁型衍生物具有抗菌、抗肿瘤及杀虫等作用[19-21]。本研究基于药用植物香青的抗菌活性,以前期活性筛选得到的内生真菌Metapochonia bulbillosaXQ-4 为研究对象,以期探索该真菌次级代谢产物中是否有结构新颖、生物活性优良的先导化合物。本研究首次从中分离出内生真菌Metapochonia bulbillosaXQ-4,并对该真菌的次级代谢产物进行研究,从香青中分离得到1 个香豆素(1)、2 个二苯醚(2 和3)、1 个色原酮(4)、1 个萜类(5)、1 个苯酚类(6)和2 个长链化合物(7 和8)。体外活性测试结果显示,化合物1、3、4、6、7 和8 对S.aureus、P.aeruginosa均具有不同程度的抑制活性,化合物8 对SMMC-7721 和HepG2 细胞的增殖有微弱的细胞毒活性。通过比较内生真菌Metapochonia bulbillosaXQ-4 次级代谢产物与其宿主植物香青的化学成分,发现其间并没有表现出明显的产物结构相似性,但对该菌株次级代谢产物的研究结果表明,其中次级代谢产物结构类型丰富、生物活性多样,这为后续对该菌株及香青的其他内生真菌的深入研究奠定了一定的实验基础。
本研究首次对真菌Metapochonia bulbillosaXQ-4 次级代谢产物和生物活性进行研究,丰富了药用植物香青的内生真菌资源多样性,同时为真菌Metapochonia bulbillosaXQ-4 次级代谢产物的进一步研究与利用提供参考。
猜你喜欢 内生乙腈产物 高纯乙腈提纯精制工艺节能优化方案煤化工(2022年3期)2022-07-08球形三氧化钼还原产物形貌粉末冶金技术(2021年3期)2021-07-28吹扫捕集-气相色谱-三重四极杆质谱法同时测定饮用出厂水中6种卤乙腈色谱(2021年7期)2021-06-07植物内生菌在植物病害中的生物防治湖北农机化(2020年4期)2020-07-24内生微生物和其在作物管理中的潜在应用世界农药(2019年4期)2019-12-30《天然产物研究与开发》青年编委会天然产物研究与开发(2019年10期)2019-11-05“党建+”激活乡村发展内生动力今日农业(2019年11期)2019-08-15授人以渔 激活脱贫内生动力乡村地理(2018年2期)2018-09-197-ACT缩合反应中三氟化硼乙腈络合物代替液体三氟化硼乙腈的可行性分析山东工业技术(2016年10期)2016-09-06天然产物中的血管紧张素转化酶抑制剂中国民族医药杂志(2016年2期)2016-05-14本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0823/643701.html




