【www.zhangdahai.com--其他范文】
周 梅,李思佳,徐玮峰,黄金保,罗小松,吴 雷
(贵州民族大学物理与机电工程学院, 贵阳 550025)
聚对苯二甲酸乙二醇酯(PET)作为常用的热塑性塑料之一,由于其具有优异的热稳定性和耐磨性等性质,被广泛应用于日常生活和食品包装等各领域,给人们的日常生活带来了极大的便利[1⁃4]。然而,PET塑料的大量生产和使用造成了PET塑料垃圾的数量急剧增加。PET废塑料具有高稳定和耐腐蚀等特性,使其在不受外界因素影响的情况下难以降解[5],这不仅严重污染环境,同时还造成了资源浪费[6⁃8]。因此,有效回收利用废塑料PET,对保护环境和节约资源具有重要意义。热解是一种在无氧环境下使高分子聚合物发生裂解的热化学转化技术[9⁃11],被广泛应用于聚合物的回收循环利用。聚合物热解转化成小分子化合物的过程需要较高的温度,所形成的产物组分复杂,废塑料原料回收利用的成本较高[12]。如果适当改变降解环境能够有效控制聚合物降解过程中的产物组分和分布及降低热解过程的能耗,则对有价值的化工产品具有较高选择性[13⁃14]。水是自然界中最重要的溶剂,它来源广泛且无毒,最后甚至无需从产物中除去,可代替那些易挥发和有毒的溶剂作为反应介质,以减少对环境造成污染[15]。甲醇作为分解反应的介质,具有反应条件温和与分解反应相对完全等优点[16]。氨气是一种还原性气体,氨气的存在会促进高分子主链酯键中的酰氧键位置发生断裂形成端羟基的中间体[17]。因此,对PET废弃物进行水/醇/氨解被认为是回收和高效利用PET塑料的可行方案。
目前对于PET水/醇/氨解已有较多的相关实验研究[18⁃21]。Yoshioka 等[22]研究了 PET 固体颗粒在硝酸(HNO3)水溶液下于70~100 ℃反应温度的常温解聚情况,实验结果表明,PET固体颗粒的尺寸与表观速率成反比,反应活化能为 101.3 kJ/mol。Liu 等[23]研究了PET与正丁醇的醇解反应,结果表明,PET醇解反应生成了对苯二甲酸二丁酯与乙二醇等产物。杨华光等[24]通过金属功能化离子液体催化PET胺解反应的研究表明,PET氨解能够生成相应的对苯二甲酸二酰胺与乙二醇。姚浩余等[25]通过研究PET醇解协同催化体系的反应机理,获得了PET在氧化锌(ZnO)不同界面的作用机制及催化PET醇解的一级反应动力学,实验结果表明,其表观活化能为215.9 kJ/mol。
与实验研究相比,通过量子化学方法进行理论研究可以更加详细地诠释PET水/醇/氨解反应过程及产物形成演化机理。然而,从分子层面对PET进行水/醇/氨解反应机理的理论研究鲜有报道。PET塑料是由对苯二甲酸与乙二醇缩聚而成具有酯键的高分子聚合物,对高分子聚合物的微观机理通常采用各种模型化合物来研究,因此,本文采用密度泛函理论方法对二聚体的水/醇/氨解进行了理论研究,对水/醇/氨解可能反应路径进行了热力学计算与分析。从微观上深入地研究对苯二甲酸乙二醇酯二聚体水/醇/氨解机理,对PET废弃物的能源转化回收利用技术具有重要的理论指导意义。
所有计算均在Gaussian 09版程序中[26]完成,蒙含仙等[27]通过选取B3P86、M06⁃2X、B3LYP和BHandH⁃LYP等密度泛函方法对PET模型化合物键离能进行了理论计算研究,结果表明,B3P86和M06⁃2X方法比B3LYP和BHandHLYP方法计算PET模型化合物更加准确,且B3P86方法计算PET模型化合物键离能值总体上要低于M06⁃2X方法,最后选用B3P86密度泛函方法对PET模型化合物键离能以及PET热降解机理[28]进行了理论研究。因此本文采用密度泛函理论B3P86/6⁃31++G(d,p)方法对参与反应的反应物、过渡态、中间体以及产物进行频率分析和几何结构优化。在同一计算水平上进行频率计算以获得标况下(273.15 K、101 kPa)的热力学参数值。对热力学量考虑了零点振动能(ZPE)校正。通过GaussView程序直接观测或内禀反应坐标(IRC)计算进行验证,确定反应物、中间体和产物的振动频率均为正,过渡态有且只有一个虚频。把标况下的过渡态与反应物的焓值能量差作为反应活化能,生成物与反应物的焓值(自由能值)能量差作为反应焓变(自由能变)。对于自由基反应,键离能近似为活化能。键离能的计算公式如式(1)所示[29⁃30]:

式中 BDE——考虑零点能修正后的键离能,kJ/mol
E——分子能量,kJ/mol
EZP——零点能,kJ/mol
2.1 对苯二甲酸乙二醇酯二聚体水解机理
PET水解相关研究文献[31⁃33]表明PET水解主要通过主链酯键中酰氧键位置发生协同反应机理进行,因此本文主要对对苯二甲酸乙二醇酯二聚体主链酯键中酰氧键位置考虑了三条通过四元环过渡态进行的协同反应机理,并对对苯二甲酸乙二醇酯二聚体水解的可能反应路径进行设计以及热力学动力学计算与分析。对苯二甲酸乙二醇酯二聚体水解可能的反应路径、反应能垒及主链酯键中酰氧位置初始裂解过渡态优化结构分别如图1~3所示。
在反应路径(1)中(如图1所示),路径(1⁃a)中,化合物1和H2O经过四元环过渡态TS1生成对苯二甲酸2和化合物3,该过程需要克服169.2 kJ/mol的势垒,吸收5.2 kJ/mol较低的热量。TS1的优化结构如图3所示,反应前单独优化水分子中的O—H键长为0.960 Å,对苯二甲酸乙二醇酯二聚体中酰氧键(C(4)—O(5))键长为1.341 Å,反应中过渡态TS1的O—H键长变为1.178 Å,酰氧键(C(4)—O(5))键长变为1.747 Å,从TS1的优化结构中可以看出,水分子的羟基(—OH)结合羰基中的碳原子C(4)形成对苯二甲酸,而氢原子结合乙烷基上的O(5)形成羟基端的化合物。化合物3可通过TS2水解生成乙二醇4和对苯二甲酸乙二醇酯5,其反应能垒为170.7 kJ/mol。对苯二甲酸乙二醇酯进一步经TS3降解形成PET主要产物[31⁃32]对苯二甲酸和乙二醇4。路径(1⁃b)中,化合物1也可经过中间四元环过渡态TS4水解形成对苯二甲酸乙二醇酯,反应能垒为169.3 kJ/mol。路径(1⁃c)中,化合物1可经过TS5裂解形成乙二醇和化合物6,该反应能垒为170.2 kJ/mol,化合物6可进一步通过TS6发生水解反应生成对苯二甲酸和对苯二甲酸乙二醇酯,该反应能垒为169.1 kJ/mol。
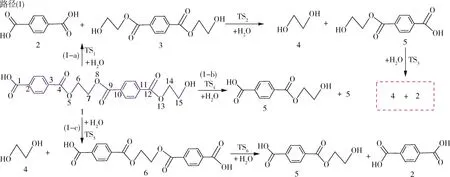
图1 对苯二甲酸乙二醇酯二聚体水解可能反应路径Fig.1 Possible reaction paths for ethylene terephthalate dimer hydrolysis

图3 对苯二甲酸乙二醇酯二聚体初始水解过渡态优化结构Fig.3 Initial hydrolysis transition state optimization structure of ethylene terephthalate dimer
对对苯二甲酸乙二醇酯二聚体水解反应路径的反应能垒进行对比分析可知,对苯二甲酸乙二醇酯二聚体主链中间和末端酯键中酰氧键位置水解的速控步反应能垒相差较小,分别为169.2、169.3、170.2 kJ/mol,这表明对苯二甲酸乙二醇酯二聚体水解反应可能是对苯二甲酸乙二醇酯二聚体主链随机位置酯键中酰氧键发生多次裂解,最终形成对苯二甲酸和乙二醇等主要产物,这与相关PET水解实验研究结果[32⁃35]相符。

图2 对苯二甲酸乙二醇酯二聚体水解反应能垒Fig.2 Energy barrier of ethylene terephthalate dimer hydrolysis reaction
2.2 对苯二甲酸乙二醇酯二聚体醇解机理
基于PET水解实验反应机理及相关醇解实验文献[36⁃40],本节对对苯二甲酸乙二醇酯二聚体醇解反应设计了3条可能的反应路径。图4~6分别描述了对苯二甲酸乙二醇酯二聚体醇解的可能反应路径和相应的反应能垒以及初始降解过渡态优化结构。
在反应路径(2)中(如图4所示),路径(2⁃a)中,化合物1和CH3OH经过四元环过渡态TS7生成对苯二甲酸单甲酯7和化合物3,该过程需要克服155.2 kJ/mol的势垒。TS7的优化结构如图6所示,反应前单独优化甲醇分子中的O—H键长为0.960 Å,对苯二甲酸乙二醇酯二聚体中酰氧键(C(4)—O(5))键长为1.341 Å,反应中过渡态TS7的O—H键长变为1.171 Å,酰氧键(C(4)—O(5))键长变为1.765 Å,从TS7的优化结构中能够看出,甲醇分子的甲氧(—OCH3)基结合羰基中的碳原子C(4)形成对苯二甲酸单甲酯,而氢原子结合乙烷基上的O(5)形成羟基端的化合物。化合物进一步通过TS8醇解生成乙二醇4和化合物8,反应能垒为156.9 kJ/mol。化合物8经TS9生成PET醇解主要产物乙二醇和对苯二甲酸二甲酯9,其过程需克服的势垒为156.9 kJ/mol。在路径(2⁃b)中,化合物1能够通过TS10生成化合物8和对苯二甲酸乙二醇酯5,对苯二甲酸乙二醇酯进一经TS11醇解形成对苯二甲酸单甲酯和乙二醇,上述过程的反应能垒分别为155.3、156.4 kJ/mol。在路径(2⁃c)中,化合物1和CH3OH通过TS12裂解形成乙二醇和化合物10,该过程的反应能垒为156.5 kJ/mol。化合物10既能通过TS13醇解生成对苯二甲酸单甲酯和化合物8,其反应能垒为155.3 kJ/mol。也能经TS14醇解生成对苯二甲酸二甲酯和对苯二甲酸乙二醇酯,该反应能垒为155.5 kJ/mol。
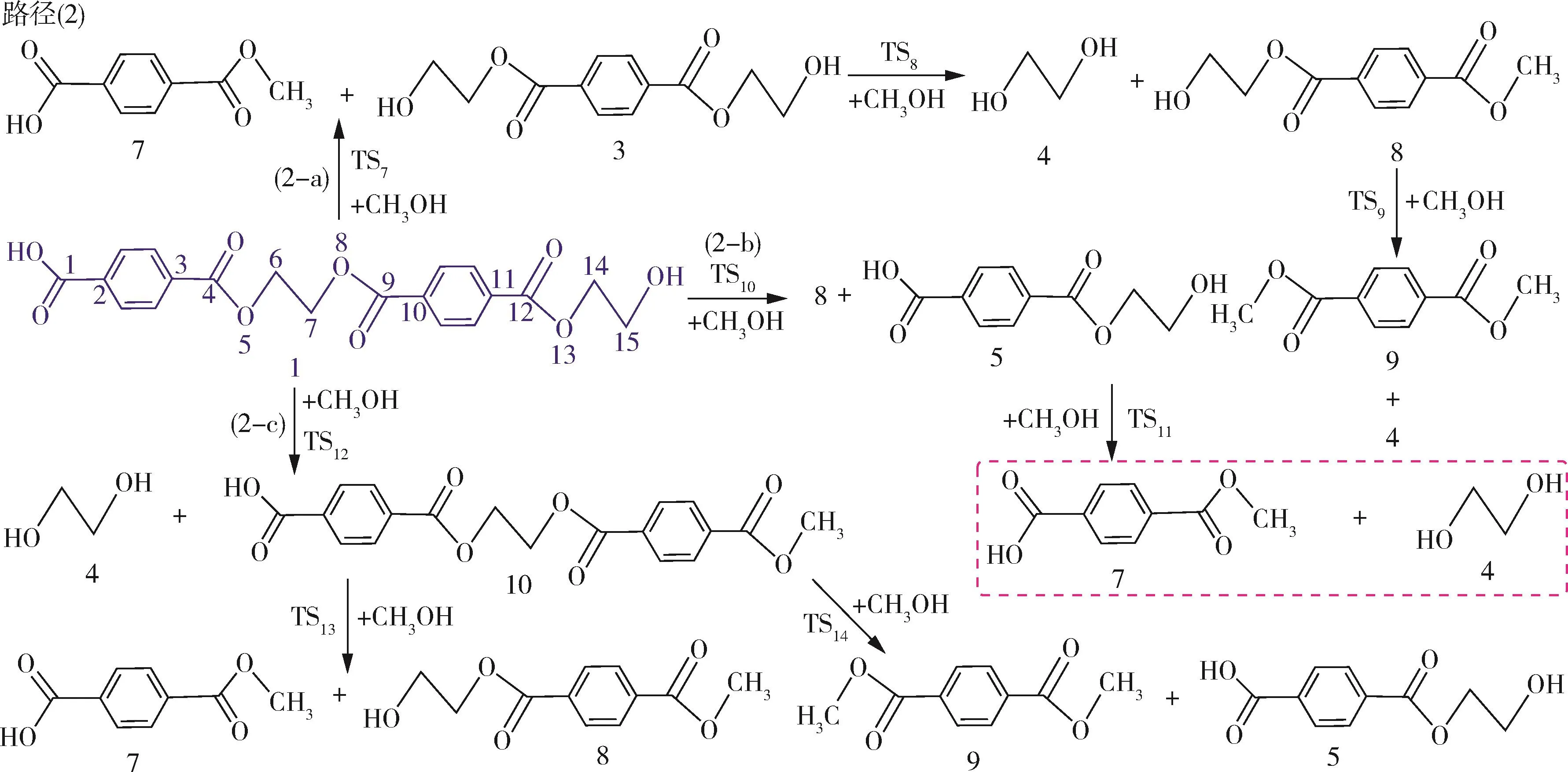
图4 对苯二甲酸乙二醇酯二聚体醇解可能反应路径Fig.4 Possible reaction paths for ethylene terephthalate dimer alcoholysis

图5 对苯二甲酸乙二醇酯二聚体醇解反应能垒Fig.5 The energy barrier of ethylene terephthalate dimer alcoholysis reaction

图6 对苯二甲酸乙二醇酯二聚体初始醇解过渡态优化结构Fig.6 Optimal structure of initial alcoholysis transition state of ethylene terephthalate dimer
对反应路径(2)的反应能垒进行对比分析可知,对苯二甲酸乙二醇酯二聚体主链中间和末端酯键中酰氧键位置醇解的速控步反应能垒分别为155.2、155.3、156.5 kJ/mol,这表明对苯二甲酸乙二醇酯二聚体醇解反应可能是对苯二甲酸乙二醇酯二聚体主链任意位置酯键中酰氧键发生多次醇解,最终形成对苯二甲酸二甲酯和乙二醇等主要产物,这与相关PET醇解实验研究结果[37⁃39]基本相符。
2.3 对苯二甲酸乙二醇酯二聚体氨解机理
根据PET在氨气气氛下的相关实验结果[41⁃42],设计了3条可能的对苯二甲酸乙二醇酯二聚体氨解可能的反应路径。图7描述了对苯二甲酸乙二醇酯二聚体氨解可能的反应路径,图8描绘了对苯二甲酸乙二醇酯二聚体氨解过程的反应能垒示意图,图9为对苯二甲酸乙二醇酯二聚体主链酯键中酰氧键位置初始氨解过渡态的优化结构。
在反应路径(3)中(如图7所示),对化合物1降解过程设计了3条路径,在(3⁃a)中,对苯二甲酸乙二醇酯二聚体化合物1经TS15氨解生成对苯二甲酸单酰胺11和化合物13,其过程需克服151.3 kJ/mol的势垒。TS15的优化结构如图9所示,反应前单独优化氨气分子中的N—H键长为1.000 Å,对苯二甲酸乙二醇酯二聚体中酰氧键(C(4)⁃O(5))键长为1.341 Å,反应中TS15的N—H键长变为1.136 Å,酰氧键(C(4)—O(5))键长变为1.902 Å,从TS15的优化结构中能够看出,氨基(—NH2)结合羰基中的碳原子C(4)形成对苯二甲酸单酰胺,而氢原子结合乙烷基上的O(5)形成羟基端的化合物。对苯二甲酸单酰胺经两次氨基中的氢原子转移通过TS16和TS17裂解生成水和对氰基苯甲酸13,其反应能垒分别为167.8 kJ/mol和241.2 kJ/mol。化合物3和NH3通过TS18降解生成乙二醇和化合物14,其过程反应能垒为156.9 kJ/mol。化合物14进一步经TS19氨解生成乙二醇和对苯二甲酰胺15,反应能垒为156.9 kJ/mol。对苯二甲酰胺能经两次氨基中的氢原子转移通过TS20和TS21生成水和化合物17,反应能垒分别为167.0 kJ/mol和240.3 kJ/mol。同理,化合物17经两次氢原子转移通过TS22和TS23生成水和对苯二甲氰19,其过程反应能垒分别为168.4 kJ/mol和244.4 kJ/mol。在(3⁃b)中,化合物1和NH3通过TS24降解生成化合物14和对苯二甲酸乙二醇酯5,该过程需克服151.2 kJ/mol的势垒。对苯二甲酸乙二醇酯进一步经TS25氨解生成乙二醇和对苯二甲酸单酰胺,反应能垒为156.6 kJ/mol。在(3⁃c)中,化合物1和NH3通过TS26降解生成乙二醇和化合物20,该反应能垒为156.6 kJ/mol。化合物20既能经TS27氨解生成对苯二甲酸单酰胺和化合物14,也能通过TS28生成对苯二甲酰胺和对苯二甲酸乙二醇酯,上述两个过程的反应能垒分别为151.2 kJ/mol和151.2 kJ/mol。

图7 对苯二甲酸乙二醇酯二聚体氨解可能反应路径Fig.7 Possible reaction paths for ammonolysis of ethylene terephthalate dimer

图8 对苯二甲酸乙二醇酯二聚体氨解反应能垒Fig.8 Ammonolysis reaction barrier of ethylene terephthalate dimer

图9 对苯二甲酸乙二醇酯二聚体初始氨解过渡态优化结构Fig.9 Optimization of transition state for initial ammonolysis of ethylene terephthalate dimer
对苯二甲酸乙二醇酯二聚体氨解反应路径的热力学与动力学分析表明:对苯二甲酸乙二醇酯二聚体主链中间和末端酯键中酰氧键位置醇解的速控步反应能垒分别为151.3、151.2、156.6 kJ/mol,这表明对苯二甲酸乙二醇酯二聚体氨解反应可能是主链任意位置酯键中酰氧键发生多次降解,最终形成对苯二甲酰胺和乙二醇等主要产物,这与相关PET氨解实验研究结果[42⁃43]基本相同。
通过对比对苯二甲酸乙二醇酯二聚体水/醇/氨解反应的热力学与动力学计算结果可知:对苯二甲酸乙二醇酯二聚体主链酯键中酰氧键位置水/醇/氨解的速控步能垒分别约为169.0、155.0、153.0 kJ/mol,均要低于对苯二甲酸乙二醇酯二聚体热解的速控步能垒(通过六元环、四元环过渡态发生的协同反应和自由基反应的能垒分别为184.0、267.0、345.0 kJ/mol)[29],由此可知,水/醇/氨解在一定程度上能降低对苯二甲酸乙二醇酯二聚体降解主要基元反应步的反应能垒,使反应更易于进行,且计算数据表明,对苯二甲酸乙二醇酯二聚体在氨气气氛中的裂解速控步能垒的最小,其次是在醇介质和水中的裂解。
2.4 温度对对苯二甲酸乙二醇酯二聚体水/醇/氨解机理的影响
根据相关 PET 热解相关文献[29,44⁃45]可知:温度对PET水/醇/氨解机理动力学(活化能)的影响不大,因此本文仅考虑温度对对苯二甲酸乙二醇酯二聚体水/醇/氨解机理热力学的影响。
从热力学的角度去研究一个反应,只需考虑这个反应的始终两态即可,而不用考虑它的中间过程[44]。故为了更加深入了解温度对PET水/醇/氨解机理热力学的影响,本节计算了对苯二甲酸乙二醇酯二聚体降解过程在不同温度条件下(298、400、500、600、700、800、900 K)的反应自由能和焓变参数,反应自由能ΔG是判断反应自发方向以及反应达到平衡时反应物转化率大小的热力学参数,当ΔG<0时,反应可自发进行,反应ΔG越小,反应达到平衡时,反应物的转化率越大[45]。从反应能量的角度考虑时,ΔH>0表示是吸热反应,反之是放热反应[46]。表1为对苯二甲酸乙二醇酯二聚体模化物水/醇/氨解过程中不同温度下降解过程的焓变(ΔH)、自由能变(ΔG)和熵变值(ΔS),图10为对苯二甲酸乙二醇酯二聚体模化物/醇/氨解过程中降解过程的焓变、自由能变和熵变与温度的相互关系。
在设定温度范围内,从表1数据可知,PET水解反应中,ΔH和ΔS恒大于零,ΔG当温度在298~400 K时ΔG>0,在温度500 K及以上时ΔG<0,故推测当温度在500 K时,PET水解反应能够自发进行,属于吸热反应,升高温度能够增加PET水解的自发性。而在PET醇解反应中,ΔH和ΔG恒小于零,ΔS大于零,故推测PET醇解可能属于热力学自发的放热反应。在对PET氨解过程中发现,ΔH和ΔS恒大于零,ΔG在温度400 K及以上时ΔG<0,故推测当温度在400 K时,PET氨解反应能够自发进行,属于吸热反应,且反应温度升高能够提高PET氨解的自发性。

表1 对苯二甲酸乙二醇酯二聚体在不同温度下水/醇/氨解过程的ΔH/ΔG/ΔSTab.1 ΔH/ΔG/ΔS of ethylene terephthalate dimer during hydrolysis/alcoholysis/ammonolysis processes at different temperature
综上所述,温度对对苯二甲酸乙二醇酯二聚体水/醇/氨解过程的ΔH影响较小,ΔS均为正值,随着温度升高,所有路径的吉布斯自由能ΔG均呈下降的趋势[如图10(a)所示],ΔG值越来越小,说明在PET水/醇/氨解反应过程中,升高温度能够增加其反应的自发性。
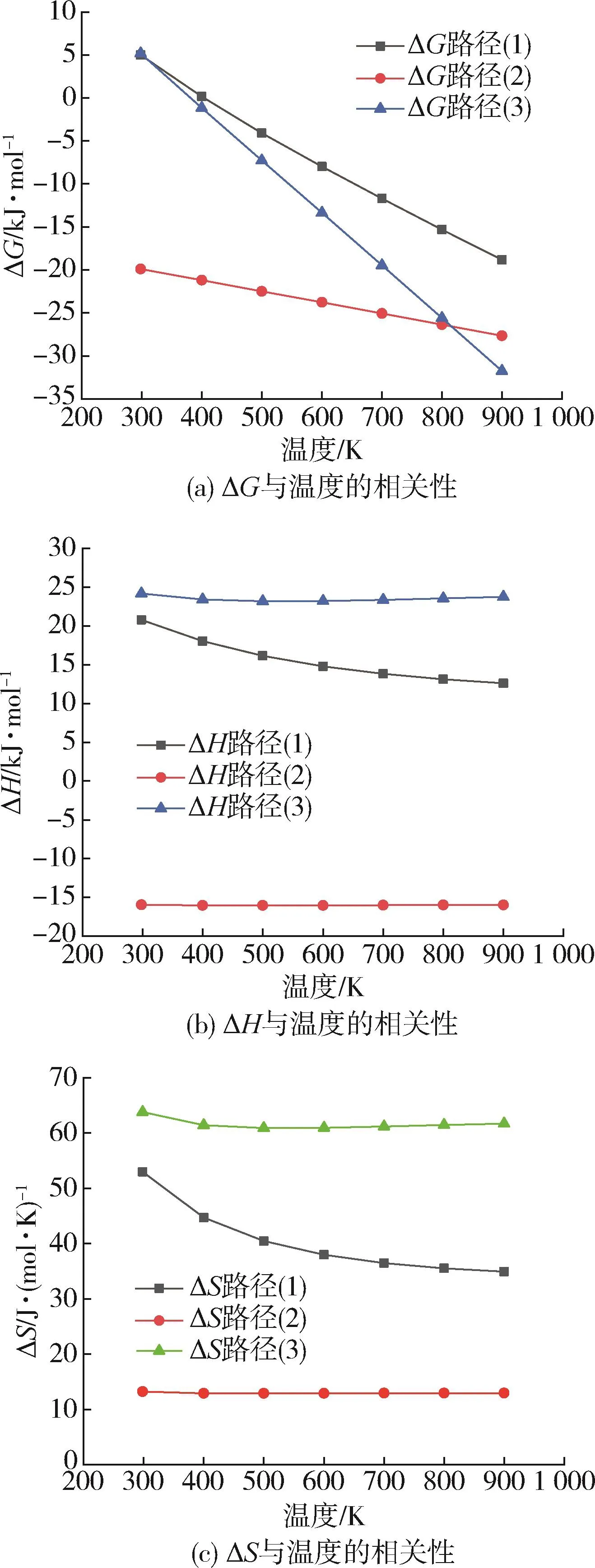
图10 对苯二甲酸乙二醇酯二聚体水/醇/氨解的ΔH、ΔG、ΔS与温度的相关性Fig.10 Relationship between ΔH,ΔG and ΔS in hydrolysis/alcoholysis/ammonolysis processes of ethylene terephthalate dimer and temperature
(1)采用密度泛函理论B3P86/6⁃31++G(d,p)方法对对苯二甲酸乙二醇酯二聚体的可能水/醇/氨解路径进行了理论研究,通过对比分析了对苯二甲酸乙二醇酯二聚体水/醇/氨解反应路径的热力学与动力学参数;
(2)对苯二甲酸乙二醇酯二聚体水解主要产物为对苯二甲酸和乙二醇;
醇解主要产物为对苯二甲酸二甲酯和乙二醇;
氨解主要产物为对苯二甲酰胺和乙二醇;
(3)对苯二甲酸乙二醇酯二聚体主链酯键中的酰氧键位置的水/醇/氨解过程中,升高温度,ΔH变化较小,ΔG越来越小,因此在PET水/醇/氨解反应过程中,反应温度的升高能够增加其反应的自发性;
(4)与纯热解相比,水/醇/氨解能够降低对苯二甲酸乙二醇酯二聚体降解过程中主要基元反应步的反应能垒[路径(1)约为169.0 kJ/mol、路径(2)约为155.0 kJ/mol、路径(3)约为153.0 kJ/mol],使反应更易于进行,且对苯二甲酸乙二醇酯二聚体主链中间和末端酯键中的酰氧键发生水/醇/氨解的速控步能垒相差较小,因此PET水/醇/氨解可能是主链随机位置酯键中的酰氧键进行的裂解反应。
猜你喜欢 主链能垒对苯二甲 四氯对苯二甲腈含量分析方法商品与质量(2021年43期)2022-01-18化学反应历程教学的再思考中学课程辅导·教学研究(2021年8期)2021-07-14苄胺在超临界水中脱氮机理的量子化学计算化学工业与工程(2021年3期)2021-06-25重质有机资源热解过程中自由基诱导反应的密度泛函理论研究燃料化学学报(2021年5期)2021-06-02WDC主链正式启动创世区块已诞生中国计算机报(2019年26期)2019-08-27电感耦合等离子发射光谱法快速测定对苯二甲酰氯中氯化亚砜残留量分析化学(2019年3期)2019-03-30有机化合物命名易错题直击中学生数理化·高二版(2017年2期)2017-04-19“烷烃”的五字命名方针中学化学(2016年12期)2017-02-05次磷酸铝与锡酸锌协效阻燃聚对苯二甲酸丁二醇酯的研究中国塑料(2016年5期)2016-04-16扩链剂对聚对苯二甲酸乙二醇酯流变性能和发泡性能影响中国塑料(2015年5期)2015-10-14本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0903/648949.html




