【www.zhangdahai.com--其他范文】
张艳艳孙丽丽潘绵立王松坡沈龙海*
(1.中国医药工业研究总院上海医药工业研究院创新药物与制药工艺国家重点实验室,上海 200437;
2.上海市生物物质成药性评价专业技术服务中心,上海 200437;
3.上海交通大学附属第一人民医院,上海 200437)
益神颗粒是国医大师、沪上张氏内科第12 代传人张镜人教授的经验方,为上海市第一人民医院院内制剂,用于肿瘤切除术后的辅助治疗。该方中灵芝具有补虚安神之功,用于一切虚劳诸疾;
黄精补脾润肺,用于脾肺不足所致纳差、气短、体倦乏力等,二者相合,灵芝益神而养精气、黄精补中而安五脏,共为君药。黄芪补气升阳、固表内托,为臣药。当归养血补血、补中有行。何首乌,补肝肾益精血。以上5 味相伍,可先后天同调,气血共补,有良好的扶正之效。
现代药理学研究证明,灵芝、黄精和黄芪等均可通过影响固有免疫、特异性免疫或肠道菌群等来调节免疫系统[1-4]。本研究拟通过建立环磷酰胺(CTX)诱导小鼠免疫异常模型,探究益神颗粒对小鼠免疫功能和肠道菌群等方面的调节作用。
1.1 实验动物 32 只SPF 级雄性BALB/c 小鼠,体质量(20±2)g,购自浙江维通利华实验动物技术有限公司,实验动物生产许可证号SCXK(沪)2018-0006,动物实验经伦理审查通过(编号2021f097),饲养于上海药理评价中心动物房内,温度(25±1)℃,相对湿度50%~70%,12 h/12 h 交替照明,给予颗粒饲料,自由饮水。
1.2 试剂与药物 环磷酰胺(CTX,美国百特国际有限公司,批号9J339A);
益神颗粒(由上海市第一人民医院中医科提供,批号20210401)。CCK-8、胰蛋白酶、红细胞裂解液(武汉谷歌生物科技有限公司,批号FZ193503、HP203411、HJ202408);
胎牛血清(美国Gibco 公司,批号205946RP);
1640 培养液(以色列Biological Industries公司,批号2051244);
刀豆蛋白A(美国Simga 公司,批号P1659069);
小鼠淋巴细胞分离液(上海达科为生物技术有限公司,批号RLS2101);
FITC-CD3、APC-CD4、PECD8、PC5.5-CD4、APC-IFN-γ 抗体、Cyto-FastTMFix/Perm Buffer Set(美国Biolegend 公司,批号B303301、B295393、B311090、B318293、B335090、B335927)。
1.3 仪器 电子天平(德国赛多利斯公司,型号ALC-210.3);
超净工作台(苏州净化设备有限公司,型号SWCJ-2FD);
二氧化碳培养箱、冷冻离心机、全波长多功能酶标仪(美国Thermo 公司,型号371、Micro2R、Varioskan Flash);
低速离心机(湖南湘仪实验室仪器开发有限公司,型号TDZ5-WS);
流式细胞仪(美国Beckman Coulter 公司,型号CytoFLEX);
细胞计数仪(美国DeNovix 公司,型号Celldrop I)。
2.1 造模及给药 小鼠适应性饲养5 d,按体质量随机分为正常组、模型组和益神颗粒低、高剂量组,每组8 只,益神颗粒低、高剂量组灌胃给予2.5、5.0 g/kg 益神颗粒,正常组和模型组灌胃给予等量生理盐水,连续15 d,于给药后第8~10 天,模型组和益神颗粒组小鼠腹腔注射80 mg/kg CTX进行造模,实验结束后对各项指标进行检测。
2.2 体质量和脏器指数检测 给药期间,各组小鼠每3 d测定1 次体质量,绘制体质量变化曲线。给药结束后,断颈处死各组小鼠,分离脾脏和胸腺并称定质量,计算脏器指数。
2.3 外周血白细胞和骨髓有核细胞计数 给药结束后,各组小鼠眼眶取血,肝素钠抗凝,利用全自动血液分析仪进行外周血白细胞(WBC)计数。同时,各组小鼠取右侧股骨,用10 mL 3%醋酸液冲洗骨髓内细胞,制成细胞悬液,细胞计数仪计数骨髓有核细胞(BMNC)。
2.4 脾淋巴细胞增殖检测 无菌条件下取出小鼠脾脏,置于生理盐水培养皿中,剪碎后过200 目尼龙筛网,收集脾细胞悬液,1 000 r/min 离心,弃上清获得细胞沉淀,按照1∶5 的比例加入红细胞裂解液,吹打均匀,冰上静置5 min,1 000 r/min 离心后弃上清,用含10% 胎牛血清的1640 培养基重悬细胞,置于37 ℃、5% CO2培养箱中培养3 h,收集悬浮细胞,离心后重悬制备密度为5×106/mL 的淋巴细胞悬液,取200 μL 淋巴细胞悬液,加入1 μL 刀豆蛋白A(ConA,终质量浓度为5 μg/mL),混合后加入到96 孔板中,每孔100 μL,置于37 ℃、5% CO2培养箱中培养24 h,培养结束后每孔加入10 μL CCK-8 试剂,2 h 后用酶标仪于450 nm 波长处测定光密度(OD)值,以OD值表示增殖能力。
2.5 流式细胞仪检测脾脏T 淋巴细胞亚群
2.5.1 CD3+T、CD4+T、CD8+T 细胞亚群检测 将“2.4”项下制备的脾淋巴细胞制成密度为1×107/mL 的细胞悬液,取100 μL 单细胞悬液,分别加入CD3、CD4、CD8a 抗体,混匀后于冰上避光孵育20 min,加入1 mL Cell Staining Buffer 洗涤2 次,100 μL Cell Staining Buffer 重悬后上机检测。另设4 个对照组,分别为空白对照(不加抗体)、CD3对照(只加CD3 抗体)、CD4 对照(只加CD4 抗体)、CD8对照(只加CD8a 抗体),其余操作步骤同上。
2.5.2 Th1 细胞亚群检测 将“2.4” 项下制备的脾淋巴细胞制成密度为1×106/mL 的细胞悬液,加入适量的Cell Activation Cocktail(含Brefeldin A)刺激6 h,收集细胞悬液,离心,重悬后调整细胞密度为1×107/mL,取100 μL单细胞悬液,加入CD4 抗体,混匀后于冰上避光孵育20 min,加入1 mL Cell Staining Buffer 洗涤2 次,加入150 μL Cyto-FastTMFix/Perm Buffer,混匀后室温孵育20 min,1 mL Cyto-FastTMPerm Wash solution 洗涤2 次,加入IFN-γ 抗体,混匀后室温孵育20 min,加入1 mL Cell Staining Buffer 洗涤2 次,200 μL Cell Staining Buffer 重悬,上机检测。另设3个对照组,分别为空白对照(不加抗体)、CD4 对照组(只加CD4 抗体)和IFN-γ 对照组(只加IFN-γ),其余操作步骤同上。
2.6 外周血T 淋巴细胞亚群检测 眼眶采血获得小鼠新鲜外周血,肝素钠抗凝,用无菌PBS 稀释1 倍,向15 mL 离心管中加入3 mL 小鼠淋巴细胞分离液,将稀释后的血液平铺在淋巴细胞分离液上层(缓慢加入,避免破坏两液体的分界面),800×g离心20 min,取白膜层即得外周血淋巴细胞,重悬计数,调整细胞密度为1×107/mL,后续步骤同“2.5.1” 项。
2.7 肠道菌群多样性分析 给药结束后,每组各选取5 只小鼠取新鲜粪便,样品置于无菌EP 管中,-80 ℃保存。所有样品送至上海美吉生物医药科技有限公司进行测序工作,随后在美吉生物在线云平台上进行数据处理与分析,比对数据库为Silva(Release138 http:/ /www.arb-silva.de),α多样性指数组间差异检验采用Wilcoxon rank-sum test,物种差异分析采用Kruskal-Wallis 秩和检验。
2.8 统计学分析 数据以(±s)表示,组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
3.1 益神颗粒对免疫抑制小鼠体质量和脏器指数的影响如图1 所示,给药期间,正常组小鼠体质量保持稳定增长,活动度良好;
模型组小鼠注射CTX 后体质量下降,毛色暗淡,活动度降低;
与模型组比较,益神颗粒各剂量组小鼠体质量下降减缓,说明益神颗粒能够恢复小鼠体质量,改善小鼠活动度,提高生存质量。如图2 所示,与正常组比较,模型组小鼠脾脏和胸腺指数降低(P<0.01),说明模型复制成功;
与模型组比较,益神颗粒各剂量组小鼠的脾脏指数升高(P<0.01),说明益神颗粒对CTX 造成的脏器损伤有改善作用。
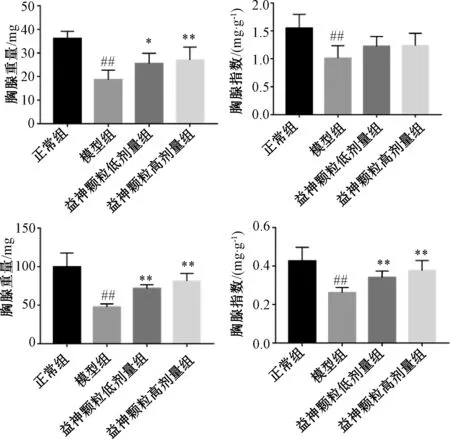
图2 各组小鼠脏器指数变化(±s, n=8)
3.2 益神颗粒对免疫抑制小鼠WBC 和BMNC 计数的影响 如表1 所示,与正常组比较,模型组小鼠WBC 和BMNC 数量减少(P<0.01);
与模型组比较,益神颗粒各剂量组小鼠WBC 和BMNC 数量增加(P<0.01),说明益神颗粒能够减轻CTX 对骨髓的破坏,增加WBC 和BMNC 数量。
表1 各组小鼠WBC 和BMNC 计数比较(±s, n=8)

表1 各组小鼠WBC 和BMNC 计数比较(±s, n=8)
注:与正常组比较,##P<0.01;
与模型组比较,**P<0.01。
3.3 益神颗粒对免疫抑制小鼠脾淋巴细胞增殖的影响 如表2 所示,与正常组比较,模型组小鼠脾淋巴细胞增殖能力降低(P<0.01);
与模型组比较,益神颗粒各剂量组小鼠脾淋巴细胞增殖能力增加(P<0.05),说明益神颗粒可提高淋巴细胞增殖能力。
表2 各组小鼠脾淋巴细胞增殖能力比较(±s, n=8)

表2 各组小鼠脾淋巴细胞增殖能力比较(±s, n=8)
注:与正常组比较,##P<0.01;
与模型组比较,*P<0.05。
3.4 益神颗粒对免疫抑制小鼠脾脏T 淋巴细胞亚群的影响 如图3A 所示,与正常组比较,模型组CD3+T、CD4+T细胞亚群比例和CD4+/CD8+比值上升(P<0.01),CD8+T细胞亚群比例降低(P<0.01);
与模型组比较,益神颗粒各剂量组CD3+T、CD4+T 细胞亚群比例和CD4+/CD8+比值降低(P<0.01),CD8+T 细胞亚群比例上升(P<0.01)。对脾脏Th1 细胞亚群分析,结果如图3B 所示,与正常组比较,模型组Th1 比例上升(P<0.01);
与模型组比较,益神颗粒各剂量组Th1 比例下降(P<0.01),典型流式图见图3C。

图3 各组小鼠脾脏T 淋巴细胞亚群变化(±s, n=8)
3.5 益神颗粒对免疫抑制小鼠外周血T 淋巴细胞亚群的影响 如图4A 所示,与正常组比较,模型组CD3+T、CD4+T细胞亚群比例和CD4+/CD8+比值上升(P<0.01),CD8+T细胞亚群比例降低(P<0.01);
与模型组比较,益神颗粒高剂量组CD3+T、CD4+T 细胞亚群比例和CD4+/CD8+比值降低(P<0.01),CD8+T 细胞亚群比例上升(P<0.01),典型流式图见图4B。

图4 各组小鼠外周血淋巴细胞亚群变化(±s, n=8)
3.6 益神颗粒对免疫抑制小鼠肠道菌群的影响
3.6.1 多样性分析 α 多样性指数可评估肠道菌群的多样性和丰富度,本研究以Shannon 和Ace 指数为标准,进行差异分析。如图5A~5B 所示,各组之间Shannon 和Ace 指数无明显变化(P>0.05),提示短期使用CTX 对小鼠肠道菌群的多样性和丰度无影响。β 多样性利用各样本序列间的进化关系及丰度信息来计算样本间距离,反映样本(组)间是否具有显著的微生物群落差异。如图5C 所示,模型组肠道菌群与正常组存在差异(P>0.05),说明CTX 可引起小鼠肠道菌群物种组成发生变化;
益神颗粒低剂量干预后,免疫抑制小鼠肠道菌群趋向正常组。

图5 肠道菌群多样性分析(±s, n=5)
3.6.2 物种组成分析 如图6A 所示,门水平上Bacteroidota和Firmicutes是小鼠肠道菌群的主要组成部分,占菌群总数的90% 以 上,其次是Campilobacterota和Patescibacteria等。采用Kruskal-Wallis 秩和检验分析组间物种组成差异,结果见图6B,将相对丰度排名前4 的细菌展开分析,如图6C~6F 所示,与正常组比较,模型组Bacteroidota相对丰度降低(P<0.05);
与模型组比较,益神颗粒各剂量组Bacteroidota相对丰度增加(P<0.05,P<0.01)。Firmicutes/Bacteroidota(F/B)比值被用来评估肠道菌群的平衡,CTX 使得F/B 值增大,引起肠道菌群异常,而益神颗粒可在一定程度上逆转该趋势。
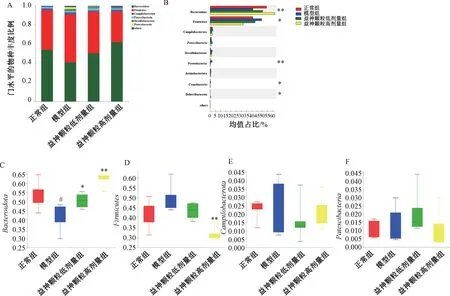
图6 门水平上的物种组成和差异分析(±s, n=5)
如图7A 所示,在属水平上norank_f_Muribaculaceae和Lactobacillus为优势菌属,在正常小鼠肠道菌群中占50%以上。采用Kruskal-Wallis 秩和检验分析组间物种组成差异,结果见图7B,将相对丰度排名前4 的菌属展开分析,如图7C~7F 所 示,与正常组比较,模型组norank_f_Muribaculaceae和Lactobacillus相对丰度降低(P<0.01),Lachnospiraceae_NK4A136_group相对丰度升高(P<0.05);
与模型组比较,益神颗粒各剂量组norank_f_Muribaculaceae相对丰度升高(P<0.05,P<0.01),低剂量组Lactobacillus相对丰度升高(P<0.01)。

图7 属水平上的物种组成和差异分析(±s, n=5)
本研究从脏器指数、T 细胞亚群和肠道菌群3 个方面探究益神颗粒的药效作用。CTX 作为烷基化抗癌药物,杀伤肿瘤细胞的同时也会损伤宿主的免疫器官和免疫细胞[5-7]。本研究表明,益神颗粒在一定程度上保护免疫器官,增加WBC 和BMNC 数目,提高淋巴细胞增殖能力。T细胞亚群分析结果显示,CTX 处理后,小鼠体内CD3+T、CD4+T、CD8+T 以及Th1 比例上升,与文献报道基本一致[8-10];
益神颗粒干预后,上述指标向正常组偏移,说明益神颗粒能在一定程度上调节CTX 导致的T 细胞亚群比例失调。其中Th1 比例升高可能与以下2 点有关,一是CTX破环免疫抑制性T 细胞[8,11],促进Th1 的分化;
二是CTX破坏肠道内环境平衡,导致黏膜通透性增加,细菌或其成分(LPS)易位[12]。
益神颗粒作为由灵芝、黄芪、黄精、当归和何首乌组成的中药复方制剂,富含多糖成分。植物多糖作为肠道微生态调节剂,具有调节肠道菌群比例,促进肠黏膜修复,增强肠黏膜分泌型免疫球蛋白表达及调节细胞因子水平等作用[10,13-15]。采用16S rRNA 测序技术,对小鼠的肠道菌群进行分析,结果显示,益神颗粒能够在一定程度上恢复CTX 造成的菌群组成失调。门水平上,益神颗粒能够恢复优势菌群Bacteroidota相对丰度,Bacteroidota作为有益菌[15],能够促进肠道淋巴组织的发育,其代谢产物对激活T 细胞依赖的免疫反应至关重要[16]。属水平上,益神颗粒部分恢复了norank_f_Muribaculaceae和Lactobacillus菌属比例,norank_f_Muribaculaceae为新确立的菌属名,属于Bacteroidota,其具体功能尚无深入研究[17];
Lactobacillus也是有益菌[18],能够通过固有免疫和适应性免疫调节宿主免疫,与肠道健康密切相关[19-20]。此外,肠道菌群与消化吸收有关,能够为宿主提供能量,益神颗粒对肠道菌群的正向调节作用在增强宿主营养摄入方面也有重要作用。
综上所述,益神颗粒能够改善CTX 诱导的小鼠免疫功能异常,恢复T 细胞水平。另外,益神颗粒能够调节肠道菌群,使CTX 处理后的小鼠菌群趋于正常,这对于小鼠免疫水平和营养吸收都有重要作用。本研究尚未对肠道菌群与宿主免疫水平的具体相关性进行研究,仅初步摸索了益神颗粒在T 细胞和肠道菌群等方面的调节作用,还需进行更深一步的研究。
猜你喜欢悬液亚群菌群“云雀”还是“猫头鹰”可能取决于肠道菌群中老年保健(2022年2期)2022-08-24甲状腺切除术后T淋巴细胞亚群的变化与术后感染的相关性中国医药科学(2022年5期)2022-05-05“水土不服”和肠道菌群科学(2020年4期)2020-11-26磺胺嘧啶银混悬液在二度烧伤创面治疗中的应用武警医学(2018年10期)2018-11-06薯蓣皂苷元纳米混悬液的制备中成药(2017年9期)2017-12-19外周血T细胞亚群检测在恶性肿瘤中的价值中国卫生标准管理(2015年3期)2016-01-14肉牛剩余采食量与瘤胃微生物菌群关系动物营养学报(2015年10期)2015-12-01雾化吸入布地奈德混悬液治疗COPD急性加重期的效果观察中国当代医药(2015年20期)2015-03-01咽部菌群在呼吸道感染治疗中的临床应用现代检验医学杂志(2015年4期)2015-02-06疣状胃炎与T淋巴细胞亚群的相关研究进展安徽医药(2014年4期)2014-03-20本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0916/655218.html




