【www.zhangdahai.com--毕业生自我鉴定】
孙卓 王妍 韩忠明 王云贺 赵淑杰 杨利民
(吉林农业大学中药材学院 省部共建生态恢复与生态系统管理国家重点实验室,长春 130118)
尖孢镰刀菌(Fusarium oxysporum)和木贼镰刀菌(F.equiseti)隶属于镰刀菌属(Fusarium),均为世界性分布、危害性较大的土传病原真菌,其拥有广泛的寄生宿主,可引起农业类、设施园艺类、药用植物类等百余种作物病害的发生[1-2]。防风(Saposhnikovia divaricata(Turcz.)Schisck.)作为我国重要的药用植物资源之一,主要分布于中国东北、河北等地区[3],由于地理环境原因,易受尖孢镰刀菌及木贼镰刀菌的越冬孢子侵染而诱发防风枯萎病、根腐病,年发病率15%-20%以上,严重影响防风药源的产量及品质[4]。利用化学途径可有效防控植物真菌性病害,且以化学农药为主导仍是目前植物病害的主要防控策略,但其引发的环境污染、抗药性增强等问题日趋凸显。利用益生微生物防控植物病害具有作用良好、生态安全性高及经济效益显著等优点,符合绿色、安全的植物保护理念,是目前降低化学农药使用、提高农业生产可持续性的一种理想替代手段[5],而挖掘具有生防潜质的微生物资源也成为了目前植物保护领域的重要研究方向[6]。
植物根际是植物根系与土壤进行物质交流的重要区域,植物体在生长发育过程中向土壤中释放的根系分泌物对土壤微生物具有富集趋化作用[7]。相较于植物非根际区域,根际土壤中微生物的相对丰度及多样性更高,而活跃于植物根系表面及根际土壤的有益微生物通过活化土壤养分,调控植物土壤微生态等机制,显著影响植物生长发育和质量形成,最终实现对植物体生长的正向促进作用[8]。此外,根际有益微生物可通过空间和营养竞争、重寄生作用、拮抗作用以及诱导植物抗病性等方式,抑制植物病原微生物的生长[9]。因此,利用植物根际有益微生物防控植物真菌性病害的研究备受科研工作者的关注[10-11]。杨茉等[12]从辣椒根际土壤中分离筛选获得5 株对立枯丝核菌(Rhizoctonia solani)、尖孢镰刀菌(F.oxysporum)、辣椒疫霉菌(Phytophthora capsiciLeonian)及辣椒炭疽菌(Colletotrichum capsicibulterg)具有生防潜力的植物根际促生菌。Khalil等[13]研究证实,筛选自植物根际的醋酸钙不动杆菌(Acinetobacter calcoaceticus)、暹罗芽胞杆菌(Bacillus siamensis),可通过产生铁载体、生物膜、蛋白酶、内切葡聚糖酶和吲哚乙酸等,实现对番茄枯萎病的防控作用及对番茄植株的促生作用。Silva等[14]研究发现,根际真菌哈茨木霉(Trichoderma harzianum)ESALQ-1306 和棘孢木霉(T.asperellum)BRM-29104 可通过调控内生菌群多样性,改变大豆内生菌群的群落组成,协助大豆抵御核盘菌侵染,有效降低大豆菌核病造成的作物减产。此外,枯草芽孢杆菌(B.subtilis)[15]、哈茨木霉[16]等作为优质的生防菌源均已被开发为生物制剂,广泛应用于作物病害田间管理。但有关防风枯萎病、根腐病等真菌性病害的生物防控研究国内外鲜有报道。
为发掘防风根际土壤中的有益微生物资源,获取对防风枯萎病、根腐病具有较好抑菌作用的生防菌源,本研究以防风健康根际土壤为研究对象,从中分离纯化筛选获得1 株对尖孢镰刀菌、木贼镰刀菌均具有显著抑菌活性的拮抗真菌MR-43,基于形态学观察,结合ITS 基因序列分析确立其分类学地位。通过室外盆栽试验方法对拮抗真菌MR-43 的土壤定殖能力、防病效果及植物促生效果进行系统评价,以期为防风枯萎病、根腐病等真菌性病害生物制剂的开发提供优质生防菌源,为药用植物病害的生物防控研究提供理论依据。
1.1 材料
1.1.1 土样采集 2020年6月于吉林省长春市吉林农业大学防风栽培实验田(43°48"24″N、125°24"59″E,海拔251 m),以五点采样法结合抖落法,采集健康防风植株根际土壤(距离主根及须根根轴表面0-3 mm 土壤),收集土样经均匀混合后置于无菌自封袋内并编号为MR,4℃保存、备用。
1.1.2 供试病原真菌 尖孢镰刀菌(F.oxysporum)Fox201、木贼镰刀菌(F.equiseti)Feq112 分别为防风枯萎病、根腐病致病菌,均由吉林农业大学植物病理研究室提供。
1.1.3 供试培养基 马铃薯葡萄糖琼脂(potato dextrose agar,PDA):去皮马铃薯200 g,葡萄糖20.0 g,琼脂17.0 g,去离子水1 000 mL。马铃薯葡萄糖水(potato dextrose broth,PDB):去皮马铃薯200.0 g,葡萄糖20.0 g,去离子水1 000 mL。
1.1.4 供试试剂 代森锰锌可湿性粉剂(70% W/W,mancozeb,WP),四川润尔科技有限公司;
多菌灵可湿性粉剂(50% W/W,carbendazim,WP),江苏丰山集团股份有限公司;
哈茨木霉T-22(有效活菌数50 亿/g),山东绿陇生物科技有限公司;
枯草芽孢杆菌BSn5(有效活菌数200 亿/g),山东奥丰生物科技有限责任公司;
利福平(≥97% W/W,rifampicin,Reagent grade),上海麦克林生化科技有限公司;
DNA Marker 和 PCR 扩增试剂盒,日本TaKaRa 公司;
PCR 产物纯化试剂盒及ITS 合成引物,生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 根际真菌的分离、纯化及保存 于无菌条件下,采用稀释平板法对根际土壤真菌进行分离[17]。取供试土样与无菌水按照1∶9 比例混合于无菌锥形瓶中,充分振荡 10 min 后静置。将所得土壤悬浊液梯度稀释至103、104、105倍,备用。分别吸取不同梯度溶液200 μL 稀释液涂布于PDA 中,于25℃恒温倒置培养5-7 d 后,挑取具有真菌特征的菌落于PDA 平板上纯化,编号为MR,-20℃保藏备用。
1.2.2 拮抗真菌的筛选 采用对峙培养法[18],于无菌条件下,将经过活化培养后的供试根际真菌、尖孢镰刀菌及木贼镰刀菌分别用打孔器制成直径为 8 mm 的菌饼,2 种病原真菌分别接种于直径为 90 mm PDA 平板中央,根际真菌接种于距平板中心 30 mm处的对称点,以单接病原菌为对照,每处理重复3 次,置于21-25℃恒温培养7 d,观察记录抑菌情况,计算抑菌率[19]。
抑菌率(%)=(RC-RP)/RC×100%
其中,RC 为对照趋势半径,RP 为处理趋势半径。
1.2.3 拮抗真菌的鉴定
1.2.3.1 形态学观察 于无菌条件下,将活化后的拮抗真菌制成8 mm 的菌饼,接种于PDA 培养基平板中央,3 次重复,置于25℃恒温倒置暗培养,逐日观察拮抗真菌的菌落形态、颜色等特征。挑取培养物进行制片,显微观察菌丝、分生孢子等形态特征[20]。
1.2.3.2 分子鉴定 将活化后的拮抗真菌接种于PDB 培养液中,25℃、150 r/min 振荡培养5 d,收集菌丝,采用TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0 试 剂 盒(TaKaRa Bio,Japan)提取真菌基因组DNA,通过1%的琼脂糖凝胶电泳检测DNA 质量。
1.2.3.3 DNA 扩增 基于ITS-PCR 对拮抗真菌DNA 进行扩增[21-22],引物为ITS1(5"-TCCGTAGGTGAACCTGCGG-3")和ITS4(5"-TCCTCCGCTTATTGATATGC-3"),反应体系:Master Mix 12.5 μL、ITS1 1 μL、ITS4 1 μL、rDNA 2 μL、ddH2O 8.5 μL,扩增程序:94℃ 3 min;
94℃ 30 s,55℃ 30 s,72℃ 1 min,30个循环;
72℃延伸5 min,4℃保存。PCR 扩增产物交由上海生工进行测序。
1.2.3.4 序列同源性比较和聚类分析 将拮抗真菌测序结果提交NCBI 核苷酸数据库并进行BIAST 比对分析,利用MEGA 5.2 软件(https://www.megasoftware.net/megamac.php,Arizona State University)进行Clustal W 多重比对,并以邻近法(neighbor-joining)构建系统发育树。
1.2.4 MR-43 利福平(Rif)标记菌株的筛选及土壤定殖能力评价
1.2.4.1 利福平标记菌株筛选 对拮抗真菌MR-43进行利福平抗性诱变,将MR-43 依次接种于含50、100、200、300、350、400 μg/mL Rif 的PDB 中进行逐级培养,培养条件为25℃,170 r/min 振荡培养5 d。当菌株MR-43 可在含400 μg/mL Rif 的PDB 中稳定生长,且形态学指标及对木贼镰刀菌抑菌活性无明显变化时,即得拮抗真菌MR-43 的利福平标记菌株,将其编号为MRRif-43,-20℃保存备用。
1.2.4.2 菌株MRRif-43 孢子悬液制备 将MRRif-43菌株在PDA 平板上25℃培养7 d 后,用无菌水洗脱其分生孢子,并配制为1×108CFU/mL 孢子悬液,4℃保存备用。
1.2.4.3 菌株MR-43 的土壤能力评价 将供试MRRif-43 孢子悬液与防风栽培土壤按照1∶10 比例均匀混合后放入育苗盆钵中,每处理10 次重复,室温下放置,每隔7 d 回收分离1 次土壤中的菌株MRRif-43,统计并记录其在土壤中的定殖菌量。
1.2.5 拮抗真菌 MR-43 的防病效果
1.2.5.1 病原菌孢子悬液的制备 将尖孢镰刀菌、木贼镰刀菌菌株分别在PDA 平板上25℃培养10 d后,用无菌水洗脱2 种病原真菌的分生孢子,并分别配制为1×108CFU/mL 孢子悬液,4℃保存备用。
1.2.5.2 盆栽防病试验 参考Gholami 等[23]研究方法。土壤基质(农田土壤∶蛭石=2∶1)已分别用尖孢镰刀菌、木贼镰刀菌孢子悬液进行预先感病。选取长势一致、根系发达的1年生健康防风植株,共设计2 个实验小区,分别为尖孢镰刀菌防病区和木贼镰刀菌防病区,每小区均设置5 个处理,分别为无处理对照(水)、农药处理组(5.0 g/L 多菌灵50%可湿性粉剂用于尖孢镰刀菌引起的防风枯萎病,0.18 g/L 代森锰锌70%可湿性粉剂用于木贼镰刀菌引起的防风根腐病)、枯草芽孢杆菌菌悬液(含菌量1×107CFU/mL)、哈茨木霉孢子悬液(含菌量1×107CFU/mL)、MR-43 孢子悬液(含菌量1×107CFU/mL)。
各实验小区独立且完全随机分布,每个处理进行20 个重复。常规农业管理70 d 后,调查防风枯萎病、根腐病发病情况,计算病情指数及防病效果。防风枯萎病和根腐病发病程度分为9 级(表1)。

表1 防风枯萎病和根腐病发病程度分级标准Table 1 Disease grading standard of Fusarium wilt and root rot of S.divaricata
病情指数=[∑(病级株数×代表值)/(总株数×最高病级代表值)]×100
防病效果(%)=(对照病情指数-处理病情指数)/对照病情指数×100%
1.2.6 拮抗真菌MR-43 的促生能力评价 土壤基质(农田土壤∶蛭石=2∶1)已预先进行消毒灭菌。选取长势一致、根系发达的1年生健康防风植株,共设置4 个处理,分别为无处理对照(水)、枯草芽孢杆菌菌悬液(含菌量1×107CFU/mL)、哈茨木霉孢子悬液(含菌量1×107CFU/mL)、MR-43 孢子悬液(含菌量1×107CFU/mL)。实验小区为完全随机分布,每个处理进行15 个重复。常规农业管理60 d 后,随机抽取9 株防风植株,测定并记录防风的全株长度、根长、全株鲜重、全株干重、根鲜重、根干重等生物量指标。
1.2.7 数据分析 实验数据采用SPSS ver.13.0(SPSS,Inc.,Chicago,USA)统计分析,采用邓肯氏新复极差法进行差异显著性分析。
2.1 根际土壤真菌的抑菌活性
本研究于防风根际土壤中共分离纯化104 株真菌。如表2所示,7 株根际真菌对尖孢镰刀菌和木贼镰刀菌均具有拮抗作用,抑菌率为9.91%-61.85%。菌株MR-43、MR-38 对尖孢镰刀菌的抑菌率达56%以上,且MR-43 菌株的抑菌活性显著高于余下6 种拮抗真菌,抑菌率为59.63%(P<0.05)。与尖孢镰刀菌相比,7 株拮抗真菌对木贼镰刀菌的拮抗作用更为明显,MR-24、MR-70、MR-43 等6 株拮抗真菌对木贼镰刀菌的抑菌率均达55%以上,其中菌株MR-24 抑菌率为61.85%,差异显著(P<0.05)。但菌株MR-24 对尖孢镰刀菌的抑菌率仅为22.36%,其对供试2 种病原真菌的平均抑菌率为42.11%,而MR-43 菌株对尖孢镰刀菌和木贼镰刀菌的平均抑菌率为58.34%,由此说明,MR-43 更为有效地控制了2 种病原真菌生长扩繁(图1)。经多次验证,菌株MR-43 的抑菌活性稳定,因此将其作为候选菌株用于后续研究。

表2 根际真菌对防风病原真菌的抑制作用Table 2 Antifungal activities of selected rhizospheric fungi against fungal pathogens of S.divaricata
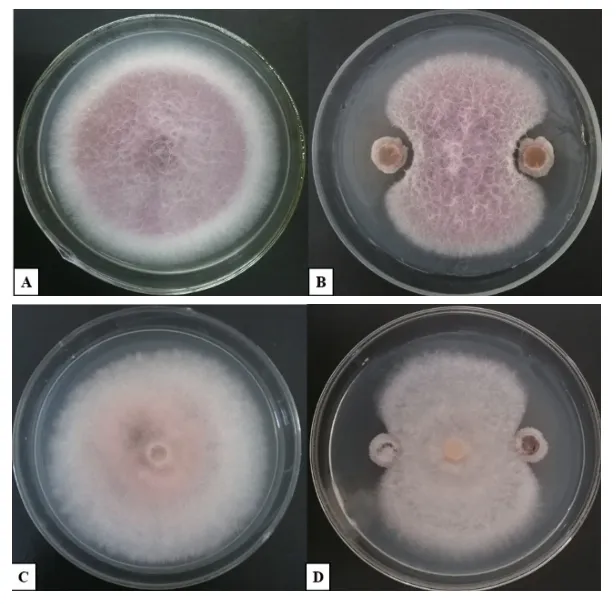
图1 菌株MR-43 对尖孢镰刀菌、木贼镰刀菌生长的影响Fig.1 Effects of MR-43 on F.oxysporum and F.equiseti during the dual culture assay
2.2 拮抗菌株MR-43的分类学鉴定
2.2.1 形态学鉴定 MR-43 菌落在PDA 平板上25℃倒置暗培养7 d 后,菌落平铺、密实,有分泌物渗入PDA 中,边缘不规则,菌落正面呈粉白色(图2-A),菌落背面有放射状褶皱,呈橙红色(图2-B)。分生孢子椭圆形(5-7)μm ×(2-4)μm(图2-C),分生孢子梗直或略弯(图2-D、E),产孢瓶体单孢、轮生,每轮3-10 个产孢瓶体,底部渐细,顶端略膨大,瓶体(9-14)μm ×(2-4)μm(图2-F)。结果表明,菌株MR-43 的形态与葡萄穗霉科真菌相近。

图2 菌株MR-43 菌落形态及显微形态特征Fig.2 Microscopic morphology characteristics and the colony morphology of strain MR-43 isolate
2.2.2 分子生物学鉴定 菌株MR-43 的ITS 基因序列经PCR 扩增,由上海生工公司测序,获得大小为540 bp 的碱基序列,GenBank 登陆号为OK287148.1。序列上传至NCBI 经BLAST 比对,与Sirastachys castanedae(KU846661.1)的同源性达99% 以上,与S.pseudolongispora(KU846674.1)、S.longispora(AF081482.1)、S.parvispora(KX690114.1)的同源性为97%-98%。基于系统发育树的构建,结果(图3)显示,菌株MR-43 与S.castanedae(MW793377.1)表现了高度同源性并处于同一分支。

图3 基于ITS 序列构建MR-43 近缘关系的系统发育树Fig.3 Phylogenetic tree of MR-43 isolate and closely related taxa based on ITS sequences
结合形态学、分子生物学鉴定结果,将分离自防风根际土壤的菌株MR-43 确定为S.castanedae。这是首次发现并报道该菌种可宿生于植物根际土壤。
2.3 菌株MR-43的土壤定殖能力
菌株MRRif-43 经传代培养10 代后仍可在含400 μL/mg 利福平的PDA 平板上稳定生长,且较菌株 MR-43 的形态无明显变化。菌株MRRif-43 对尖孢镰刀菌、木贼镰刀菌的抑菌活性与菌株MR-43 相比无显著差异,抑菌率仍可保持约60%,结果表明,菌株MRRif-43 具有遗传稳定性且对病原真菌仍保持较好抑菌活性。土壤定殖试验周期为35 d,未接种标记菌株的供试土壤经检测,其所含微生物无法在含有400 μg/mL 利福平的PDA 平板生长,由此说明,该浓度下的抗生素选择培养基可用于MRRif-43 菌株的有效回收。如图4所示,土壤中菌株MRRif-43的菌量变化呈明显波动趋势。接种14 d,MRRif-43的土壤含菌量降至1.85×106CFU/g 土;
第21 天,MRRif-43 实现扩繁,其土壤含菌量上升至5.36×106CFU/g 土,增幅为190%,差异显著(P<0.05);
第28 天,菌株MRRif-43 的定殖菌量出现小幅下降,至35 d,MRRif-43菌株的土壤含菌量回升至5.38×106CFU/g 土,与28 d 相比差异显著(P<0.05),定殖菌量较为可观。结果表明,菌株MR-43 具有良好的土壤定殖能力。

图4 菌株MRRif-43 在防风土壤中的定殖情况Fig.4 Colonization of MRRif-43 in the soil of S.divaricata
2.4 菌株MR-43对防风枯萎病及根腐病的防控效果
筛选自防风根际土壤的菌株MR-43,其孢子悬液回施于防风栽培土壤后,可有效缓解防风枯萎病、根腐病病害的发生,降低病害危害。接种MR-43 70 d 后,对照组防风植株枯萎病、根腐病均发生严重,病情指数分别为50.59、64.14,而经多菌灵、代森锰锌农药处理,以及枯草芽孢杆菌、哈茨木霉和MR-43 孢子悬液处理后防风病害均得到了不同程度地控制。其中,MR-43 对枯萎病、根腐病的防效可达63%以上,平均防效为68.51%,与农药处理组相比差异不显著(P>0.05);
菌株MR-43 防效显著高于枯草芽孢杆菌、哈茨木霉(表3,图5)。

图5 MR-43 对防风根腐病、枯萎病的防控效果Fig.5 Biocontrol effects of MR-43 against the root rot and Fusarium wilt disease of S.divaricata

表3 MR-43 孢子悬液对防风真菌性病害的防效Table 3 Control effect of the MR-43 spore suspension on fungal disease of S.divaricata
2.5 菌株MR-43对防风植株生长的影响
将菌株MR-43 接种于防风植株后,其叶片、茎梗及根须等部位未出现致病引发的霉烂或病斑,表明S.castanedaeMR-43 对药用植物防风无致病力。如表4所示,菌株MR-43、B.subtilis菌悬液及T.harzianum孢子悬液均可不同程度的促进防风植株生长。经MR-43 处理后的防风整株长度、根鲜重及根干重指标均显著高于其他处理组(P<0.05)。与CK组(清水处理)相比,MR-43 组防风整株长度、整株鲜重等6 项指标平均增加33.44%,防风根鲜重及根干重提高44%以上。结果表明,菌株MR-43 可促进防风生长,具有根际促生真菌(plant growthpromoting fungi,PGPF)属性,可作为增产有益菌源进一步研究开发。

表4 MR-43 对防风植株的促生效果Table 4 Effects of MR-43 on the promoting growth of S.divaricata
葡萄穗霉科(Stachybotryaceae)真菌是土壤中普通存在的腐生菌成员之一[24],虽然部分该科真菌可引起人类疾病[25-26],但其作为较早被发现并命名的真菌物种之一,在植物病害防控方面拥有较高的研究价值[27],作为生防菌源具有一定的开发潜力[28]。本研究在开展吉林长春防风栽培基地土壤有益微生物资源调查的研究中,筛选获得1 株对防风常见真菌性病害致病菌尖孢镰刀菌、木贼镰刀菌具有较强拮抗作用的根际真菌MR-43,基于培养特性、显微形态特征及分子生物学手段,将菌株MR-43 鉴定为Sirastachys castanedae,首次发现该菌种可作为土著真菌宿生于植物根际土壤。S.castanedae隶属于子囊菌门(Ascomycota),盘菌亚门(Pezizomycotina),粪壳菌纲(Sordariomycetes),肉座菌亚纲(Hypocreomycetidae)肉座菌目(Hypocreales),葡萄穗霉科(Stachybotryaceae),Sirastachys组进化分支中,在1964年首次发现于加拿大安大略省的阿伯福伊尔地区种植的北美香柏土壤,目前S.castanedae仅在中国及西班牙等个别国家有资源调查及分布的报道[29-31]。
生防真菌对植物病原菌具有多种直接或间接的抑菌机制,包括生态位竞争、真菌寄生、抗性物质溶菌及诱导植物抗性等[32]。研究发现,葡萄穗霉科真菌可通过产生β-1,3-葡聚糖酶、几丁质酶等物质有效抑制植物病原真菌的生长[29]。本研究发现,经菌株MR-43 作用后的尖孢镰刀菌及木贼镰刀菌,其菌落边缘均变薄且趋于清晰,气生菌丝溶解消亡。由此推测S.castanedaeMR-43 可通过产生某些次生代谢物质破坏病原真菌菌丝胞壁或胞膜结构,实现抑制病原真菌生长的作用机制,由此暗示S.castanedae胞外次生代谢产物具有植物病害生防制剂的开发潜质。但S.castanedaeMR-43 产生抑菌效应的具体物质尚不明确,仍需开展后续工作挖掘研究。
拮抗微生物的定殖能力强弱直接影响其生防作用有效性及稳定性,同时也是评估生防菌源应用潜力的重要指标[33]。本研究基于抗生素标记法,证实S.castanedaeMR-43 对防风栽培土壤环境的适应力强,可实现稳定地扩繁增殖,具有较好的土壤定殖能力。后续会进一步评价MR-43 在防风等植株体内的定殖效果。
目前,植物病害生物防控研究中普通存在生防菌源室内抑菌效果明显,但室外盆栽或田间防效偏低的问题[34]。本研究利用MR-43 孢子悬液,证实了S.castanedae可有效防控防风枯萎病、根腐病,其室外盆栽防病效果与室内抑菌效果相比仍保持较高水平,且与常规化学农药的病害管理效果持平。此外,本研究发现S.castanedaeMR-43 对防风植株的生长具有促进作用,效果优于已进行农药登记注册的B.subtilis和T.harzianum。有研究者称,将非土著性外源微生物大量引入土壤,易受到来自于习居优势微生物的竞争或其他环境因子的影响,其生长繁殖受限导致生防效果不理想,且非土著性微生物对土壤小环境的习居微生物可能存在取代作用,由此改变土壤微生物群落结构特征,影响土壤原有的微生态平衡[35]。土著群落的多样性及结构对群落功能的发挥具有重要作用,外源微生物的过分干扰,可能会导致宿主植物与土壤微生物的互作受到直接或间接的影响[36]。本研究中,枯草芽孢杆菌、哈茨木霉作为外源微生物,并非源自防风栽培土壤固有的微生态平衡体系,引入土壤后可能与土著微生物存在生态位重叠,土著微生物的功能多样性发生变化导致土壤代谢功能下降,最终影响了外源生防微生物对植物促生效果的发挥。综上所述,分离筛选自防风根际土壤的S.castanedaeMR-43 在防风生态友好型病害防控及作物增产方面具有开发及应用潜力。
本研究于防风根际土壤中分离筛选1 株葡萄穗霉科(Stachybotryaceae)真菌S.castanedaeMR-43,发现该菌种可宿生于植物根际土壤。S.castanedaeMR-43 可在防风栽培土壤中稳定扩繁,具有良好的定殖能力,且其病害防控能力及对防风植株的促生能力均较为突出。由此说明,S.castanedaeMR-43 作为防控防风真菌性病害的候选生防菌源具有开发应用潜力。
猜你喜欢枯萎病根腐病防风番茄萎蔫膨果慢 当心根腐病今日农业(2022年15期)2022-09-20茴香根腐病 防治有办法今日农业(2021年21期)2021-11-26饲用南瓜根腐病的发生原因及防治措施现代畜牧科技(2021年9期)2021-10-13大楼的防风攻略小哥白尼(趣味科学)(2021年11期)2021-02-28胡萝卜镰刀菌根腐病病原菌的鉴定中国蔬菜(2016年8期)2017-01-15非洲:控制香蕉枯萎病的新方法中国果业信息(2016年2期)2016-01-29ZTGC-TD-2011D便携式色谱仪防风处理云南科技管理(2015年5期)2015-12-22云防风的化学成分研究云南中医学院学报(2014年3期)2014-07-31浅谈堆料场防风抑尘墙中国工程咨询(2014年10期)2014-02-16铜、锌元素对香蕉枯萎病的防治有显著效果中国果业信息(2012年9期)2012-01-23本文来源:http://www.zhangdahai.com/gerenwendang/biyeshengziwojianding/2023/0911/652641.html




