【www.zhangdahai.com--其他范文】
曹丽萍,苏芳,周玉花,党万玛,祁兴仁,马秀梅
青海柴达木职业技术学院 生物工程系(德令哈 817000)
藜麦是一种藜科草本植物,营养价值极其丰富,含有多种氨基酸、蛋白质、维生素、铁、钙、磷、锌、叶酸等营养成分[1-4],此外黄酮类、酚类物质含量也较高[5-7],可为人体均衡补充营养,具有改善体质、调节免疫、增强抗病能力、调节人体酸碱平衡的功效[8-10]。
藜麦适合高原山地气候,终年低温地区,且种植海拔越高,品质越好。青海海西州得天独厚的地理环境成为种植藜麦的主产区,近几年,海西藜麦更因营养价值极高远销国内外,藜麦品质也在贸易中得到保证,一大批藜麦加工业蓬勃发展[11]。青海海西藜麦产业发展有其优势,也势必存在其弊端。青海海西生产的藜麦主要有白色、深红色、棕色三色藜麦,种植面积及产量极其庞大[12-14],但在藜麦加工、成分研究方面,始终处于初级开发阶段,市场上的藜麦产品主要是没有经过加工的袋装藜麦颗粒及藜麦作为辅助材料的代餐粉,产品单一,附加值低,对于颜色特殊的红色藜麦未见天然色素提取及藜麦色素加工类产品。食用色素是食品中不可缺少的添加剂,分人工合成色素和天然色素。与人工素色相比,天然色素具有无毒、安全性高、色泽自然鲜艳、营养价值高和药理功能等优越性,日益受到重视和青睐。天然色素现在主要是从植物、动物和微生物细胞中提取[15-18]。红、棕藜麦为草本植物,营养价值极高[19-21],是否可以从红、棕色藜麦中提取藜麦色素,并研究提取后藜麦色素的耐稳定性,进而可开发新天然色素,补充天然色素种类。
已开展天然色素开发的相关研究,其中不乏以紫皮洋葱和苋菜等富含色素的植物为原料进行的研究,但是有关于红、棕藜麦色素提取应用的技术并未出现。因此,试验旨在探究青海海西棕色及深红色藜麦提取色素最佳工艺的研究,并研究其色素的稳定性,为藜麦生产加工链及相关企业开发天然色素类产品提供指导意义,提高该天然色素产业的经济效益,更是为后续藜麦的深加工提供参考价值,提高天然海西藜麦的潜在使用价值,提高藜麦及其产业的经济效益。
1.1 材料与仪器
1.1.1 试验材料
红色藜麦(购于大润发超市,经粉碎后备用);
乙醇(分析纯,天津市大茂化学试剂厂);
氯化钠、过氧化氢、氢氧化钠、抗坏血酸(均为分析纯,天津试剂厂)。
1.1.2 试验仪器
BT224电子天平(北京赛多利斯仪器系统有限公司);
T6型紫外可见分光光度仪(上海天美科学仪器有限公司);
PHS-3C型酸度计(济南泰医生物技术有限公司);
SC-5A超声波清洗器(宁波海曙乙恒仪器有限公司);
KH22R离心机(湖南凯达有限公司);
PW80高速万能粉碎机(天津市泰斯特仪器有限公司);
HH-S4数显恒温水浴锅(河北中捷仪器制造有限公司)。
1.2 试验方法
1.2.1 藜麦色素提取剂的选择
准确称取10 g藜麦粉,利用水和乙醇作为提取剂,提取藜麦中的色素,通过计算藜麦色素提取含量确定最优提取溶剂。
1.2.2 单因素试验
准确称取10 g红藜麦粉,利用超声法提取红藜麦粉中的色素,以藜麦色素得率为考察指标,研究乙醇体积分数(40%,50%,60%,70%和80%)、料液比(1∶50,1∶60,1∶70,1∶80和1∶90 g/mL)、超声温度(35,45,55,65,60和75 ℃)、超声时间(25,30,40,50和60 min)对色素得率的影响。
1.2.3 正交试验
在单因素试验基础上进行正交试验,确定色素最优提取工艺,正交试验因素水平见表1。

表1 正交试验因素水平表
1.2.4 藜麦色素含量的计算
准确称取10.00 g藜麦粉,分别在上述提取试验、单因素试验及正交试验中进行浸提,离心收集滤液,在538 nm下测量吸光度,根据朗伯比尔定律(Lambert-Beer)A=εbc,藜麦色素含量与其吸光度呈正比,因此可采用式(1)计算藜麦色素含量,确定最佳提取工艺[22-23]。

式中:Bp为藜麦色素含量,mg/g;
A为吸光度;
DF为稀释倍数;
Mω为藜麦色素的相对摩尔质量,550 g/moL;
V为溶液总体积,L;
ε为甜菜红素的摩尔消光系数,61 600 L/(moL·cm);
L为光程长,1 cm;
m为藜麦质量,g。
1.3 红藜麦色素稳定性研究
通过正交试验得出最优提取工艺时,以色素残存率为指标,研究pH、温度、光照、氧化剂、还原剂、VC和食盐对藜麦色素稳定性的研究,并进行平行试验。色素残存率按式(2)计算[24-25]。

1.3.1 藜麦红色素溶液配制
取10 g藜麦粉、在乙醇体积分数70%、料液比1∶60 g/mL、超声提取温度30 ℃、超声提取时间55 min条件下提取色素,制得红、棕藜麦色素,用蒸馏水定容至250 mL容量瓶中,密封避光保存备用。
1.3.2 光稳定性试验
取20 mL上述红藜麦色素溶液,分别置于自然光下与紫外灯下72 h,每隔12 h在538 nm处测定藜麦色素提取液的吸光度,按式(2)计算藜麦色素残存率。
1.3.3 热稳定性试验
取6份20 mL上述藜麦色素溶液,分别置于25,35,45,55,65和75 ℃恒温水浴55 min,每10 min在538 nm处测定色素提取液的吸光度,按式(2)计算藜麦色素残存率。
1.3.4 耐氧化性试验
取20 mL上述色素溶液,分别加入10 mL 0.2%,0.5%,1.0%,1.5%和2.0%的过氧化氢溶液,室温放置0,6,12,24和48 h后在538 nm处测定色素溶液的吸光度,按式(2)计算色素残存率。
1.3.5 酸碱稳定性试验
取6份20 mL上述甜菜红色素溶液,并做平行试验。用HCl和NaOH调节色素溶液pH,分别将色素溶液调节成pH 4.0,6.0,7.0,8.0,9.0和11.0并在538nm处测定色素溶液的吸光度,观察吸光度的变化,按式(2)计算色素残存率。
1.3.6 护色试验
取5份20 mL藜麦色素溶液,分别加入2 mL 0,0.5%,0.1%,2.0%和2.5%的抗坏血酸,室温放置反应48 h,并分别在反应48 h,538 nm处测定藜麦色素的溶液吸光度,按式(2)计算藜麦色素残存率。
1.4 数据统计与分析
采用SPSS软件进行数据分析,两组数据的显著性差异采用ANOVA检验,显著性水平为P<0.05。正交试验采用SPSS软件设计,并进行极差和方差分析。
2.1 藜麦色素提取剂的选择
分别选用水和乙醇提取藜麦色素时,提取时间30 min时,研究显示藜麦色素微溶于水,多溶于有机溶剂乙醇。提取时间24 h时,藜麦色素均溶于水和乙醇,但通过测定吸光度得出:水作为提取剂时,吸光度为0.054;
乙醇作为提取剂时,吸光度为1.854。由此可以判断藜麦色素在乙醇溶液中溶解率较大,因此试验选用乙醇作为提取溶剂。
2.2 藜麦色素提取单因素试验结果与分析
2.2.1 乙醇体积分数对藜麦色素提取的影响
如图1所示:随着乙醇体积分数增加,藜麦色素提取率呈现先增后减小趋势,乙醇体积分数60%时,色素提取率最高,为0.818 g/mg,分析原因可能是适当体积分数的乙醇可破坏藜麦细胞脂质结构,加快了色素的溶出;
乙醇体积分数70%时,色素提取率缓慢下降,当乙醇体积分数达到80%,提取含量下降到0.600 g/mg。究其原因可能是随着乙醇体积分数的升高,藜麦中溶出的物质不只色素,还有很多糖类、酚类等非色素物质,导致杂质增多,使得藜麦色素得率低。经分析,选择乙醇体积分数为50%,60%和70%用于正交试验设计。
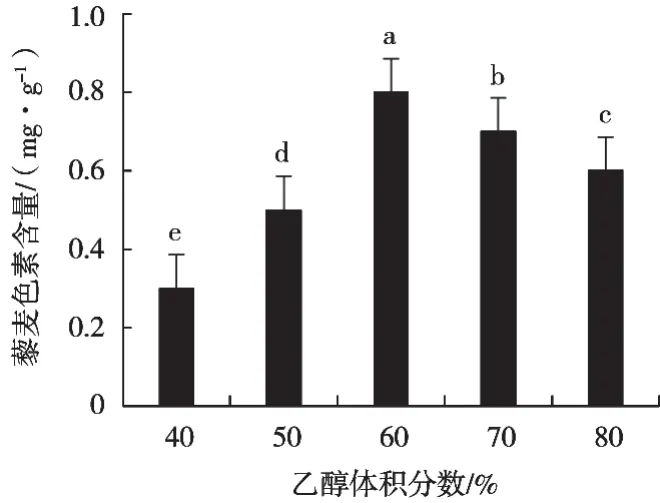
图1 乙醇体积分数对藜麦色素提取的影响
2.2.2 料液比对藜麦色素提取率的影响
如图2所示:随着料液比中液体比例的增加,藜麦色素提取率呈先增后减趋势,料液比1∶60 g/mL时,色素提取率最高,为0.892 mg/g。料液比在小于等于1∶70 g/mL时,藜麦色素提取率呈逐渐下降趋势,分析原因可能是随着乙醇比例的增加,溶出藜麦中的黄酮类及多酚类物质,杂质增多,影响色素的溶出。经分析,选择料液比1∶50,1∶60和1∶70 g/mL用于正交试验设计。

图2 料液比对藜麦色素提取率的影响
2.2.3 超声温度对藜麦色素提取率的影响
如图3所示:随着超声时间的增加,藜麦色素提取率呈先增后减小趋势,超声时间40 min时,色素的提取含量最高,为0.789 mg/g。超出40 min时,藜麦色素提取率呈逐渐下降的趋势,分析原因:其一是藜麦色素耐热性差,时间过高会破坏藜麦色素结构,导致色素提取率不高;
其二是时间过高,导致乙醇挥发过快,溶剂减少,导致色素提取率差。综上,选择超声时间25,30和40 min用于正交试验设计。

图3 超声温度对藜麦色素提取率的影响
2.2.4 超声时间对藜麦色素提取率的影响
如图4所示,藜麦色素提取率随着超声温度的增长呈现先增加后减少的趋势。超声温度55 ℃时,提取含量最高,为0.793 mg/g。超声温度35 ℃时,提取含量较低,为0.456 mg/g,原因可能是提取时间太短,乙醇还未渗透藜麦的细胞壁和细胞膜,导致色素部分溶出,提取量较低。提取温度75℃时,色素提取含量急剧减少,原因可能是:在75 ℃时,色素在之前提取过程中已全部溶出,导致提取率低;
也可能是随着提取温度的增大,其他杂质析出,因此色素提取含量低。经分析,选择超声提取温度45,55和65 ℃用于正交试验设计。

图4 超声时间对藜麦色素提取率的影响
2.3 正交试验
由表2可知,影响藜麦色素提取因素大小顺序是B>A>D>C。在正交试验中,藜麦色素提取最佳工艺配方为A2B2C3D1,即乙醇体积分数60%、料液比1∶60 g/mL、超声时间40 min、超声温度45 ℃,此时色素提取率最高,提取含量为0.897 mg/g。

表2 正交试验结果
由于理论最优水平A3B1C3D1(即乙醇体积分数为70%、料液比为1∶50 g/mL、超声时间为40 min、超声温度为45 ℃)与正交试验最优水平A2B2C3D1(即乙醇体积分数60%、料液比1∶60 g/mL、超声时间40 min、超声温度45 ℃)结果不一致,因而进行验证试验以确定最佳水平组合。由表3分析比较得1组的结果具有显著性差异,因而选择最佳水平组合为A2B2C3D1,即乙醇体积分数60%、料液比1∶60 g/mL、超声时间40 min、超声温度45 ℃。

表3 验证试验
2.4 藜麦色素稳定性研究
2.4.1 藜麦色素光稳定性试验
如图5所示,藜麦色素在自然光和紫外光下随着照射时间的增大色素均呈现下降趋势,但色素的降解率很低。藜麦色素在自然光下残存率达到85.23%,在紫外光下残存率为89.21%,表明在照射72 h内藜麦色素对光不敏感,尤其对紫外光不敏感,色素的降解率低。但熊勇[18]、任文明等[26]的研究表明,色素不宜长时间暴露在自然光下,随着时间的延长,色素的降解会越来越快,直至降解完全。综上,避光保藏有利于藜麦色素的保存,便于加工利用。

图5 藜麦色素光稳定性试验结果
2.4.2 藜麦色素热稳定性试验结果
由图6可知,随着超声温度的升高,藜麦色素的残存率先缓慢平稳下降,后急剧下降。超声温度25 ℃时,色素残存最高,吸光度为0.804,且藜麦色素颜色呈现黄绿色;
超声温度75 ℃时,色素急剧降解到最低,测得的吸光度为0.723,藜麦色素颜色呈现出淡黄绿色,且经75 ℃处理后藜麦色素残存率下降到53.73%。分析原因:藜麦色素对高温较敏感,在高温条件下会发生降解现象,破坏色素化学结构,破坏稳定性。因此藜麦色素建议使用温度应在30 ℃左右,温度不可过高。
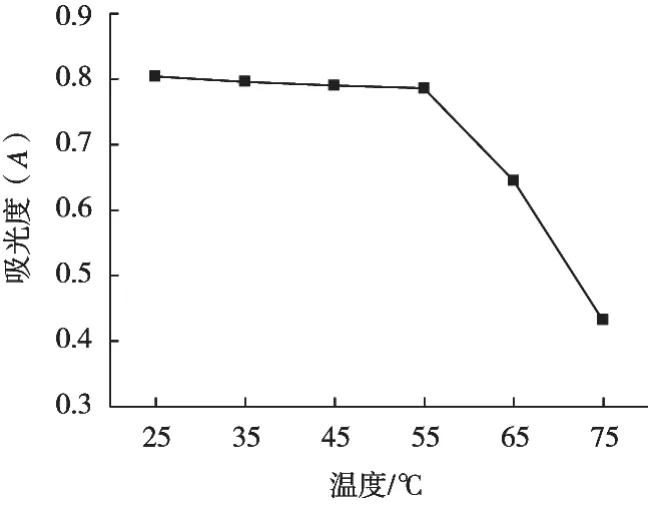
图6 藜麦色素热稳定性试验结果
2.4.3 藜麦色素耐氧化性试验结果
由图7可知,随着H2O2浓度的增大及处理时间的增长,藜麦色素残存率5个处理组都呈现降低趋势,但下降趋势总体不明显。5个处理组的试验结果表明,不同浓度的氧化剂随着氧化时间的增长表现出不同程度的氧化作用,浓度越低氧化作用越小,浓度越大氧化作用越大,用最大浓度(2.0%)H2O2处理藜麦色素48 h后,在5个处理组中色素的降解率最高,但色素残存率为97.17%,保存率较高。这表明,强氧化剂H2O2对藜麦色素具有一定的保护作用,藜麦色素的耐氧化性较好。

图7 藜麦色素耐氧化性试验结果
2.4.4 藜麦色素耐酸碱性试验结果
由表4可知,酸碱环境对藜麦色素影响较大,藜麦色素溶液pH在4.0~7.0范围时色素的吸光度随pH的增大而增加,且溶液中色素的颜色由淡黄色变为深黄色。在pH 7.0时,颜色最深,吸光度最大,为1.092;
pH在8.0~11.0时溶液的吸光度随着pH的增大而逐渐减小,颜色逐渐变浅,但pH为9.0时,出现深黄色,颜色加深,分析原因是可能是当pH 9.0时,藜麦色素中的酚羟基在碱性条件下电离成酚氧负离子,供电性大大增强,同时,藜麦色素中的供吸电子协同作用加强,从而产生深色效应,后pH为11.0时,又恢复淡黄色。综上,建议藜麦色素最佳使用pH范围为4.0~8.0。

表4 藜麦色素酸碱稳定性研究试验结果
2.4.5 藜麦色素护色试验
如图8所示,未添加护色剂时,藜麦色素残存率随着放置时间的延长呈现缓慢下降的趋势,残存率由99.76%下降到99.38%。添加0.5%护色剂时,色素残存率曲线较未添加护色剂下降缓慢,由99.76%下降到99.50%,表明0.5%的护色剂已发挥护色作用,但效果不明显;
添加1.5%的护色剂时,色素残存率保持稳定,无下降趋势,且色素残存率一直稳定在99.76%;
添加2.0%的护色剂时,色素残存率有小幅上升趋势,表现出护色剂的增色作用。由此可知,不同浓度的抗坏血酸对藜麦色素残存率的护色效果差异较大,较低浓度的护色剂,护色效果较差,但较高浓度的护色剂可保护色素,降低色素降解的速率,也可起到增色作用,故建议在藜麦色素的实际应用中应适量加入一定浓度的抗坏血酸,起增色作用。
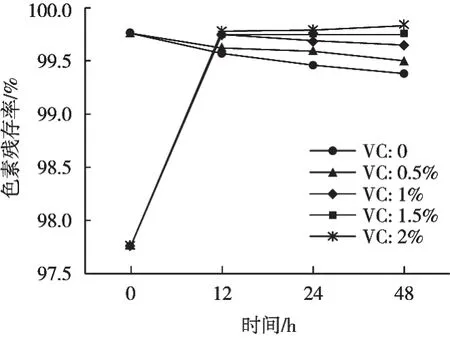
图8 藜麦色素耐氧化性试验结果
选用青藏高原红藜麦为主原料,通过单因素试验和正交试验得到藜麦色素的最佳提取方法:乙醇体积分数60%、料液比1∶60 g/mL、超声时间40 min、超声温度45 ℃。对色素进行稳定性研究,结果表明藜麦色素在适当酸碱、热条件及氧化剂作用下都有较好的稳定性,并在pH 4.0~8.0范围内色素呈现较好的颜色,为黄绿色。但藜麦色素并不耐光,不宜长时间放置在自然光下。综上,藜麦色素应尽量低温、避光、低酸性条件下储存和使用,适当添加抗坏血酸可有效提高藜麦色素颜色强度。
猜你喜欢 光度乙醇色素 乙醇的学习指导中学化学(2022年4期)2022-06-17乙醇和乙酸常见考点例忻中学生数理化·高一版(2022年4期)2022-05-09食用色素安全吗少儿科技(2022年2期)2022-03-05炫彩熔岩灯数学大王·趣味逻辑(2021年6期)2021-09-27褪色的芬达发明与创新·小学生(2020年12期)2020-12-21皎皎月光花火A(2018年9期)2018-11-26光谱类食品安全快速检测仪空白扣除原理中国新技术新产品(2017年5期)2017-03-20世界主要国家乙醇燃料生产情况能源(2014年12期)2014-12-23生活中两种常见的有机物(第一课时)学案成才之路(2009年35期)2009-06-09本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0423/588521.html




