【www.zhangdahai.com--其他范文】
韩 红陈旭霞逯建立韩艳珺*
(1.邢台市人民医院儿一科,河北 邢台 054000;2.秦皇岛市第一医院儿科,河北 秦皇岛 066000)
肺炎支原体(Mycoplasmapneumoniae,MP)感染多发于童和青少年,其致病率高、易于流行,临床可引发咳嗽、发热,并可导致多器官、多系统的肺外损害,严重影响人体健康[1-2]。肺炎支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)由MP感染引起,发病机制与上皮细胞凋亡和机体过度免疫应答有关[3-4]。近年来的研究证实,“TLR4/NF-κB”信号通路与机体抗炎免疫机制密切相关。TLR4是首个发现的Toll样受体TLRs(toll-like receptor,TLR),其参与支原体肺炎发病进程,介导炎症反应[5]。当TLRs识别外源性刺激危险信号后,核因子κB(nuclear factor-κB)被激活,从而启动炎症免疫相关细胞因子的分泌[6]。
杀 菌、通 透 性 增 加 蛋 白(bactericidal/permeability-increasing protein,BPI)是机体在免疫反应中释放的免疫分子,可特异性地中和脂多糖(lipopolysaccharide,LPS),对革兰氏阴性菌具有强烈的细胞毒性效应[7],在机体免疫中发挥重要作用。有研究表明[8],BPI具有抑制促炎因子IL-6的表达,促进抗炎因子白细胞介素-10(interleukin-10,IL-10)表达的作用,能有效减轻机体炎症反应,同时还具有增效抗生素杀菌的作用[9],但重组BPI在支原体感染小鼠肺部炎症中的作用还尚不清楚。因此,本研究通过建立支原体感染小鼠模型,给予重组BPI干预,研究重组BPI对MPP小鼠炎症反应及TLR4/NF-κB信号通路的影响,为研究重组BPI在MP的抗病机理研究奠定基础。
1.1 实验动物
4~6周龄SPF级雄性BALB/c鼠67只,体重14~18 g,购于河北省实验动物中心[SCXK(冀)2018-004],饲养于河北医科大学实验动物公共服务平台[SYXK(冀)2020-002],单笼饲养,饲养温度控制在25℃~26℃,相对湿度为50%~60%,充足光照,饲养1周后进行试验。实验过程遵守减少、替代、优化的3R原则,所有动物实验经我院实验动物伦理委员会审批(IACUC-2019-0356)。
1.2 主要试剂与仪器
肺炎支原体(ATCC15331)FH标准株(上海佰泰科技有限公司);兔抗鼠TLR4抗体、兔抗鼠NFκB p65抗体、重组BPI蛋白及DAB显色试剂盒(北京中杉金桥生物技术有限公司);RIPA裂解液、IL-1β、IL-6、TNF-α酶联免疫吸附法(ELISA)检测试剂及MP核酸检测试剂盒(上海科华生物工程股份有限公司);HRP标记羊抗兔IgG(武汉武汉博士德公司);HE染色试剂盒(北京中山生物技术公司);TRIzol总RNA提取试剂及RNA反转录试剂盒(Invitrogen公司)。
ELX88型酶标仪(美国Bio-Tek仪器有限公司);CKX41倒置光学显微镜(日本Olympus公司);2720 Thermal cycler PCR扩增仪(美国Applied Biosystem公司);UV-3型紫外可见分光光度计(上海美谱达仪器有限公司);实时荧光PCR仪(美国Bio-Rad公司);RM2335石蜡切片机、Histostar石蜡包埋机、TP1020型自动组织脱水仪(德国leica公司)。
1.3 实验方法
1.3.1 研究路线
本文研究路线图如图1所示。
图1 研究路线图Figure 1 Research roadmap
1.3.2 动物分组及模型制备
适应性饲养1周后,根据样本量计算公式φ2=(∑si2/g)/[∑(xi-x)2/(g-1)]计算得出本研究单组小鼠的最小样本量为9.27,采用随机数字表法将小鼠分为正常对照组(15只)、肺炎支原体(MP)模型组(13只)和重组BPI蛋白高、中、低剂量组(各13只)。按照文献[10]中的方法对除正常对照组外的小鼠建立MP模型,1%戊巴比妥钠(0.05 mL)腹腔注射麻醉小鼠,鼻滴100 μL浓度为1×106CCU/mL的MP菌液,完成后将小鼠头部后仰30~45°,保持1 min,使MP菌液经鼻腔到达下呼吸道,对照组以等量不含MP的培养液滴鼻,连续滴鼻4 d。次日对小鼠进行核酸检测,阳性结果提示造模成功。造模过程中MP模型组死亡两只小鼠,其余造模小鼠核酸检测结果均呈阳性,造模成功。
1.3.3 药物处理
除正常对照组和MP模型组,其余组小鼠开始药物治疗,重组BPI蛋白各治疗组小鼠腰静脉注射0.45、0.3和0.15 mol/L重组BPI,注射量为1.5 mL,每3 d注射1次,空白对照组和模型组腰静脉给予等量生理盐水注射,所有小鼠均采用不同方法干预4周。
1.3.4 小鼠肺指数、干湿比测定
末次给药后禁食12 h后,将小鼠麻醉后进行称重,无菌解剖,分离小鼠双侧肺组织并称重,计算肺湿重指数,肺指数=肺重/体重×100%。
取右中肺叶组织置于锡箔纸上,采用洁净滤纸吸干肺组织表面水分置于玻璃瓶中精确称湿重(W),然后将肺组织连同锡箔纸置于80℃恒温箱中烘烤72 h后测定肺组织干重(D),记录并计算出肺组织W/D重比值。
1.3.5 HE染色观察肺组织病理变化
将小鼠麻醉处死后取左肺上叶,在4%多聚甲醛中固定24 h 后转移至75%的乙醇中,脱水、透明处理,石蜡包埋后5 μm切片,水浴展开,捞片,沥干,置于烘箱中烤2 h,HE染色,显微镜下观察小鼠肺组织病理学改变。
1.3.6 肺组织病理评分
由两位主治医师采用双盲法阅片,并根据肺组织病理变化进行肺组织病理学评分,每张切片通过5个分类评价系统进行评分,评分标准见表1[11]。总评分计算公式为:总分=A+3(B+C)+D+E。

表1 肺组织病理评分标准Table 1 Lung tissue pathology scoring standard
1.3.7 ELISA检测炎症因子水平
小鼠眼眶静脉丛取血,离心分离血清(3000 r/min,15 min),ELISA检测IL-6、TNF-α及IL-1β水平。
1.3.8 RT-PCR检测肺组织TLR4、NF-κB p65 和IκBα mRNA相对表达量
小鼠基因引物序列由上海生工合成,见表2。取小鼠肺组织并粉碎,TRIzol提取总RNA,紫外分光光度计分析RNA纯度。合成cDNA,PCR扩增,RT-PCR检 测 肺 组 织TLR4、NF-κB p65和I-κBα mRNA表达水平。反应体系:SYBR Greeb PCR Master Mix(2×)15 μL;Primer A 0.5 μL;Primer B 0.5 μL,加超纯水至30 μL。扩增程序:95℃预变性5 min,95℃变性15 s,60℃退火50 s,共40个循环。反应均以β-actin为内参,采用2-ΔΔCt算法计算mRNA相对表达量。

表2 RT-PCR基因序列Table2 RT-PCRgenesequence
1.3.9 Western blot检测蛋白表达
采用RIPA细胞裂解液裂解小鼠肺组织,离心(12000 r/min,10 min)收集上清。取样30 μL,12%SDS-PAGE凝胶电泳,电转至PVDF膜,浸入封闭液中孵育1 h,加入一抗室封闭过夜。次日加入二抗孵育1 h,凝胶成像系统成像,以GAPDH为内参,计算蛋白表达。
1.4 统计学方法
数据分析采用SPSS 22.0版,采用Graphpad 5.0绘图,计量资料采用(x±s)表示,组间比较采用t检验,检验水准α=0.05,P<0.05表示差异有统计学意义。
2.1 各组小鼠肺指数、W/D及病理评分
与对照组比较,MP模型组小鼠肺指数及肺组织病理学评分显著增加(P<0.05),不同剂量重组BPI干预后,小鼠肺指数、组织病理学评分有所降低,除重组BPI低剂量组肺指数与模型组比较无统计学意义外,其余组别肺指数及肺组织病理学评分与模型组比较,差异均具有统计学意义(P<0.05);各组W/D比差异均无统计学差异(P>0.05),见表3、表4。
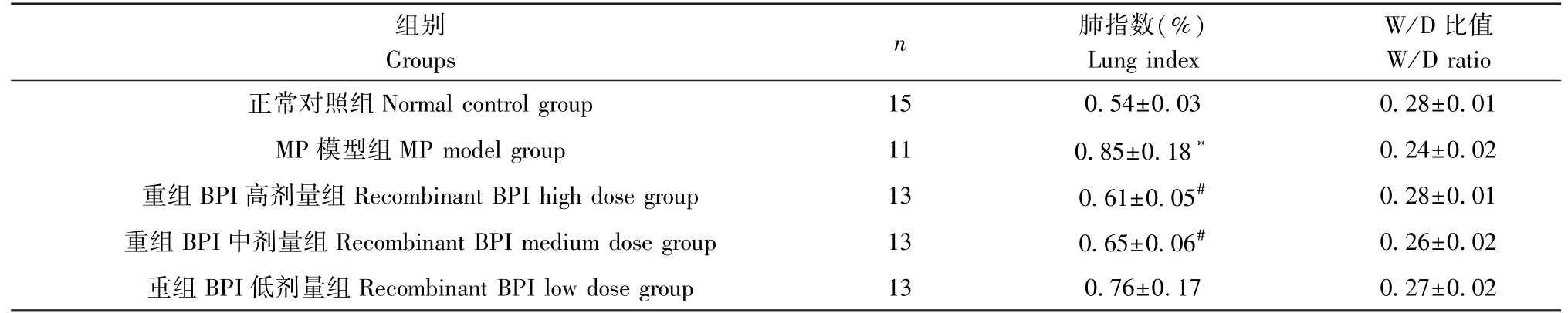
表3 各组小鼠肺指数、W/D比较Table 3 Comparison of lung index and W/D of mice in each group

表4 各组小鼠肺组织病理学评分Table 4 Lung histopathological scores of mice in each group
2.2 小鼠肺组织病理学改变
对照组小鼠肺组织肺泡清晰正常,无炎性物渗出,周围血管未见炎性细胞浸润;MP模型组小鼠肺泡结构不完整,见大量渗出物,毛细血管扩张,气管管壁及周围间质充血,肺泡间质见炎性细胞浸润;重组BPI高、中、低剂量组肺部炎症较轻,渗出物和炎性细胞浸润较少,并呈出剂量依赖性,见图2。

图2 各组小鼠肺组织病理变化(HE染色)Figure 2 Pathological changes of lung tissue of mice in each group(HE staining)
2.3 各组小鼠血清炎症因子水平
MP模型组小鼠血清TNF-α、IL-1β、IL-6水平较对照组显著增加(P<0.05),与MP模型组比较,重组BPI各剂量组小鼠血清炎症因子水平均降低(P<0.05),其中重组BPI治疗组炎症细胞因子水平随给药量的增加而下降,呈现出剂量依赖性,见表5。

表5 各组小鼠血清中TNF-α、IL-1β、IL-6水平比较(ng/L)Table 5 Comparison of TNF-α, IL-1β and IL-6 levels in serum of mice in each group
2.4 各组小鼠肺组织TLR4、NF-κB p65 和I-κBα mRNA 的表达水平
RT-PCR检测结果显示,与正常对照组比较,MP模型组小鼠肺组织TLR4 mRNA、NF-κB p65 mRNA表达明显上调(P<0.05);重组BPI各组小鼠肺组织TLR4 mRNA、NF-κB p65 mRNA表达与MP模型组比较明显下调(P<0.05);MP模型组I-κBα mRNA表达较对照组明显下调(P<0.05),重组BPI各组小鼠肺组织I-κBα mRNA表达与MP模型组比较明显上调(P<0.05),见表6。

表6 各组小鼠肺组织NF-κB p65、TLR4、p-IκB mRNA表达变化Table 6 Expression changes of NF-κB p65, TLR4 and p-IκB mRNA in lung tissue of mice in each group
2.5 各组小鼠肺组织TLR4、NF-κB p65 和I-κBα蛋白表达水平
与正常对照组比较,MP模型组小鼠肺组织中NF-κB p65、TLR4蛋白表达明显上调,I-κBα蛋白表达明显下调;与MP模型组比较,重组BPI各组蛋白表达明显下调,而I-κBα 蛋白表达明显上调(P<0.05),见图3。

图3 各组小鼠肺组织NF-κB p65、TLR4、I-κBα 蛋白表达水平Note. Compared with normal control group, *P<0.05. Compared with MP model group, #P<0.05.Figure 3 Protein expression levels of NF-κB p65, TLR4 and I-κBα in lung tissue of mice in each group
MPP是一种主要由肺炎支原体感染引起的急性呼吸道感染疾病,易在儿童群体中爆发流行,但目前关于支原体肺炎致病的具体机制尚不完全明确。临床研究多认为其与上皮细胞损伤和免疫学机制有关[12-13]。BPI是一种阳离子膜结合型抗菌蛋白,广泛分布于小鼠、人皮肤及粘膜上皮细胞中,具有抑制炎性介质生成及杀灭革兰氏阴性菌的作用,并且不易产生抗性,在机体免疫防御系统中起着重要作用[14]。与常规抗生素不同,BPI可通过与脂多糖结合抑制免疫系统的过度激活[15]。近年来,人们对BPI的天然蛋白及重组蛋白进行了系统的研究。早期研究发现[16],在狒狒大肠杆菌脓毒血症模型中,静脉注射重组BPI后能减少细菌量并缓解器官衰竭,胡伶俐[17]等通过体外抑菌试验证明重组BPI具有抗革兰氏阳性菌和革兰氏阴性菌的生物活性。基于以上研究结果,本研究将重组BPI蛋白应用于肺炎支原体感染小鼠的治疗中。
MP感染后机体免疫功能紊乱,促进炎症浸润和炎症细胞因子释放。TNF-α可通过促进中性粒细胞释放诱导炎症反应,与MP发病有关[18-19],MP感染患者的TNF-α水平较正常者明显增加[20]。IL-6是炎症反应的重要媒介,在肺部炎症反应和机体免疫防御中起重要作用[21],研究发现MP感染小鼠肺泡灌洗液中IL-6水平与炎症程度呈正相关[22]。本研究中,MP感染小鼠血清炎性细胞因子水平与对照组显著升高,提示MP感染可影响炎性细胞因子水平,从而引发机体炎症反应。重组BPI干预后,MP小鼠血清TNF-α、IL-1β、IL-6水平均降低,HE染色结果显示,重组BPI干预后的MP小鼠肺组织炎细胞浸润较少,肺泡渗出减轻,表明重组BPI能有效减轻MP感染肺炎症反应。
Toll样受体(TLRs)是具有天然免疫和获得性免疫的识别受体,TLR4是其家族成员之一,能介导机体的抗病毒固有免疫,促进获得性免疫的产生[23],被证实与肺部感染性疾病密切相关,NF-κB是一种很重要的转录因子,位于TLR下游信号通路的枢纽位置,当细胞内TLR被激活后,通过髓系分化蛋白MyD88激活NF-κB,正常情况下,NF-κB通过其抑制剂IκB蛋白在细胞质中螯合处于未激状态,当受到致病菌刺激时I-κBα被磷酸激酶磷酸化,导致其蛋白酶体降解和NF-κB p65的激活和释放,从而激活炎症细胞因子,调控机体免疫功能[24-26]。本研究结果显示,MP模型组小鼠肺组织TLR4和NF-κB p65 mRNA及蛋白表达均较正常对照组明显上调,I-κBα mRNA及蛋白表达均较对照组明显下调,提示MP感染可激活TLR/NF-κB信号通路,引起炎症反应。重组BPI各给药组肺组织中TLR4和NF-κB 蛋白表达明显降低,TLR4和NF-κB mRNA活性被显著抑制,提示重组BPI蛋白可能通过TLR/NF-κB信号通路抵抗MP感染造成的肺部炎症反应和损伤。
综上所述,重组BPI蛋白能够减轻MP小鼠肺部损伤,推测这一作用是通过调控TLR/NF-κB信号通路从而抑制TNF-α、IL-1β、IL-6的产生,为肺炎支原体引起的肺炎治疗提供了新的思路。本研究尚存在不足之处,TLR/NF-κB相关通路分子和基因表达网络还有待进一步研究。
猜你喜欢 支原体机体小鼠 小鼠大脑中的“冬眠开关”学苑创造·A版(2020年9期)2020-10-13肠道细菌改变小鼠更难克服恐惧大自然探索(2020年2期)2020-04-30邓俊峰作品选海峡影艺(2019年1期)2019-06-24支原体对生殖健康的危害人人健康(2017年19期)2017-10-20饲粮锌在畜禽机体中的作用农民致富之友(2017年4期)2017-04-10柴油机机体常见损伤的检修农机使用与维修(2016年10期)2016-11-10浅析12V240ZJB柴油机碾瓦烧轴科技与创新(2015年11期)2015-06-16小儿支原体肺炎65例临床分析中国民族民间医药·下半月(2014年2期)2014-09-26宠物小鼠金山(2009年11期)2009-01-05本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0425/589098.html




