【www.zhangdahai.com--其他范文】
朱翔,汪宣,徐文君,沈建敏
(上海烟草包装印刷有限公司,上海 200137)
全氟和多氟化合物(PFAS)是一类人工合成的脂肪烃类化合物。OECD和EPA等国际机构将全氟化合物中取代的C原子数目大于等于6的PFSAs、大于等于7的PFCAs定义为长链PFASs,反之则称之为短链PFASs[1-3]。PFAS因其独特的惰性、疏水疏油性、良好的滑动性、拒污性等,被广泛应用于纺织品、涂料、化工、纸张和包装等领域。在食品接触材料相关领域,PFAS最广泛的用途是作为生产聚四氟乙烯(PTFE)、不粘锅涂层以及被添加到用于盛放热的油腻食品的纸制品中,而N-乙基全氟辛基磺酰氨基乙醇(EtFOSE)则被广泛用于造纸处理。由于全氟化合物是一种出色的表面活性剂,因此也常常添加入油墨中,帮助其中的组分进行分散。目前,全氟化合物用于纸质材料涂层或添加物中的主要是些低分子量(C6,C8等)或者以他们为主链含有一定侧链的高分子量(如C10和C12)的全氟化合物。[4]
PFAS中的C-F使得此类化合物难降解,排放至环境后能够在自然界中稳定存在,并在生物链中不断传递和累积。已有的毒理研究表明长链PFAS可引发多种疾病,因此许多国际氟化工生产商就开展了短链PFASs的替代研究,但短链PFASs与长链PFASs一样对肝和甲状腺有毒性效应,区别是短链PFASs需要更高的剂量以达到长链PFASs相似的效应。因此,研究PFAS需要同时关注长链和短链的使用情况。[5-7]
目前一些主要国家都发表了PFAS的管控要求:1)中国只有生态环境部出台相关公告,2019年底10号《关于禁止生产、流通、使用和进出口林丹等持久性有机污染物的公告》中涉及在物质和产品中到不得使用全氟辛烷磺酸及其盐类、全氟辛基磺酰氟。执行日期为2019.3.26。2)欧盟POPs法规(2019/1021)中阐明物质、混合物、物品中:a)全氟辛酸及其盐类:≤0.025 mg/kg;
b)全氟辛酸相关物质:≤1 mg/kg。执行日期为2020.7.4。3)REACH法规高度关注物(SVHC)中规定物质、混合物、物品中:a)全氟十三酸:≤ 0.1%;
b)全氟十二烷酸:≤ 0.1%;
c)全氟十一烷酸:≤ 0.1%;
d)全氟代十四酸:≤ 0.1%;
e)全氟辛酸铵(APFO):≤ 0.1%;
f)全氟辛酸(PFOA):≤ 0.1%;
g)全氟壬酸(PFNA)及其钠盐和铵盐:≤ 0.1%;
h)全氟癸酸(PFDA)及其钠盐和铵盐:≤ 0.1%;
i)全氟己基磺酸(PFHxS)及其盐类:≤ 0.1%;
j)全氟丁烷磺酸(PFBS)及其盐类:≤ 0.1%;
k)3,3,3-四氟-2-(七氟丙氧基)丙酸及其盐和酰卤化物:≤ 0.1%。均已实行。其法规附录REACH法规附录XVII规定物质、混合物、物品中:a)C9-C14全氟羧酸(C9-C14 PFCAs)及其盐:< 0.025 mg/kg (25 ppb);
b)C9-C14全氟羧酸(C9-C14 PFCA)相关物质:< 0.026 mg/kg (260 ppb)(总和)。正在提议。4)丹麦的行政命令第681/2020号规定食品接触用纸和纸板中全氟和多氟烷基物质(PFAS):不得使用,执行日期为2020.7.1。5)加拿大SOR/2012-285及其修订SOR/2016-252规定物品、产品中:a)全氟辛基磺酸(PFOS)及其盐类和其相关物质:不得含有;
b)全氟辛酸(PFOA)及其盐类:不得含有;
c)C7-C8全氟烷基物质(C7-C8 PFAS):不得含有;
d)C9-C21全氟羧酸(C9-C21 PFCAs)及其盐类:不得含有;
e)C8-C20全氟烷基物质(C8-C20 PFAS):不得含有。执行日期:2017.1.1。6)与我们贸易摩擦最严重的美国包装中的有毒物质公示法案(TPCH)规定包装或包装部件全氟和多氟烷基物质(PFAS):不得检出。正在公众评议阶段[8]。可以看出中国对于全氟化合物的管控还比较宽松,因此很多全氟化合物的使用都被得到允许,加之许多供应商对其使用量及添加成分是商业机密,因此很难直接知悉可能存在的风险。然而一旦我们的产品出口到国外,许多国家的法律法规是非常严格的,可能遭遇“绿色壁垒”。
全氟烷基化合物的主要分析包括气相色谱类方法、液相色谱类方法、光谱法、酶联免疫法及电化学方法。目前一些标准中,如GB 31604.35-2016《食品接触材料及制品 全氟辛烷磺酸(PFOS)和全氟辛酸(PFOA)的测定》[9]、SN/T 2393-2009《进出口洗涤用品和化妆品中全氟辛烷磺酸的测定 液相色谱——质谱/质谱法》[10]、SN/T 3544-213《出口食品中全氟辛酸和全氟辛烷磺酸盐的测定 液相色谱——质谱/质谱法》[11]、SN/T 3694.1-2014《进出口工业品中全氟烷基化合物测定 第1部分:化妆品 液相色谱——串联质谱法》[12]、SN/T 3694.6-2014《进出口工业品中全氟烷基化合物测定 第6部分:油墨 液相色谱——串联质谱法》[13]、SN/T 3694.13-2013《进出口工业品中全氟烷基化合物测定 第13部分:食品接触材料 液相色谱-串联质谱法》[14]、SN/T 3694.14-2013《进出口工业品中全氟烷基化合物测定 第14部分:塑料制品 液相色谱——串联质谱法》[15],基本采用HPLCMS/MS进行检测,其灵敏度高、分析对象比较广、且能够准确定性定量,因此本研究中采用HPLC-MS/MS对多种全氟烷基化合物进行检测。
我国对全氟化合物的研究还处于国际发展水平,相关的管控措施也并不完善,然而,随着全氟烷基化合物的关注度持续提升,相关政策和法规的建立只是时间问题。本文基于液相色谱——串联质谱法,旨在对开发检测方法的关键点进行探索研究,特别是色谱柱、流动相及进样量对色谱图峰形以及标准曲线相关系数的影响,在此基础上开发了用于包装印刷材料中全氟烷基化合物检测的液相色谱——串联质谱法。
2.1 仪器、耗材、标准品与试剂
2.1.1 仪器及耗材
仪器:Agilent 1290 II-6470超高效液相色谱三重四极杆液质联用仪(美国Agilent公司);
电子天平(感量:0.1 mg,瑞士Mettler Toledo公司);
移液器(德国brand公司);
5804R高速离心机(德国eppendorf公司);
Milli-Q超纯水仪(美国Millipore公司);
2700TH超声波清洗器(上海安普实验科技股份有限公司);
各种规格具塞锥形瓶(德国witeg公司);
各种规格色谱柱。
2.1.2 试剂及标准品
全氟烷基化合物混合标准溶液(2000 μg L-1)、内标物标准品(2000 μg/L);
色谱纯甲醇、乙酸铵(上海安普实验科技股份有限公司);
符合GB/T6682规定的一级水。
2.2 内标溶液的配制
取20 μL内标物标准品(2000 μg L-1)于10 mL容量瓶,甲醇定容,配制成浓度为4 μg L-1的内标溶液。
2.3 系列标准溶液的配制
取0.25 μL全氟烷基化合物混合标准溶液(2000 μg L-1)于50 mL容量瓶,甲醇定容,配制成浓度为10 μg L-1的标准储备溶液;
分取0.1、0.5、1、2、5、10 mL的标准储备溶液,加入100 μL内标溶液,用甲醇定容至10 mL容量瓶中,得到0.1、0.5、1.0、2.0、1.0、5.0、10.0 μg L-1系列标准溶液。
3.1 色谱柱的选择
全氟烷基化合物由于同时兼具疏水性和亲水性,因此选择C18反相色谱柱进行实验即可满足化合物的分离分析。然而,虽然固定相种类相同,但粒径、柱长、柱直径都会影响出峰时间、峰形和分离情况。本文选择C18 RRHD 1.8 μm×2.1 mm×100 mm(图1a)、C18 RRHD 1.8 μm×2.1 mm×150 mm(图1b)、C18 RRHD 1.8 μm×3.0 mm×50 mm(图1c)进行研究。

图1a) C18 RRHD 1.8 μm×2.1 mm×100 mm色谱柱图

图1b) C18 RRHD 1.8 μm×2.1 mm×150 mm色谱柱图

图1c) C18 RRHD 1.8 μm×3.0 mm×50 mm色谱柱图
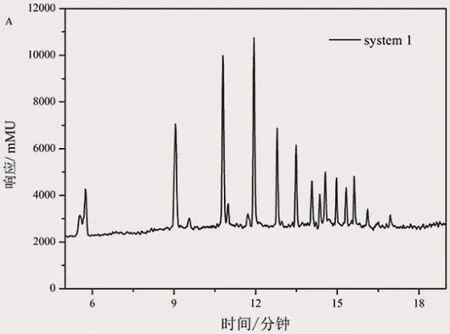
图2a) 乙酸铵-水:乙酸铵-甲醇体系中的色谱图

图2b) 乙酸-水:乙酸-甲醇体系中的色谱图

图2c) 乙酸铵:水-甲醇体系中的色谱图
在使用C18 RRHD 1.8 μm×3.0 mm×50 mm色谱柱时,色谱峰出峰时间较晚,同时峰形较差。改用C18 RRHD 1.8 μm×2.1 mm×150 mm时,出峰位置前移,峰形得到改善。进一步优化,使用C18 RRHD 1.8 μm×2.1 mm×100 mm时,色谱峰出峰时间更快,同时峰形较为对称。因此,后续实验采用C18 RRHD 1.8 μm×2.1 mm×100 mm进行检测。
3.2 流动相体系的选择
流动相对于色谱峰的分离效果也是一个重要因素,甚至影响出峰情况。目标化合物带有COO-、SO32-等集团,难于质子化,故在流动相中需要提供酸性环境以帮助目标化合物进行质子化,同时采用ESI-模式进行全扫描。实验中加入乙酸铵和乙酸进行酸性调节。当采用①乙酸铵-水:乙酸铵-甲醇体系进行实验时,色谱峰分离度较好、出峰均在18 min内完成。当采用②乙酸-水:乙酸-甲醇体系时,色谱峰分离度没有体系①效果好,并且出峰较慢,均在20 min内完成,因此采用乙酸铵体系进行酸度调节可以获得满意的实验结果。
进一步实验结果表明,乙酸铵在甲醇中的溶解度随着温度升高而增大,在温度较低的环境,例如冬天的实验环境,乙酸铵容易在甲醇中析出,产生微小结晶,当随着流动相进入系统会液相堵塞系统、堵塞色谱柱,使液相系统的压力波动较大,同时在样品采集过程中压力不断增大会影响出峰时间稳定性、出峰峰形。由于乙酸铵与水是互溶的,温度对其溶解度影响较小,进一步进行优化,采用③乙酸铵:水-甲醇体系进行实验。采用该体系时,其出峰时间与体系①相比,差别较小,均在17.5 min内完成出峰,同时峰形的影响较小。而采用该体系可以有效解决乙酸铵在甲醇中灵敏度的问题,故后续实验采用体系③进行。
3.3 进样量选择
进样量对液相体系影响较大,特别是其中涉及到的溶剂效应。实验中进行10 μL和5 μL进样量进行研究。结果表明,当进样量为10 μL时,会产生较大的溶剂效应,峰不仅出现裂分,并且出现变形(如图3b所示)。当用甲醇对标样进行稀释或者降低进样量时,峰形得到明显改善(如图3a所示),因此后续实验采用5 μL进行实验。
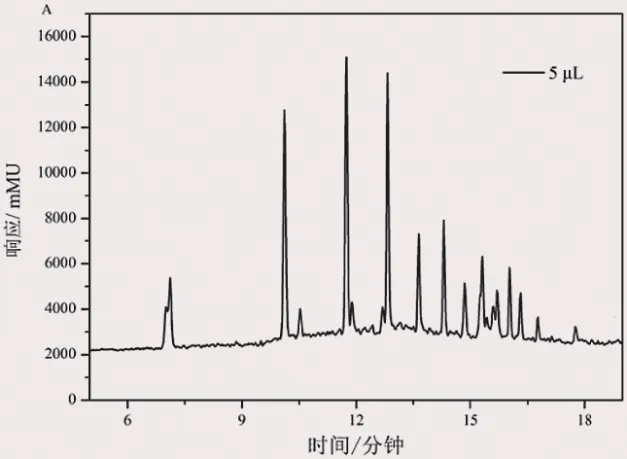
图3a) 进样量为5 μL的色谱图

图3b) 进样量为10 μL的色谱图
3.4 标准曲线的建立
在最优条件下,进行标准曲线的建立,具体结果如表1所示,所有物质的线性相关系数均在0.99以上。
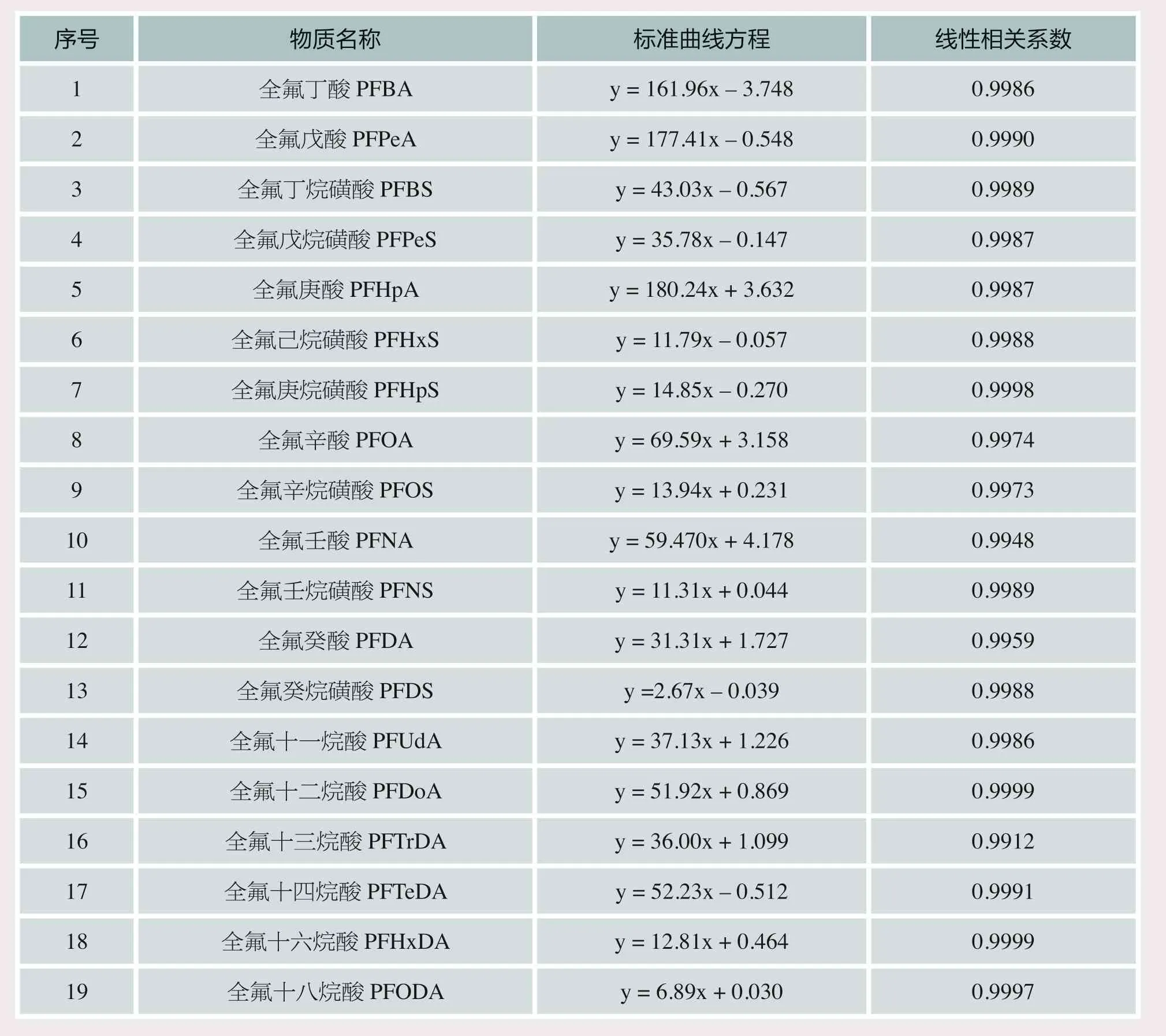
表1 标准曲线建立的具体结果
本文利用液相色谱——串联质谱法对全氟烷基化合物进行检测,着重研究色谱柱、流动相及进样量对色谱峰峰形、出峰时间等的影响,并完成相关检测方法的开发,标准曲线的相关系数均大于0.99。该方法有望为包装印刷材料中全氟烷基化合物检测和筛查提供技术保障和技术支撑,填补相关技术空缺。
猜你喜欢 质谱法液相甲醇 高效液相色谱法测定纺织品中的羟脯氨酸含量纺织标准与质量(2022年1期)2022-07-12固相萃取-高效液相色谱法测定水产品中四环素类的含量当代水产(2022年4期)2022-06-05硅胶吸附管采集甲醇汽车尾气排放中甲醇的方法研究汽车实用技术(2022年4期)2022-03-07浅谈天然气制甲醇与煤制甲醇的区别E动时尚·科学工程技术(2019年11期)2019-09-10多接受电感耦合等离子质谱法准确测定天然地质样品中的锂同位素组成分析化学(2019年3期)2019-03-30全蒸发顶空—气相色谱—质谱法快速测定塑料玩具中的致敏性芳香剂分析化学(2018年8期)2018-11-01气相色谱-质谱法检测食品中的丙烯酰胺食品界(2018年8期)2018-09-03光化学反应—串联质谱法鉴定细胞中不饱和卵磷脂双键的位置分析化学(2017年12期)2017-12-25窄内径多孔层开管柱的制备及在液相色谱中的应用分析化学(2017年12期)2017-12-25低温甲醇洗装置甲醇消耗高原因与应对措施进出口经理人(2017年7期)2017-09-20本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0427/590235.html




