【www.zhangdahai.com--其他范文】
张子杭, 成元华, 2, 李小梅
胃癌起源于胃表层黏膜[1-2]。侵袭和转移是病人死亡的主要原因[3]。胃癌的发病率逐年升高, 在全球癌症死亡率中排第二[4], 但其确切发病机制仍未完全阐明。研究发现转化生长因子-β(transforming growth factor-β, TGF-β)信号通路参与了胃癌的发生发展[5], 胃癌病人TGF-β1(TGF-β通路激活剂)的高表达可能与病人预后差相关[6-7]。当给予外源性TGF-β1时, 肿瘤细胞的生长速度、侵袭能力和转移能力均增加[8]。TGF-β1通过促进肿瘤间质中血管的生长从而增强胃癌细胞侵袭能力, SB431542可抑制激活素受体样激酶(activin receptor-like kinase, ALKs)活力, 是ALK家族中ALK-5(TGF-βI型受体)的有效抑制剂, SB431542使胞内信号蛋白Smad2和Smad3不能被激活, 进一步抑制其磷酸化过程, TGFβ信号通路因此被阻断。TGF-β信号通路已被证实参与体内上皮-间充质转化(endothelial-mesenchymal transition, EMT)的激活[9]。TGF-β信号转导通路通过Smads的中间传导, 使信号得以从细胞外部传入到细胞内部, 是TGF-β信号通路传导的关键。相关研究提示, EMT诱导转录因子Slug在高分化胃癌中低表达, 在低分化胃癌中高表达, 而上皮钙黏素(E-cadherin, E-cad)的表达则与之相反, 不难推测胃癌恶性程度与slug蛋白的表达程度成正比, 而与E-cad表达程度成反比。本研究于2021年1月至2022年1月, 旨在探讨TGF-β信号通路对胃癌HGC-27细胞增殖侵袭能力、slug和E-cad蛋白表达的影响, 以期进一步为阐明胃癌的发病机制, 充实实验依据。
1.1 材料
1.1.1 细胞系及细胞培养相关试剂 胃癌HGC-27细胞系购自上海传秋生物公司;
细胞培养相关试剂购自KATAWA。
1.1.2 实验主要试剂 TGF-β1购自美国Enzo, TGF-β通路阻滞剂SB-431542购自MedChemExpress, 二甲基亚砜(DMSO)购自Solarbio Technology公司, 细胞计数试剂盒(CCK-8)购自大连美伦生物科技公司, 酶联免疫吸附测定(ELISA)试剂盒购自上海康朗生物科技公司, RIPA细胞裂解液购自索莱宝科技公司。
1.2 实验方法
1.2.1 细胞培养 配置88%RPMI 1640+11%胎牛血清(FBS)+1%双抗体成分的完整细胞培养基(KATAWA有限公司), 在37 ℃、5%二氧化碳恒温培养箱中培养。
1.2.2 体外实验分组 根据对细胞给药不同进行分组:(1)空白对照组:仅使用等量常规培养基;
(2)激 动 剂 组:TGF-β1(25 μg/L);
(3)阻 断 剂 组:SB431542(2 mg/L);
(4)激动剂+低浓度阻断剂组:TGF-β1(25 μg/L)+SB431542(2 mg/L);
(5)激动剂+高浓度阻断剂组:TGF-β1(25 μg/L)+SB431542(4 mg/L)。
1.2.3 CCK-8检测体外细胞增殖活性 培养胃癌细胞系HGC-27后, 共分为五组, 每组设置5个复孔。使用CCK-8试剂盒检测细胞增殖活性, 在96孔板中配置100 μL细胞悬液。将培养板放入37 ℃, 5%二氧化碳培养箱中培养24 h。根据分组情况, 每孔加入试剂10 μL, 分别于0、6、12、24、48和72 h时行CCK-8法检测。测量450 nm处的吸光度。
1.2.4 Transwell侵袭实验检测细胞侵袭能力 配置基质胶, 使其达到基质胶∶PBS=1∶8的比例, 将人胃癌HGC-27细胞以5×104个/孔的密度接种于96孔培养板中, 置于细胞培养箱中培养24 h后, 按照分组加入药物, 在Transwell小室的上室膜上用棉签均匀涂抹预先配置好的基质胶, 37 ℃条件下放置30 min, 小室的下室中加入500 μL完全培养基, 上室中加入200 μL按照分组处理后的细胞悬液(无血清)。37 ℃过夜, 弃去孔中培养液, 使用PBS润洗2遍, 用棉签轻轻擦去上层未迁移细胞, 甲醛固定30 min, 将小室适当风干。用0.1%结晶紫染色30~60 min, 用PBS洗3遍。用棉签轻轻擦掉上室水分。于倒置显微镜下观察计数。
1.2.5 ELISA试剂盒检测不同组细胞slug和E-cad蛋白表达情况 使用PBS清洗培养瓶中的细胞, 冰浴条件下加入300 μL RIPA细胞裂解液, 反复铺匀10 min, 刮取细胞后转移至冰浴下的离心管中吹打数次, 持续裂解10 min, 裂解完成后12 000g, 4 ℃, 离心5 min, 吸取上清, 上清液使用ELISA试剂盒检测, 标准孔各加50 μL不同标准浓度;
分别设置待测空白孔和样品孔。稀释后, 样品的最终稀释度为5倍。加入100 μL酶标试剂, 密封避光, 37 ℃孵育60 min, 弃去液体, 洗涤5次, 显色后在450 nm波长处测量各孔的吸光度。根据试剂盒说明书绘制标准曲线从而计算各组细胞总蛋白中slug和E-cad蛋白浓度。
1.3 统计学方法采用SPSS 16.0软件进行统计分析。计量资料以±s表示, 多组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2.1 TGF-β通路对HGC-27细胞体外增殖活性的影响使用CCK-8对细胞进行增殖活性检测后, 结果显示:在12 h内, 各组之间增殖能力几乎没有差别(P>0.05);
24 h后激动剂组细胞增殖能力强于空白对照组(P<0.05);
阻断剂组细胞增殖活性在24 h后低于空白对照组(P<0.05);
激动剂+高浓度阻断剂与激动剂+低浓度阻断剂两组的细胞增殖活性在24 h内与空白对照组相比较, 差异无统计学意义(P>0.05), 在24 h后两组增殖活性出现明显下降, 但与空白对照组相比较, 差异无统计学意义(P=0.181)。见表1。
表1 TGF-β通路促进胃癌HGC-27细胞增殖活性/±s
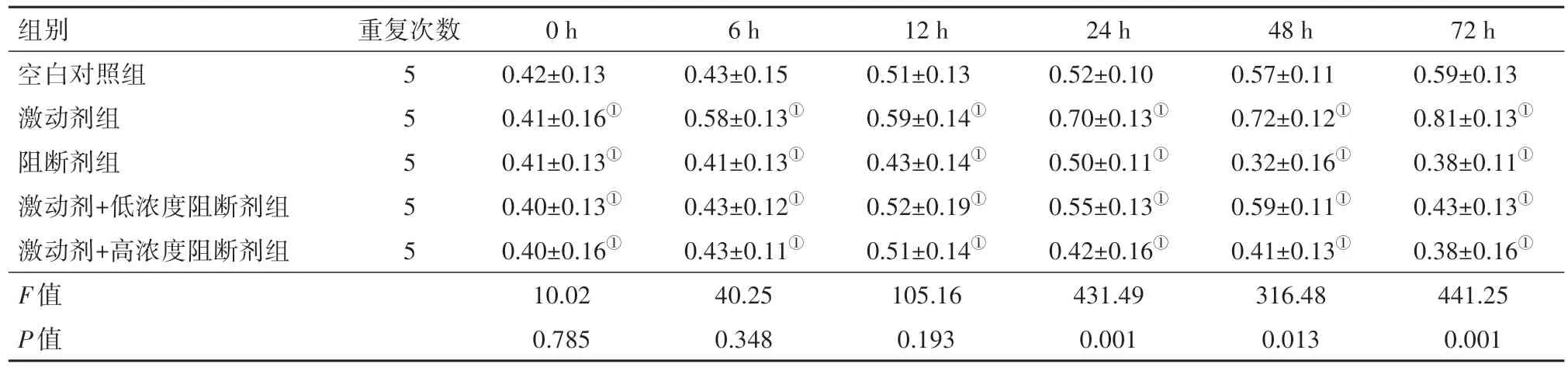
表1 TGF-β通路促进胃癌HGC-27细胞增殖活性/±s
注:TGF-β为转录生长因子β。①与空白对照组比较,P<0.05。
组别空白对照组激动剂组阻断剂组激动剂+低浓度阻断剂组激动剂+高浓度阻断剂组F值P值重复次数5 5 5 5 5 0 h 0.42±0.13 0.41±0.16①0.41±0.13①0.40±0.13①0.40±0.16①10.02 0.785 6 h 0.43±0.15 0.58±0.13①0.41±0.13①0.43±0.12①0.43±0.11①40.25 0.348 12 h 0.51±0.13 0.59±0.14①0.43±0.14①0.52±0.19①0.51±0.14①105.16 0.193 24 h 0.52±0.10 0.70±0.13①0.50±0.11①0.55±0.13①0.42±0.16①431.49 0.001 48 h 0.57±0.11 0.72±0.12①0.32±0.16①0.59±0.11①0.41±0.13①316.48 0.013 72 h 0.59±0.13 0.81±0.13①0.38±0.11①0.43±0.13①0.38±0.16①441.25 0.001
2.2 使用Transwell侵袭实验检测体外培养人胃癌HGC-27细胞侵袭能力变化各组细胞使用药物处理24 h后, 于倒置显微镜下观察到, 细胞穿过小室膜的细胞数量激动剂组多于空白对照组, 阻断剂组低于空白对照组, 均差异有统计学意义(均P<0.05);
而激活剂+高浓度阻断剂组和激活剂+低浓度阻断剂组与空白对照组相比较, 差异无统计学意义(P=0.179)。见表2。
表2 TGF-β通路激活和阻断后胃癌HGC-27细胞侵袭能力的变化/(个,±s)

表2 TGF-β通路激活和阻断后胃癌HGC-27细胞侵袭能力的变化/(个,±s)
注:TGF-β为转录生长因子β。①与空白对照组比较,P<0.05。
组别空白对照组激动剂组阻断剂组激动剂+低浓度阻断剂组激动剂+高浓度阻断剂组F值P值重复次数5 5 5 5 5细胞迁移数117.81±3.11 227.45±5.46①68.47±3.36①113.84±5.21①115.19±5.12①479.15 0.001
2.3 ELISA检测体外培养HGC-27细胞的slug和E-cad蛋白的表达情况激动剂组的slug蛋白表达水平高于空白对照组(P=0.001);
阻断剂组slug蛋白表达水平低于空白对照组和激动剂组(P<0.000 1);
激动剂+高浓度阻断剂组slug蛋白表达水平低于激动剂组(P=0.009)。激动剂组E-cad蛋白水平低于空白对照组(P<0.000 1);
阻断剂组E-cad蛋白浓度高于其他组(P<0.000 1)。见表3。
表3 TGF-β通路激活促进slug蛋白表达并抑制E-cad表达/±s
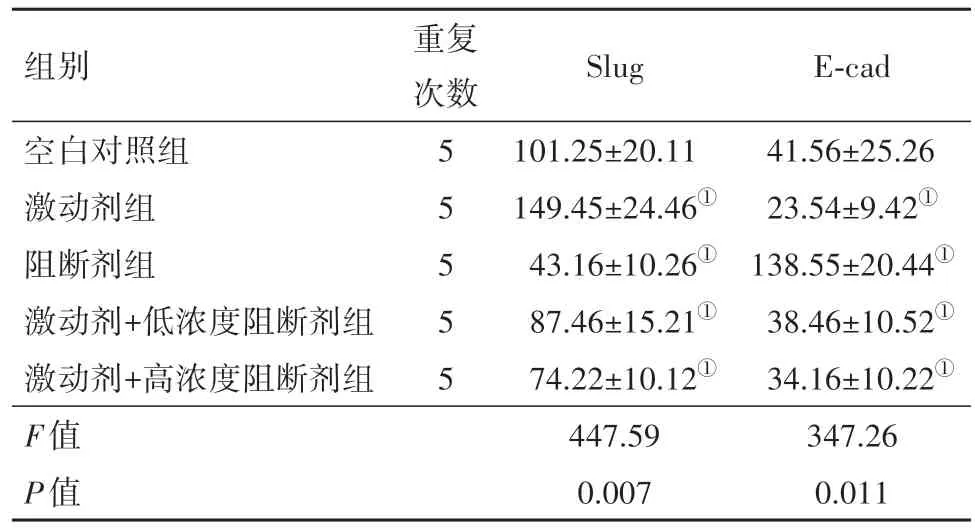
表3 TGF-β通路激活促进slug蛋白表达并抑制E-cad表达/±s
注:TGF-β为转录生长因子β, slug为slug蛋白, E-cad为上皮钙黏素。①与空白对照组比较,P<0.05。
组别空白对照组激动剂组阻断剂组激动剂+低浓度阻断剂组激动剂+高浓度阻断剂组F值P值重复次数55555 Slug 101.25±20.11 149.45±24.46①43.16±10.26①87.46±15.21①74.22±10.12①447.59 0.007 E-cad 41.56±25.26 23.54±9.42①138.55±20.44①38.46±10.52①34.16±10.22①347.26 0.011
TGF-β信号转导通路在不同肿瘤中都通过EMT促进肿瘤发生、转移[10], 相关研究表明, 激活该信号通路后, 上皮细胞获得侵袭特性[11], 其生长速度和转移能力得到提高[12]。在TGF-β信号通路中, Smads蛋白家族界导了TGF-β信号从细胞外进入细胞核的过程[13], 从而诱导肿瘤细胞EMT的进展, 调节肿瘤细胞增殖、分化、凋亡、衰老、迁移等[14]。
EMT主要特征是上皮细胞标志物E-cad表达降低[15], 正常生理条件下, E-cad表达于各类正常上皮细胞[16], 在维持细胞的极性和组织结构的完整性中起重要作用[17]。slug是诱导EMT发生的一种转录因子, 同时也是E-cad的上游转录因子[18], 相关研究中发现, slug转录因子的表达情况往往与E-cad表达情况相反。
本实验使用研究较少的人胃癌HGC-27细胞系, 丰富了TGF-β通路研究的实验基础, 旨在通过外源性药物激活和阻断TGF-β信号通路, 观察胃癌细胞在体外增殖和侵袭能力的变化以及EMT过程中相关基因slug与E-cad的蛋白表达水平的变化。
最新研究结果显示, 纺锤体蛋白 1(SPIN1)的表达情况与密封蛋白1(Claudin-1)成反比[19], 而 Claudin-1本身是上皮细胞中slug家族的直接下游靶基因[20]。因此可推测SPIN1蛋白通过作用于slug蛋白而调节Claudin-1的表达, Claudin-1蛋白的表达与EMT具有相当紧密的关系, 而EMT的发展过程与Ecad和N-cad的蛋白表达具有直接关系[21], 因此可以认为, SPIN1蛋白与E-cad和N-cad蛋白在促癌过程中以某种方式相互作用, 具体作用方式目前尚未知晓, 而slug蛋白的表达在其中具有重要作用[22]。
相关研究显示, 30%的胃癌组织均显示出slug表达呈阳性[23], 而在之后的研究中显示约75%的胃癌病人均存在slug表达阳性[24]。这两项研究结果存在较大差异的原因可能是:后者的研究中包含了更多的晚期胃癌病人。在早期的研究中, 大约60%的病人处于Ⅰ期, 而后者的研究中只有大约30%的病人处于Ⅰ期。提示slug在一定程度上可用于判断胃癌的发展情况。slug在EMT诱导中具有公认的作用[25], 因此本实验研究了slug蛋白表达情况与E-cad蛋白的表达关系。
本研究发现:使用TGF-β通路激活剂TGF-β1激活该通路后, slug蛋白表达上升, 而E-cad蛋白表达下降, 肿瘤细胞增殖与侵袭能力均上升。使用TGFβ通路阻断剂SB431542阻断该通路后, slug蛋白表达下降, 而E-cad蛋白表达水平上升, 肿瘤细胞的增殖与侵袭能力均下降。在激动剂+低浓度阻断剂和激动剂+高浓度阻断剂组两组中, 随阻断剂浓度的提高, 通路的激动效果下降, 激动剂+高浓度阻断剂组的slug蛋白表达水平低于激动剂+低浓度阻断剂组, 而E-cad蛋白表达水平高于激动剂+低浓度阻断剂组;
肿瘤细胞的增殖与侵袭能力也低于激动剂+低浓度阻断剂组。从而可见:阻断与激活TGF-β通路能够改变slug与E-cad蛋白的表达情况, 随slug蛋白与E-cad蛋白表达情况发生改变, 肿瘤的增殖与侵袭能力发生改变, 说明在该通路中slug与E-cad两种蛋白之间呈负相关, 且TGF-β通路激活水平与细胞增殖和侵袭能力成正比。
以往研究发现TGF-β1具有能够促进胃癌SGC-7901细胞系增殖能力的作用[26], 肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)是体内TGF-β1的主要来源[27], 耗竭TAMs后, TGF-β1的数量下降约7倍, 而肿瘤细胞的增殖能力显著下降[28], 但具体作用机制仍然不清楚。slug在恶性肿瘤中过度表达, 并能上调细胞内血管内皮生长因子(vascular endothelial growth factor, VEGF)表达, 干扰slug能起到抑制胃癌血管生成的作用[29]。本研究观察到, 使用TGF-β1激活TGF-β通路后, slug蛋白表达显著升高, 并增强了胃癌HGC-27细胞的增殖能力, 而在阻断TGF-β通路后细胞增殖活性明显下降, slug蛋白表达下降, 可以推测TGF-β1是通过激活TGF-β通路, 促进血管生成从而增强细胞增殖活性。
Matrigel在Transwell侵袭实验中充当了体内ECM的作用, 细胞穿过小室膜不仅仅反映了细胞的运动能力, 同时也反映了其分泌MMPS溶解ECM的能力。本研究使用Transwell侵袭实验检测人胃癌HGC-27细胞的侵袭能力时, 激动剂组的细胞相较于其余各组均发挥出了较强的侵袭能力。同时测得激动剂组细胞E-cad表达下降, 推测当使用TGF-β1激活通路后, E-cad表达的下降不仅会导致细胞失去极性、降低细胞连接稳定性[30], 同时还会使胃癌细胞分泌更多的MMPS[31], 溶解掉ECM, 从而增强了胃癌细胞的侵袭能力。
在使用CCK-8检测人胃癌HGC-27细胞的增殖能力时, 我们发现所有组别的HGC-27细胞在起初24 h均表现为快速增殖, 而添加了阻断剂组的细胞在接下来的48 h和72 h表现为增殖活性的明显下降, 可能提示SB431542的起效时间往往需要24 h以上。预实验中发现:当TGF-β1浓度高于40 μg/L和低于10 μg/L时, 激动剂组HGC-27细胞的增殖活性不增高反而降低, 这意味着较高和较低浓度的TGFβ1可抑制胃癌细胞增殖, 提示TGF-β1的作用效果与浓度相关。在激动剂TGF-β1(50 μg/L和10 μg/L)+阻断剂SB431542(2 mg/L)的非最佳浓度组中, 观察到TGF-β1和SB431542共同抑制细胞增殖, 且其抑制程度大于SB431542(2 mg/L)单药组, 提示TGF-β1在某些浓度下可与SB431542共同作用从而阻断TGF-β通路并抑制人胃癌HGC-27细胞的增殖。
综合本研究和文献报道可知, 当TGF-β通路被激活后, 活化的TGF-β受体1将Smad2和Smad3磷酸化, 磷酸化的Smad2和Smad3与Smad4组装成异二聚体和三聚体复合物, 然后进入细胞核[32], 直接与slug的启动子结合以诱导其转录, 促使slug结合E-cad基因CDH1的启动子, 抑制E-cad蛋白的编码而促进EMT的进展, 导致N-cad的表达上升、E-cad的表达下降, TGF-β信号通路可改变slug和E-cad蛋白的表达情况, 从而调节胃癌细胞增殖和侵袭能力, 而TGF-β1和SB431542在体外实验中发挥的作用与药物剂量和二者间相互作用有关。
猜你喜欢 阻断剂低浓度激动剂 水环境中低浓度POPs的控制技术研究进展资源节约与环保(2022年8期)2022-09-20爱眼有道系列之三十二 用低浓度阿托品治疗儿童近视,您了解多少基层中医药(2020年8期)2020-11-16绿萝花中抗2型糖尿病PPARs激动剂的筛选中成药(2018年10期)2018-10-26GPR35受体香豆素类激动剂三维定量构效关系研究天然产物研究与开发(2018年6期)2018-07-09环境中的β-阻断剂及其在污水处理中的工艺研究四川农业科技(2018年6期)2018-03-17An Error Estimator for the Finite Element Approximation of Plane and Cylindrical Acoustic Waves.Computer Modeling In Engineering&Sciences(2015年14期)2015-12-13AMPK激动剂AICAR通过阻滞细胞周期于G0/G1期抑制肺动脉平滑肌细胞增殖医学研究杂志(2015年5期)2015-06-10改良长效低浓度骶管阻滞用于药物中期引产43例中国药业(2014年19期)2014-05-17微丝解聚剂及微管阻断剂对藓羽藻细胞重建过程的影响中国海洋大学学报(自然科学版)(2014年12期)2014-02-28低浓度氯气综合利用的探讨中国氯碱(2014年11期)2014-02-28本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0903/648843.html




