【www.zhangdahai.com--其他范文】
欧阳先进 康 旭 郭婷婷 刘悦萍 常明明
北京农学院生物与资源环境学院,农业农村部华北都市农业重点实验室,北京 102206
介孔二氧化硅纳米粒(mesoporous silica nanoparticles,MSNs)一般<500 nm,由于具有有序介孔结构、比表面积大、孔隙大小可调的特点而引起广泛关注。介孔二氧化硅在多个领域显现出广泛的应用价值,如药物输送[1]、生物成像[2]、生物传感[3]、生物催化[4]、支架工程[5]等。
介孔二氧化硅负载药物后可有效提高药物在体内的生物利用度,增加药物靶向性,负载荧光分子后可清晰观测到药物在细胞内部转运路径。因此,介孔二氧化硅在肿瘤、糖尿病、成像等领域表现出广泛的应用前景。此外,由于介孔二氧化硅表面易于修饰,使药物在体内的环境刺激释放成为可能。随着研究的深入,介孔二氧化硅作为基质材料的多功能刺激响应纳米载体在药物控释领域的研究取得了巨大进步[6]。本文从介孔二氧化硅表面是否被修饰介绍其在药物控制释放领域的应用。
多药耐药蛋白对药物的外排作用是药物输送过程的主要屏障之一。Jia 等[7]将紫杉醇和中药抗癌成分负载进介孔二氧化硅,有效克服了多药耐药蛋白对药物的外排作用。Xiong 等[8]构建了双药负载脂质纳米颗粒用于控制药物的释放。Fe3O4@mSiO2-DOX 磁性纳米粒子,在外加磁场的作用下可有效诱导癌细胞凋亡,促进介孔二氧化硅在靶向药物载体等领域的应用[9]。
介孔二氧化硅作为药物载体在生理条件下药物突释效果明显。将功能分子修饰到介孔二氧化硅表面,可提高药物靶向性,增加介孔二氧化硅环境刺激响应性,有效避免药物的突释现象。采用纳米阀门的方法可实现介孔二氧化硅对药物分子的控制释放。根据纳米阀门的组成和形状不同,可分为有机小分子、无机纳米粒子、环状分子等。
2.1 有机小分子
在无机纳米粒子表面修饰具有刺激响应功能的官能团封堵MSNs 内部的药物,通过细胞内外环境的刺激,实现药物释放。葡萄糖酸改性胰岛素引起环磷酸腺苷的连续传送刺激胰岛素分泌[10]。Mal 等[11]将香豆素修饰在MSNs 表面,当表面被照射310 nm 以上的紫外光时,香豆素形成二聚体,将药物封装在介孔材料内部;
当照射波长低于250 nm 时,二聚体解聚释放药物,该动态可逆过程实现了光控药物释放。Liu 等[12]在MSNs 表面引入伯胺和仲胺官能团,实现了药物的pH 响应控制释放。Pan 等[13]利用MSNs 表面原位合成超薄ZIF-8 膜,可在酸性内溶酶体中分解并触发siRNA和化学治疗药物在细胞内的释放,从而显著增强对耐药癌细胞的治疗效果(图1)。Chang 等[14]采用聚多巴胺对负载去郁敏的MSNs 表面进行修饰,设计得到pH敏感的MSNs 控释给药体系,同时聚多巴胺自身对肿瘤组织具有良好的光热治疗效果,为肿瘤组织的靶向治疗提供了新的思路(图2);
Guo 等[15]在此基础上,通过MSNs 负载甲氨蝶呤通过局部经皮给药的方式治疗类风湿性关节炎,治疗效果更加稳定(图3)。

图1 超薄ZIF-8 膜封装的介孔二氧化硅siRNA 和药物释放模拟图[13]

图2 MSNs-DES-PDA 示意图及透射电镜图[14]

图3 MTX-mSiO2@PDA 控释给药系统释药过程示意图[15]
2.2 无机纳米粒子
对MSNs 表面修饰巯基DNA 和银纳米粒子,将药物封装在介孔内部,当该体系遇到谷胱甘肽时,银纳米粒子脱落,实现谷胱甘肽响应药物控制释放[16]。硼酸酯键在介孔二氧化硅表面修饰超顺磁性四氧化三铁,通过pH 值变化实现介孔开关的可逆切换[17]。同样,氨基对纳米介孔二氧化硅表面进行功能化修饰后,以CD44 为靶向受体实现对结肠癌的治疗[18]。将顺磁性Gd2O3与DOX 共同加载到MSNs 中,制备得到pH敏感和高性能MR 成像功能的治疗型纳米载体[19]。石墨烯量子点和MSNs 组成的GQDs-MSNs 复合纳米颗粒可监测载体的细胞内定位和药物从载体的释放途径,并具有对pH 和温度依赖的释放行为[20]。Liu 等[21]采用缩醛官能团将金纳米粒子键接到MSNs 表面,制备具有pH 响应性的药物控制释放体系(图4)。
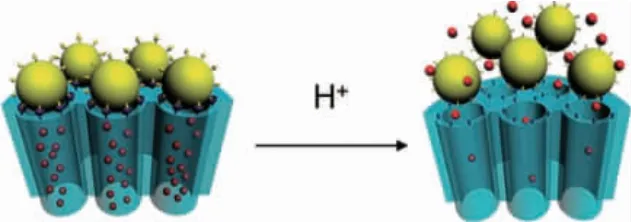
图4 金纳米粒子通过缩醛封装于介孔二氧化硅表面制备的pH 敏感门控系统[21]
2.3 环状分子
环状分子通过与其他分子相互作用,可实现介孔二氧化硅纳米载药体系的进一步功能化。目前,引入环状分子的方法主要有两种:一种是在介孔二氧化硅表面修饰小分子;
另一种是通过具有刺激相应性的基团将环状分子连接在介孔二氧化硅表面。通过组装具有环境刺激响应功能的环状分子封闭介孔二氧化硅,在控制药物释放的同时提高了药物靶向性。例如,由于肿瘤和炎症组织比正常组织和血液中的酸性更强,靶细胞内较低的pH 值被用于触发pH 敏感药物分子从介孔二氧化硅体系内的释放[22],在介孔二氧化硅表面修饰β-环糊精分子并将阿霉素封装在体系内部,在pH 较低的肿瘤细胞内阿霉素迅速从体系中释放出来[23]。将介孔二氧化硅表面进行琥珀酸-β-乳球蛋白修饰后,药物在胃部被封闭在介孔二氧化硅里,pH 响应部分在小肠部精准释放药物[24]。将β-环糊精分子引入邻苯二酚,酸性条件下硼酸酯键水解及葡萄糖与苯硼酸较强的结合力,实现了pH 和葡萄糖双重相应控制药物释放[25]。此外作为介孔二氧化硅的纳米阀门还有树枝状纳米阀门、聚合物膜纳米阀门、脂质体纳米阀门等。
介孔二氧化硅载药体系的稳定性一直是研究者关心的课题。人们通过各种努力以期减少介孔二氧化硅在体内的聚集,提高其在血液中的稳定性。通过对纳米颗粒表面包覆聚合物涂层和修饰带电基团有效减少了颗粒聚集,明显改善了介孔二氧化硅在血液中的稳定性[26]。Bernardos 等[27]将介孔二氧化硅表面进行磷酸基修饰,提高了介孔二氧化硅在溶液中的稳定性和分散性,阻滞颗粒间聚集。一般情况下,介孔二氧化硅溶解速率取决于粒径、官能化、二氧化硅缩合程度和孔结构。非官能化的介孔二氧化硅在模拟体液生理条件下表面溶解相当迅速并且产生可溶性的无毒硅酸类似物。表面官能化可避免介孔二氧化硅快速降解并提高介孔二氧化硅在生物体内的长期稳定性。Ashley 等[28]在介孔二氧化硅表面修饰聚乙二醇提高了MSNs 在水中的稳定性及较好的单分散性,同时减少了生理条件下蛋白等成分对纳米颗粒的非特异性吸附。这样的聚合物涂层为二氧化硅表面提供了一个保护壳,有效延长了药物在生物体的循环时间。
血液相容性是设计介孔二氧化硅时需要考虑的另一个重要因素。介孔二氧化硅表面功能修饰后,能够减少甚至完全防止形成血栓及非特异性蛋白质对介孔二氧化硅表面的吸附作用。例如,Akinc 等[29]设计了负载肝素的核-壳结构的介孔二氧化硅。由于肝素是高度硫酸化的阴离子多糖,具有显著的抗凝血特性,将多功能核-壳结构的介孔二氧化硅纳米系统负载肝素后,起到了较好地预防凝血效果,同时表现出优良的胶体稳定性。因此,介孔二氧化硅表面经过修饰后在改进生物相容性和血液相容性方面具有广泛的应用潜力。
介孔二氧化硅在药物输送领域的广阔应用前景已经引起越来越多研究者的重视。人们希望通过对其表面的修饰提高介孔二氧化硅的生物相容性和生物降解性,并将药物分子有效地包封在其大小可调的介孔内部。与其他药物载体比较,介孔二氧化硅具有较高负载能力、高稳定性,并保护药物分子免受机体内酶或蛋白的作用而提高药物的生物利用度,在药物控缓释和靶向释放领域具有重要的研究意义。但是介孔二氧化硅在药物输送领域仍然存在一些问题。主要体现在以下几个方面:①MSNs 的生物相容性问题,如细胞毒性、生物降解性、血液相容性,目前并没有进行系统的研究;
②介孔二氧化硅口服和注射给药后其在血液中的稳定性,在血液中的循环情况也没有进一步的研究数据;
③介孔二氧化硅在细胞内转运机制并没有进行深入研究;
④对介孔二氧化硅的生物分布和清除的药物动力学研究也并不深入,无法证实介孔二氧化硅在体内毒性和生物相容性与体内残留的相关问题。基于以上四点,介孔二氧化硅载药系统应用于临床治疗还有一段很长的路。尽管如此,人们对介孔二氧化硅在药物输送领域的探索并未停止。最近的研究主要集中在多功能介孔二氧化硅的诊疗一体化方面的应用,通过使用纳米载体的诊断信息来控制或调整药物释放达到靶向治疗作用。我们相信开发质量可控、生物相容性好、载药量高的介孔二氧化硅仍将是未来介孔材料研究的热点和趋势。





