【www.zhangdahai.com--其他范文】
凌 敏,施伟庆,张 薇,梁 婕
(江苏省疾病预防控制中心毒理与风险评估研究所,江苏 南京 210009)
谷胱甘肽(glutathione,GSH)是由谷氨酸、半胱氨酸和甘氨酸组成的一种三肽,是甘油醛磷酸脱氢酶的辅基,又是乙二醛酶及磷酸丙糖脱氢酶的辅酶[1]。还原型谷胱甘肽是人体内自身合成的一种活性成分,具有酶活性和抗氧化活性,是体内重要的自由基清除剂[2]。临床上还原型谷胱甘肽已经广泛用于多种疾病的治疗。维生素C(vitamin C,Vit.C)系脯氨酸羟化酶等8种酶的辅助因子或组成成分,直接参与体内的氧化-还原及羟化反应[3]。Vit.C作为一种抗氧化剂,除了可以保护细胞免受有害因素所引起的氧化性损伤外,在机体的新陈代谢中包括蛋白质的修饰、基因的表达以及生物防御功能的激活等均起着重要作用[4]。
本产品谷胱甘肽Vit.C片作为一种护肝片,对化学性肝损伤有一定的保护作用。本文根据2003年版《保健食品检验与评价技术规范》,进行30天喂养试验,通过观察大鼠的一般表现、血液学及血生化指标、组织病理学改变等对其进行安全性评价。为谷胱甘肽Vit.C片的进一步开发应用提供毒理学数据。
1.1 实验动物
4周龄SD大鼠80只,雌雄各半,购自北京维通利华实验动物技术有限公司。动物生产许可证号SCXK(京)2016-0011;
屏障环境实验动物使用许可证号SYXK(苏)2017-0031。实验室温度20~24°C,湿度40%~70%。试验期间动物自由饮水、摄食。
1.2 样品
谷胱甘肽Vit.C片由南京某生物有限公司提供,生产批号2016062303。成人(体质量以60 kg计)推荐剂量为每人1 000 mg/d,即16.67 mg/(kg·d)。
1.3 主要试剂和仪器
生化试剂盒(宁波美康生物科技股份有限公司),全自动生化分析仪(日本Olympus公司),ADVIA®2120血细胞分析仪(德国Siemens公司),RM-2245病理切片机(德国Leica公司)。
1.4 实验动物分组及处理
大鼠适应性喂养3 d后随机分为低、中、高剂量组(分别为417、834、1 667 mg/kg,相当于人体推荐剂量的25、50、100倍)和对照组(灭菌基础饲料)。按剂量组设计要求分别称取83、167和333 g的谷胱甘肽Vit.C片加入至2 kg基础饲料中混匀后制成颗粒饲料,再以每日约100 g/mg的摄食量给于大鼠自由食用,连续喂养30 d。期间每天观察动物的一般表现,每周记录大鼠体质量、进食量,并与对照组比较。
1.5 血清生化和血液学指标检测
喂养30天后,用10%水合氯醛麻醉大鼠,腹主动脉采血,进行血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总蛋白(TP)、白蛋白(ALB)、血糖(GLU)、尿素氮(BUN)、肌酐(CRE)、总胆固醇(CHO)、甘油三酯(TG)等血清生化指标检测和血红蛋白(HGB)、血小板(PLT)、红细胞(RBC)、白细胞(WBC)总数及中性粒细胞(NE)、淋巴细胞(LY)、单核细胞(MO)、嗜酸性粒细胞(EO)、嗜碱性粒细胞(BA)分类等血液学指标检测。
1.6 组织病理学检查
采血结束后颈椎脱臼法处死大鼠,对各主要脏器进行大体观察,取肝、脾、肾、胃、睾丸或卵巢称量并计算脏器系数(脏器系数=脏器质量/体质量×100%),脏器以10%甲醛固定后进行组织病理学检查。
1.7 统计分析
实验结果数据以±s表示。采用SPSS 16.0软件进行单因素方差分析(One Way ANOVA);
若方差不齐,采用Kruskal-Wallis秩和检验。以P<0.05为差异具有统计学意义。
2.1 谷胱甘肽Vit.C片对大鼠体质量的影响
试验期间,各剂量组大鼠的生长发育良好,一般表现和行为均未见异常,亦无死亡情况;
各剂量组雌雄大鼠多个观察点的体质量和总体质量增量与对照组相比,差异均无统计学意义(P>0.05)。见表1。
表1 谷胱甘肽Vit.C片对大鼠体质量的影响(g,±s,n=10)

表1 谷胱甘肽Vit.C片对大鼠体质量的影响(g,±s,n=10)
性别雌性雄性组别对照组低剂量组(417 mg/kg)中剂量组(834 mg/kg)高剂量组(1 667 mg/kg)对照组低剂量组(417 mg/kg)中剂量组(834 mg/kg)高剂量组(1 667 mg/kg)第0天74±4 73±4 74±4 74±4 78±6 77±6 78±6 77±6第7天121±8 123±4 124±8 121±6 142±8 145±11 141±10 142±10第14天164±7 164±8 170±17 160±10 207±12 214±14 209±9 209±14第21天188±8 190±7 197±18 187±13 273±12 273±14 272±15 272±19第30天223±11 229±14 237±23 220±18 364±20 353±20 353±22 355±30体质量增量148±11 156±16 163±23 145±18 286±21 276±17 275±22 278±26
2.2 谷胱甘肽Vit.C片对大鼠摄食量及食物利用率的影响
由表2和表3可见,对照组相比,雌雄大鼠不同观察点及总的进食量和食物利用率差异均无统计学意义(P>0.05)。
表2 谷胱甘肽Vit.C片对大鼠每周进食量及总进食量的影响(g,±s,n=10)

表2 谷胱甘肽Vit.C片对大鼠每周进食量及总进食量的影响(g,±s,n=10)
性别雌性雄性组别对照组低剂量组(417 mg/kg)中剂量组(834 mg/kg)高剂量组(1 667 mg/kg)对照组低剂量组(417 mg/kg)中剂量组(834 mg/kg)高剂量组(1 667 mg/kg)第1~7天119±10 117±7 120±9 118±9 137±9 137±10 133±14 134±9第8~14天155±12 161±9 164±15 153±12 175±10 182±13 176±11 179±9第15~21天137±7 142±9 139±6 135±7 196±7 189±8 192±9 190±9第22~30天165±8 174±12 174±14 166±14 253±19 244±18 244±15 251±19总进食量576±24 594±29 597±24 572±29 761±21 753±36 745±35 754±30
表3 谷胱甘肽Vit.C片对大鼠食物利用率的影响(%,±s,n=10)
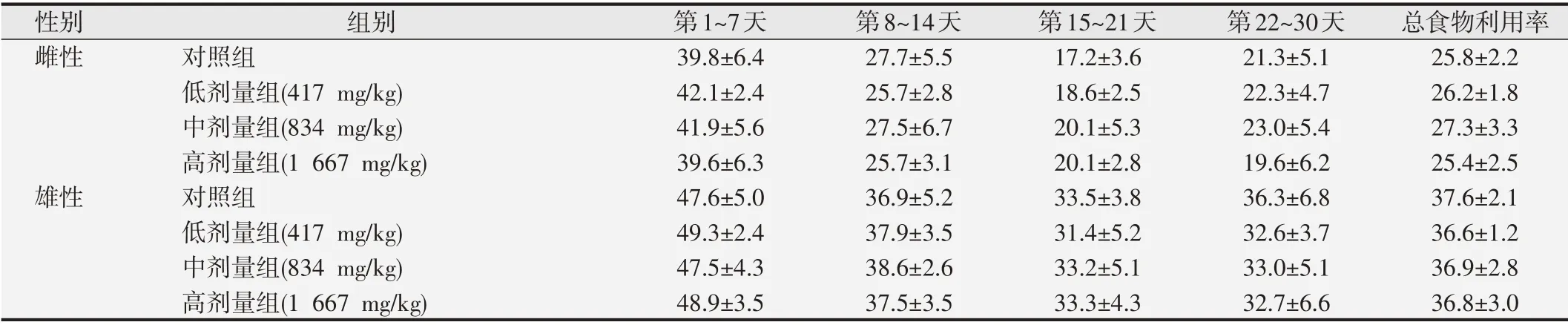
表3 谷胱甘肽Vit.C片对大鼠食物利用率的影响(%,±s,n=10)
性别雌性雄性组别对照组低剂量组(417 mg/kg)中剂量组(834 mg/kg)高剂量组(1 667 mg/kg)对照组低剂量组(417 mg/kg)中剂量组(834 mg/kg)高剂量组(1 667 mg/kg)第1~7天39.8±6.4 42.1±2.4 41.9±5.6 39.6±6.3 47.6±5.0 49.3±2.4 47.5±4.3 48.9±3.5第8~14天27.7±5.5 25.7±2.8 27.5±6.7 25.7±3.1 36.9±5.2 37.9±3.5 38.6±2.6 37.5±3.5第15~21天17.2±3.6 18.6±2.5 20.1±5.3 20.1±2.8 33.5±3.8 31.4±5.2 33.2±5.1 33.3±4.3第22~30天21.3±5.1 22.3±4.7 23.0±5.4 19.6±6.2 36.3±6.8 32.6±3.7 33.0±5.1 32.7±6.6总食物利用率25.8±2.2 26.2±1.8 27.3±3.3 25.4±2.5 37.6±2.1 36.6±1.2 36.9±2.8 36.8±3.0
2.3 谷胱甘肽Vit.C片对大鼠血液学指标的影响
由表4和表5可见,对照组相比,各剂量组大鼠的血常规及白细胞分类值差异均无统计学意义(P>0.05)。说明谷胱甘肽Vit.C片对大鼠的血液学指标未造成明显影响。
表4 谷胱甘肽Vit.C片对大鼠血常规的影响(±s,n=10)

表4 谷胱甘肽Vit.C片对大鼠血常规的影响(±s,n=10)
白细胞(WBC)、红细胞(RBC)、血小板(PLT)、血红蛋白(HGB).
性别雌性雄性组别对照组低剂量组(417 mg/kg)中剂量组(834 mg/kg)高剂量组(1 667 mg/kg)对照组低剂量组(417 mg/kg)中剂量组(834 mg/kg)高剂量组(1 667 mg/kg)WBC/(×109/L)7.7±2.4 7.7±1.4 7.1±1.5 7.9±1.9 8.5±1.7 9.1±1.5 8.8±1.8 8.7±2.0 RBC/(×1012/L)6.6±0.3 6.6±0.2 6.5±0.3 6.6±0.1 6.6±0.2 6.7±0.3 6.6±0.4 6.5±0.3 PLT/(×109/L)1 104±166 1 113±180 1 060±140 1 089±142 1 112±121 1 061±113 1 120±137 1 152±128 HGB/(g/dL)11.8±0.5 11.8±0.5 11.7±0.6 12.1±0.4 11.9±0.4 11.9±0.6 11.9±0.6 11.8±0.6
表5 谷胱甘肽Vit.C片对大鼠白细胞分类的影响(%,±s,n=10)

表5 谷胱甘肽Vit.C片对大鼠白细胞分类的影响(%,±s,n=10)
中性粒细胞(NE)、淋巴细胞(LY)、单核细胞(MO)、嗜酸性粒细胞(EO)、嗜碱性粒细胞(BA).
BA 0.16±0.08 0.17±0.07 0.18±0.09 0.19±0.07 0.17±0.08 0.16±0.07 0.20±0.05 0.19±0.07性别雌性雄性组别对照组低剂量组(417 mg/kg)中剂量组(834 mg/kg)高剂量组(1 667 mg/kg)对照组低剂量组(417 mg/kg)中剂量组(834 mg/kg)高剂量组(1 667 mg/kg)NE 17.6±4.4 17.5±4.4 17.8±6.6 14.3±4.0 18.6±5.2 17.8±3.8 15.9±3.5 16.8±3.4 LY 76.6±5.2 77.2±5.0 75.5±8.4 79.7±4.8 76.7±5.6 77.5±4.0 78.4±3.9 78.2±3.5 MO 3.2±1.0 2.8±0.7 3.9±0.9 3.3±0.9 3.2±1.1 3.2±0.5 3.9±0.8 3.4±0.8 EO 1.6±0.7 1.3±0.4 1.8±1.5 1.7±1.3 0.6±0.2 0.9±0.3 1.0±0.3 0.8±0.3
2.4 谷胱甘肽Vit.C片对大鼠血生化指标的影响
由表6可见,与对照组相比,高剂量组雄性大鼠BUN值和雌性大鼠CRE值均升高,差异具有统计学意义(P<0.05),但数值仍在本实验室历史正常值范围内。其余各剂量组的多项血生化指标值与对照组相比差异均无统计学意义(P>0.05)。
表6 谷胱甘肽Vit.C片对大鼠部分血生化的影响(±s,n=10)

表6 谷胱甘肽Vit.C片对大鼠部分血生化的影响(±s,n=10)
丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、血糖(GLU)、甘油三酯(TG)、总胆固醇(CHO)、总蛋白(TP)、白蛋白(ALB)、尿素氮(BUN)、肌酐(CRE)。与对照组相比,*P<0.05.
性别雌性雄性组别对照组低剂量组(417 mg/kg)中剂量组(834 mg/kg)高剂量组(1 667 mg/kg)对照组低剂量组(417 mg/kg)中剂量组(834 mg/kg)高剂量组(1 667 mg/kg)ALT/(U/L)41±7 40±8 37±7 42±11 53±9 47±7 46±9 45±8 AST/(U/L)151±21 149±29 150±27 164±36 160±40 137±22 172±16 169±21 GLU/(mmol/L)5.9±0.3 5.9±0.4 5.8±0.4 5.6±0.4 6.2±0.8 6.6±0.3 5.7±0.6 5.7±0.3 TG/(mmol/L)0.85±0.26 0.80±0.39 0.92±0.42 0.78±0.17 1.34±0.52 1.14±0.31 1.37±0.43 0.98±0.37 CHO/(mmol/L)2.39±0.47 2.43±0.49 2.56±0.40 2.63±0.57 2.05±0.17 2.00±0.27 2.11±0.27 2.32±0.27 TP/(g/L)68±4 68±5 67±5 69±5 58±2 57±3 58±2 58±3 ALB/(g/L)40±3 40±3 39±3 40±3 30±1 30±1 31±1 31±1 BUN/(mmol/L)5.3±0.9 5.2±0.7 5.5±0.9 5.7±0.6 4.0±0.5 4.3±0.5 4.4±0.5 4.7±0.5*CRE/(μmol/L)25±2 25±3 26±1 28±4*22±2 21±1 22±2 22±1
2.5 谷胱甘肽Vit.C片对大鼠脏器系数及组织病理的影响
从表7可见,与对照组相比,各剂量组大鼠脏器系数的差异均无统计学意义(P>0.05)。大体检查均未发现各剂量组脏器出现明显异常,高剂量组的各大鼠肝、脾、肾、胃、卵巢或睾丸均未出现与谷胱甘肽Vit.C片有明显相关的组织病理学改变(见图1)。
表7 谷胱甘肽Vit.C片对大鼠脏器系数的影响(%,±s,n=10)

表7 谷胱甘肽Vit.C片对大鼠脏器系数的影响(%,±s,n=10)
*:雌鼠未作卵巢系数检测.
性别雌性睾丸系数*----0.88±0.11 0.86±0.14 0.88±0.13 0.89±0.09雄性组别对照组低剂量(417 mg/kg)中剂量(834 mg/kg)高剂量(1 667 mg/kg)对照组低剂量(417 mg/kg)中剂量(834 mg/kg)高剂量(1 667 mg/kg)肝系数3.68±0.21 3.80±0.34 3.64±0.29 3.68±0.27 3.61±0.22 3.51±0.38 3.52±0.31 3.51±0.32肾系数0.88±0.03 0.88±0.06 0.87±0.06 0.84±0.07 0.86±0.09 0.84±0.05 0.86±0.06 0.86±0.08脾系数0.23±0.04 0.24±0.04 0.26±0.09 0.23±0.03 0.24±0.03 0.24±0.04 0.25±0.03 0.25±0.02

图1 各胱甘肽Vit.C片连续30天喂养后的大鼠组织切片图(×200)
氧化还原状态的失衡在各种疾病的发生发展中均扮演着重要角色,氧化应激反应会引起组织炎症和损伤,谷胱甘肽的主要生理作用之一就是作为体内的一种重要抗氧化剂,可以通过清除或中和人体中产生的各种有害过氧化物质和自由基,从而降低氧化应激反应,起到调节机体免疫及控制炎症的作用[5]。Vit.C作为体内的另一种重要抗氧化剂,可以抑制细胞释放氧、清除细胞内外氧自由基、参与体内氧化-还原及羟化反应,发挥抗氧化作用[6]。Vit.C通过减轻氧化应激反应,促进受损组织细胞的修复[7]。研究表明谷胱甘肽和Vit.C均具有抵抗自由基攻击和脂质过氧化的能力,从而起到保护机体免受外源性有毒物质损害,减少肝脏炎症的作用[8-10]。临床上也常用谷胱甘肽联合Vit.C治疗肝内胆汁淤积症、感染性疾病致肝功能损害、原发性肝癌、酒精性肝病等[11-14]。
本试验通过给予以417、834和1 667 mg/kg剂量(相当于推荐摄入剂量的25、50和100倍)的谷胱甘肽Vit.C片掺入基础饲料中喂养大鼠30天,并且在本实验室试验条件下,该样品30天喂养试验高剂量组雌雄大鼠实际摄入剂量分别达2 095和1 983 mg/kg,相当于推荐摄入剂量的125和118倍,结果显示:各剂量组动物一般情况良好,体质量未发生明显异常改变;
各剂量组雌雄大鼠每周体质量、每周及总进食量、每周及总食物利用率与对照组比较,差异均无统计学意义(P>0.05);
血液学指标及生化指标结果均显示在正常值范围内;
脏器系数及高剂量组主要脏器的组织病理学检查也未见明显异常。结果表明谷胱甘肽Vit.C片在本试验条件下未出现明显的损害效应,具有较好的安全性。





