【www.zhangdahai.com--其他范文】
张腾,江昊
农产品保鲜与食品包装
超声渗透等离子活化水对香蕉切片鲜切品质的影响
张腾,江昊
(西北农林科技大学 食品科学与工程学院,陕西 咸阳 712100)
利用等离子活化水处理香蕉切片不同时间,以达到对香蕉切片护色的目的,并探究贮藏期间的特性变化规律。使用低温等离子体(Cold Plasma, CP)处理去离子水产生等离子活化水(Plasma Activated Water, PAW),超声辅助PAW处理香蕉切片后测定PAW处理对香蕉切片微观结构、贮藏性质、风味物质、酶促褐变关键酶及活性氧水平的变化。与对照组相比,PAW处理增强了贮藏期间多酚氧化酶(Polyphenol Oxidase, PPO)和过氧化物酶(Peroxidase, POD)的活性;
改善了切片的硬度、水分含量、色度值等贮藏特性。激光扫描共聚焦显微镜的荧光结果显示,PAW处理提高了切片细胞中活性氧(Reactive Oxygen Species, ROS)的水平。此外,气相色谱–质谱的结果表明,PAW处理增加了香蕉切片中酯类物质的百分比,而在处理后的香蕉切片中没有检测到醇类物质。由扫描电子显微镜表征可知,PAW处理影响了香蕉切片的表面微观结构,使香蕉切片表面变得粗糙并伴有损伤的出现。香蕉切片在PAW–30 s处理下具有较强的抗氧化活性,较好的贮藏品质以及对风味物质和微观结构较小的影响。PAW对果蔬鲜切品质有积极作用,采用PAW–30 s对鲜切果蔬产品进行加工贮藏具有广阔的前景和更环保的经济效益。
等离子活化水;
香蕉切片;
活性氧;
酶活性;
贮藏品质
香蕉(cv. AAA Cavendish)具有独特而宜人的香气,作为重要的亚热带和热带水果在世界各地广泛种植。香蕉果实不仅富含各种维生素和矿物质,还有酚类化合物和抗坏血酸等对人体有益的生物活性物质。研究发现香蕉果实有抗衰老、预防癌症和促进肠道健康的作用[1]。长期以来,香蕉采后不经加工即作为商品销售,但随社会需求的发展,鲜切水果成为新的加工销售方式。它具有便利、干净卫生和可利用度高等优点。然而,鲜切香蕉会在加工后发生硬度、颜色、风味等感官品质的不利变化[2],因此,保持鲜切香蕉的良好感官品质并延长其保鲜期成为鲜切加工工艺的关键。
自鲜切果蔬出现以来,前人开发了低温、热处理、气调、辐照、化学浸渍、可食性涂膜、植物提取物[3]等多种方法来维持其新鲜品质,但低温贮藏造成鲜切香蕉的冷害,热处理和化学浸渍会影响鲜切香蕉品质,很多消费者也不接受添加化学防腐剂的产品。低温等离子体(Cold Plasma, CP)作为一项新兴技术,它的非热处理特性能避免许多传统工艺的弊端,是保持鲜切品质良好的替代方案。CP电离气体会产生带电粒子、活性氧(Reactive Oxygen Species, ROS)、紫外光子等多种活性物质。作为一项新型非热食品加工工艺,它具有抑制微生物[4]、影响酶活性、改变食品成分等能力。近年来探索CP处理对新鲜食材的影响成为新趋势,研究发现,CP对维持圣女果、猕猴桃[5]和蓝莓等多种新鲜果蔬的功能特性有积极作用,但是,CP处理的负面影响很少被提及,这种直接放电方式会造成食品表面的蚀刻现象,Gu等[6]使用CP处理香蕉切片后发现切片边缘发黑且粗糙,与此同时,草莓被CP处理后会因为样品的颜色损失、生物活性化合物降解导致其表面劣化[7]。为解决这一问题,利用CP技术制备的等离子活化水(Plasma Activated Water,PAW)被考虑作为一种CP技术的优化(更温和、更清洁)方案应用于新鲜果蔬材料的处理。
PAW通过将等离子体源放置于液体近上方或液体中产生,不同的等离子体源、处理时长和放电气体等因素对PAW的性质有直接影响。液体会与CP处理产生的多种物质反应生成更多衍生物,因此,PAW中会包含ROS、硝酸盐和亚硝酸根离子等物质。这些活跃物质的存在使液体理化性质发生变化,例如,PAW的pH值因酸性化合物生成而下降[8],电导率因活性物质溶解而增大等。这些变化作用于微生物细胞时,会使细胞的DNA、蛋白质和脂质等结构损伤。Zhou等[9]用PAW处理鲜鱼后去除了表面微生物的保护膜,有效减少了感染面积。PAW在减少解冻鸡肉中微生物的同时,还能使鸡肉的蛋白质和脂质保持良好状态[10]。同时,PAW在处理双孢蘑菇、生菜[11]、绿豆芽时也表现出良好的抑菌作用。另外,PAW处理在新鲜水果领域也取得了一定成果。Ma等[12]指出PAW处理的高氧化还原电位和低pH降低了杨梅上微生物的活性并减缓了杨梅腐烂。Chen等[13]将鲜切梨用PAW处理后,梨表面的需氧菌、酵母菌和霉菌的总数均在检测限〔1.0 log10(CFU/g)〕以下,梨的抗氧化活性提高。综上,前人研究兴趣主要在PAW处理果蔬的杀菌潜力和机制上,对果蔬品质和理化性质的综合影响的研究仍然较少,而采用PAW改善香蕉切片的鲜切品质在之前尚未报道过,是一项具有吸引力的研究。
本研究采用将香蕉切片浸泡在PAW中的方法,研究PAW在改良鲜切香蕉品质并提升其耐贮藏性方面的作用,测定PAW处理前后酶促褐变相关酶的活力、ROS水平、贮藏特性(硬度、含水量、色度值)、风味物质变化、表面微观结构等,为PAW在鲜切香蕉保鲜贮藏方面的应用提供了新的加工技术和理论依据。
1.1 材料与仪器
主要材料和试剂:从陕西咸阳杨凌当地市场挑选品质良好的香蕉(cv. AAA Cavendish);
CP处理前将香蕉去皮切片,每片厚度为6 mm;
试剂均为分析纯,CP处理使用去离子水,以保证PAW质量。
主要仪器:CTP–2000 K型低温等离子体电源,南京苏曼电子公司;
N6000型分光光度计,上海佑科仪器公司;
LEICA TCS SP8 型生物激光共聚焦显微镜,德国莱卡公司;
TA.new plus型质构仪,美国ISENSO公司;
101–1AB型电热鼓风干燥箱,天津泰斯特仪器公司;
CR–310型色度计,日本柯尼卡美能达公司;
GCMS–TQ8050 NX型气相质谱联用仪,日本岛津公司;
Nano SEM–450型扫描电子显微镜,美国FEI公司。
1.2 方法
1.2.1 CP处理和PAW的产生
介质阻挡放电(Dielectric Barrier Discharge,DBD)等离子体仪器装置见图1,由等离子体电源、反应器、调节器组成。将去离子水倒入反应皿,以30、60和90 s的间隔用CP处理(电压为40 V,电流为0.7 A±0.1 A,距离为6 mm),得到PAW。将香蕉切片分别浸入去离子水和PAW中,超声渗透10 min后测量指标。

图1 介质阻挡放电型等离子体仪器装置
1.2.2 酶活性的测定
过氧化物酶(Peroxidase, POD)活性的测定采用Gu等[6]描述的方法。在470 nm处测定吸光度,定义1 mL酶液反应1 min后吸光度增大0.01为1个酶活力单位(U)。
多酚氧化酶(Polyphenol Oxidase, PPO)的活性参照Tappi等[14]的方法测定并略作修改。在420 nm下测定吸光度,定义1 mL酶液反应1 min后吸光度增大0.01为1个酶活力单位(U)。
酶活性公式为:
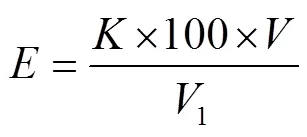
式中:为酶的活性,U;
为由吸光度曲线计算出的斜率;
为酶液的体积,mL;
1为用于吸光度测量的酶液的体积,mL。
1.2.3 ROS水平的分析
对香蕉细胞中的ROS的荧光染色参考Gu等[6]的方法并略作修改,使用激光扫描共聚焦显微镜(Confocal Laser Scanning Microscope, CLSM)分析香蕉切片在PAW处理前后ROS的荧光强度变化。
1.2.4 硬度的测定
使用质构仪测定对照组和PAW处理组香蕉切片的硬度,TA/2的柱状探针直径为2 mm,测试速率为1 mm/s,穿刺深度为5 mm,穿刺时的最大力(g/cm2)被确定为硬度。每隔1 h取一次样,每种处理测量10片香蕉,每片测量2次。
1.2.5 含水量的测定
将干燥好的称量皿称量,再将香蕉切片放在称量皿中称量,后在80 ℃下将香蕉切片干燥到恒质量。水分含量用以式(2)表示。

式中:为水分含量;
1为烧杯的质量,g;
2为烧杯的质量和样品的鲜质量之和,g;
3为烧杯的质量和样品的干质量之和,g。
1.2.6 色度的测定
参照Gu等[6]的方法,测量PAW处理前后的香蕉切片色度变化,用式(3)确定总色差(Δ)。

式中:Δ为总色差;
L为明暗度;
a为红绿色度;
b为黄蓝色度。
1.2.7 风味化合物的分析
使用GC–MS(Gas Chromatograph- Mass Spectrometer)对香蕉切片的风味化合物进行了测定。采用顶空固相微萃取法(Headspace-Solid-Phase Microextraction,HS-SPME)来提取香蕉切片中含有的风味化合物。峰面积归一化法对各分离组分的相对含量进行定量,公式见式(4)。

式中:为组分的相对含量,%;
P为每个分离成分的峰面积;
T为总峰面积。
1.2.8 扫描电子显微镜
使用扫描电子显微镜(Scanning Electron Microscope,SEM)分析香蕉切片的表面结构变化。样品用体积分数为4%的戊二醛预固定,然后用浓度为0.1 mol/L的PBS缓冲液(pH=6.8)冲洗,用乙醇进行梯度洗脱。在二氧化碳干燥和导电胶黏合后,对样品进行喷金并固定在仪器上观察。
1.3 数据统计分析
采用SPSS 26.0进行统计分析,通过单因素方差分析和邓肯多范围检验法验证显著性差异。使用Origin 2018来绘制图表。用NIST Chemistry WebBook进行香蕉风味物质的核对与确定。
2.1 PAW处理对香蕉切片ROS水平的影响
如图2所示,CLSM测量的荧光强度反映PAW处理前后香蕉细胞内ROS的水平,可观察到细胞核荧光(蓝色)和ROS荧光(绿色)。与对照组相比,PAW–30 s组、PAW–60 s组和PAW–90 s组的ROS荧光强度随CP处理时间的增加而变强,在PAW–90 s组达到最高水平,这与Ma等[12]的研究一致,他们发现荧光强度和酵母细胞的染色数量随CP处理时间的增加而增加。Lukes等[15]发现,ROS从PAW传输到微生物中,会分解微生物的DNA、破坏蛋白质和其他成分,从而造成细胞损伤。PAW中的ROS含量与CP处理时长呈正相关,香蕉切片在PAW中时,ROS通过细胞膜渗透,导致胞内ROS水平增加。

图2 PAW处理前后香蕉切片中ROS的 CLSM荧光图像
2.2 PAW处理对香蕉切片POD和PPO活性的影响
如图3a所示,香蕉切片的POD活性在贮藏期间呈单峰变化,且PAW–30 s组始终高于对照组,并在贮藏2 h后达到峰值,此时高于对照组12.18%(<0.05)。这与Zhao等[16]用PAW处理鲜切猕猴桃得到的结果相似,果实增加POD活性以增强抵抗力,减少PAW的ROS氧化损伤。随CP处理时间的增加,PAW–60 s组和PAW–90 s组的POD活性低于对照组的,且在贮藏6 h后分别比对照组低6.45%(<0.05)和14.52%(<0.05)。Kang等[17]了解到CP源产生的ROS对氨基酸的侧链造成损伤,在暴露于CP后的POD中发现二级结构的损失。此外,Gu等[6]认为香蕉中POD活性随CP处理时间增加而明显下降(<0.05),因此,PAW–60 s组和PAW–90 s组的POD活性低于对照组的,这是因为PAW中的ROS随CP处理时间延长而增加,大量ROS破坏了香蕉切片的POD,使其活性下降。
如图3b所示,香蕉切片的PPO活性在贮藏期间呈单峰变化。随CP处理时间的延长,PAW处理组的PPO活性均高于对照组的,并在贮藏2 h后达到峰值,其中PAW–30 s组、PAW–60 s组、PAW–90 s组的PPO活性分别比对照组的提高了29.81%、25.46%和39.57%(<0.05)。Jaiti等[18]报道,植物在感受到诱导剂(ROS的积累)后诱发防御反应,这涉及一系列生化变化的协调表达。此外,随CP处理时间增加,PAW–90 s组的PPO活性始终高于其他组,并在贮藏6 h后高于对照组18.15%(<0.05),因此,PAW处理组香蕉切片中PPO活性的增加与CP处理使PAW中ROS增加有关。PPO和POD的不同结构使它们在CP处理下表现出明显差异[19]。
2.3 PAW处理对香蕉切片硬度的影响
如图4所示,与对照组相比,经PAW处理的香蕉切片在贮藏5 h后硬度保持得更好,PAW处理组的硬度都高于对照组的(308.07 g)。Cong等[20]发现,用PAW处理新鲜枸杞并贮藏19 d后,枸杞保持了较高硬度。贮藏5 h期间,对照组和PAW–30 s组的硬度呈下降趋势;
PAW–60 s组和PAW–90 s组在贮藏初期硬度下降,后期变化较小,显然,经过PAW处理后的香蕉切片随贮藏时间的增加能保持更好的硬度。这是由于PAW处理提高了组织细胞的含水量和对细胞膜的支撑力[20]。在贮藏后期,PAW处理组的硬度随CP处理时间增加而下降,主要是CP处理导致了香蕉多糖的降解。
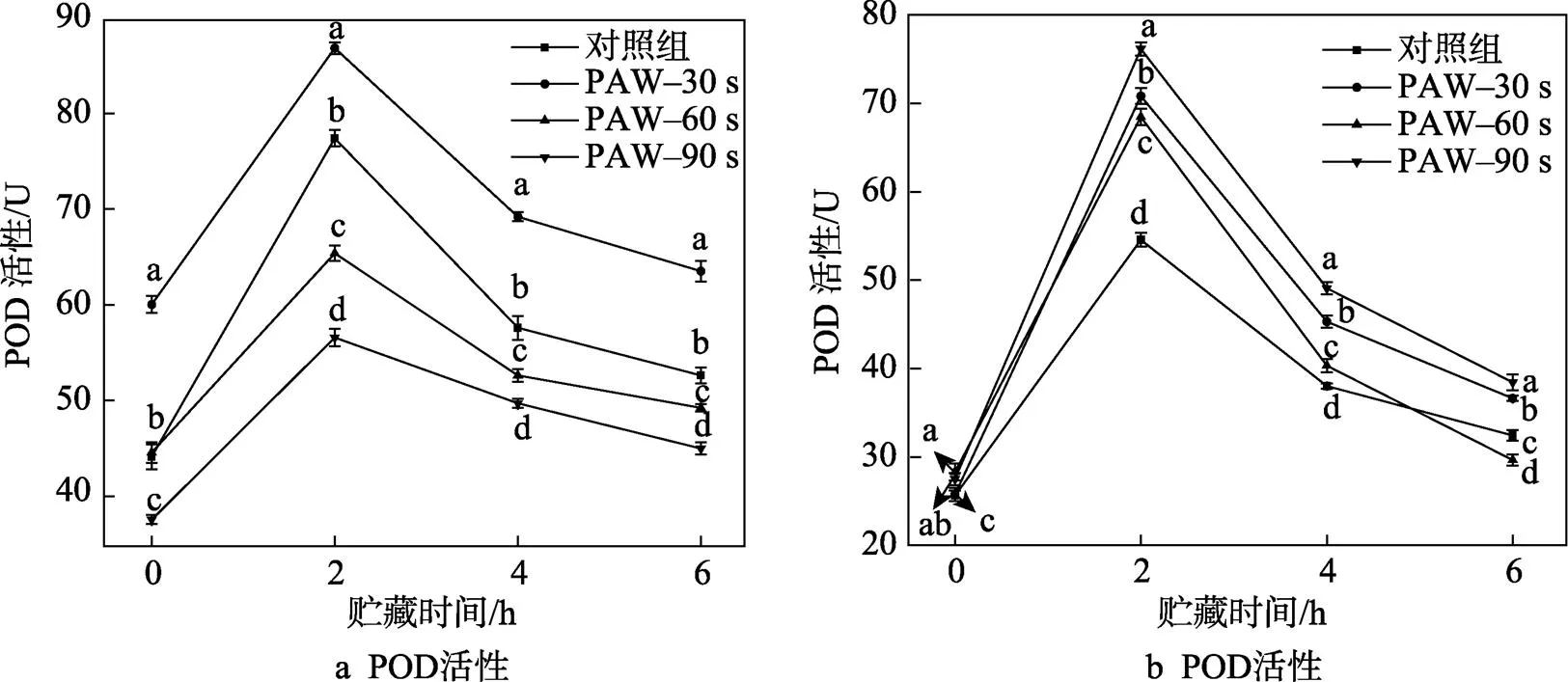
图3 PAW处理前后贮藏6 h内香蕉切片的POD和PPO活性的变化

图4 PAW处理前后贮藏5 h内香蕉切片硬度的变化
2.4 PAW处理对香蕉切片含水量的影响
PAW处理香蕉切片后含水量的测量结果见图5。与对照组相比,PAW处理组增加了香蕉切片的含水量(<0.05)。细胞内酶活性因清除渗入的过量ROS而增强,导致细胞内总代谢增强,从而使得细胞的含水量增加[20]。本研究还表明,PAW处理组组间含水量随CP处理时间的增加呈下降趋势,且组间差异显著(<0.05)。这种差异可能是PAW中ROS随CP处理时间延长而上升,过剩的ROS使细胞膜损伤。Chen等[21]发现PAW处理损伤了酿酒酵母的细胞壁和细胞膜,从而导致细胞外部的DNA数量的上升。
2.5 PAW处理对香蕉切片色度的影响
色度参数变化见图6。在贮藏8 h期间,对照组和PAW处理组的L值和b值下降,a值上升。PAW处理组的L值和b值在大部分时间内高于对照组(<0.05),且PAW处理组的a值在贮藏初期明显低于对照组的(<0.05),但在贮藏末期相反。L值的降低可能与表面水分渗出和酶促褐变有关。同时,酶促褐变对a值和b值也有影响。PAW处理组的组内比较表明,L、a和b值随着CP处理时间的增加而下降;
PAW–30 s组使香蕉切片保持正亮度,果实呈黄色,而PAW–60 s组明显使果实发红(<0.05)。结合Δ的变化发现PAW–30 s组与对照组之间的差异最明显(<0.05),因此,它是保持香蕉切片颜色质量的可行方法。PAW处理在保持香蕉切片色度上有积极作用,与Cong等[20]采用PAW处理枸杞时发现的结果一致。
2.6 PAW处理对香蕉切片风味物质的影响
PAW处理前后香蕉切片的主要挥发物质以及它们的保留时间和峰面积如表1—4所示。对照组的香蕉切片中相对含量(某个化合物的峰面积除以所有积分后的峰面积的和)最高的是酯类(62.07%),其次是醇类(23.17%)、酸类(7.78%)和醛类(6.20%),其中酯类物质以丁酸酯和乙酸酯为主。经过PAW处理后,酯类的相对含量从64.39%(PAW–30 s组)明显增加到91.11%(PAW–60 s组)和89.34%(PAW–90 s组),而醇类的相对含量从23.17%(PAW–30 s组)下降到0%(PAW–90 s组)。这可能与在一定条件下香蕉中醇类物质与PAW中的酸化活性物质的酯化反应有关。Bruggeman等[22]认为,不同的CP产生源会影响pH值的降低程度和酸化化合物的生成量。这可能也影响了PAW处理前后香蕉切片中酸类物质的相对含量,并导致酯类略有增加。此外,发现乙烯基–环己烷的相对含量在PAW处理过程中呈现出先下降后消失的趋势。这可能与PAW中的活性物质(ROS)的增加有关。ROS的增加使分子内部发生了烯烃双键与自由基的加成反应。香蕉切片浸泡在PAW中时发生一系列复杂的氧化反应导致了乙烯基–环己烷相对含量下降。通常酯类物质由醇和酸类物质经过酯化反应生成,多带有芳香味,其中短链酸形成的酯类多呈水果香,长链酸形成的酯多呈较淡油脂味,对香蕉整体风味有一定影响。其中丁酸己酯带有强烈的水果香气(清香香韵和花香香调),它的相对含量由从2.76%(对照组)增加到3.40%(PAW–90 s组);
1–环戊基丁酸乙酯具有强烈的果香和菠萝芳香气味,且伴有底香,它的相对含量由从0.00%(对照组)增加到30.08%(PAW–90 s组);
同时,2–壬醇乙酸酯(茉莉香)的相对含量由0.47%(对照组)增加到0.75%(PAW–90 s组);
而天然存在于香蕉中的2–甲基丁酸己酯(水果清香香气)、3–甲基丁酸己酯(生鲜水果香气)和己酸异戊酯(苹果和菠萝香味)的相对含量在PAW处理后(PAW–90 s)也分别增加了0.22%、0.30%和1.84%。因此,PAW处理增加了香蕉切片的酯类香气成分,且对香蕉的风味有积极影响。

图5 PAW处理前后香蕉切片含水量的变化

图6 PAW处理前后贮藏8 h内香蕉切片色度的变化
注:在计算Δ的值时,对照组的样品被设定为参照对象;
不同小写字母表示在<0.05水平上有显著差异。
表1 对照组香蕉切片挥发性成分的参数

Tab.1 Parameters of volatile components in banana slices of the control group
表2 PAW–30 s处理组香蕉切片挥发性成分的参数

Tab.2 Parameters of volatile components in banana slices of PAW-30 s treated group
表3 PAW–60 s处理组香蕉切片挥发性成分的参数

Tab.3 Parameters of volatile components in banana slices of PAW-60 s treated group
表4 PAW–90 s处理组香蕉切片挥发性成分的参数

Tab.4 Parameters of volatile components in banana slices of PAW-90 s treated group
2.7 PAW处理对香蕉切片表面微观结构的影响
PAW处理前后的香蕉切片扫描电镜图像如图7所示(放大倍数为400×),显示了细胞的表面微观结构变化。对照组(图7a)具有光滑平整且致密的表面,然而,PAW处理后的表面变得更为粗糙且有褶皱,并伴有损伤和絮状附着物的出现。在PAW处理组内,表面损伤程度与CP处理的时间正相关。Chen等[23]发现CP处理后糙米失去自然形态且表面有裂缝和糙纹。Sarangapani等[24]发现CP产生的活性因子破坏了米粒表面的C−C和C−H键,导致了裂缝和损伤的生成,因此,PAW中ROS等活性物质随CP处理时间增加而增多,损伤了香蕉的表面微观结构,在PAW–90 s组(图7d)中发现了严重的不可逆破损和收缩,这与使用CLSM测量ROS荧光强度得到的结果一致。选用PAW–30 s处理组不仅对香蕉切片表面微观结构损伤小,还具有节能环保的优势。

图7 PAW处理前后香蕉切片表面微观结构的变化
香蕉作为一种营养丰富、风味极佳的水果,在全世界范围内大量种植和销售,但在贮藏运输中会发生果实的褐变、氧化、软化等问题,使香蕉果实总体品质下降显著。PAW处理作为一项新型保鲜技术,在影响果蔬酶活性、护色、抗菌等方面有积极作用。本研究使用CP制备(30、60、90 s)的PAW浸泡香蕉切片后,测定了切片的物理化学性质,包括ROS水平、酶活性、硬度、含水量、色度、风味化合物和表面微观结构。观察到PAW处理后香蕉内的ROS与对照组的相比显著上升(<0.05),并随CP处理时长增加而增多,这表明PAW中的ROS会随处理进入到香蕉切片细胞内部。同时,POD和PPO的活性在PAW处理后增加,这与果蔬的氧化应激机制有关,一定条件的PAW处理提高了香蕉切片的抗氧化活性。此外,PAW处理组的香蕉切片比对照组的更加坚硬,含水量也因为PAW处理而上升,因此PAW处理对果实的耐贮藏性具有积极影响。PAW处理对香蕉切片贮藏过程的表面颜色也有积极影响,使用CP处理去离子水30 s所产生的PAW的效果最好。香蕉切片中的酯类在PAW处理后显著增加,醇类显著减少,且增加的酯类成分对香蕉风味有积极作用。随CP处理的时间增长,香蕉表面在PAW处理后更粗糙,损伤更为严重。综上,选用PAW–30 s的处理在保护香蕉鲜切品质,并提升其耐贮藏性方面具有巨大的潜力,是一种新颖且高效的非热预处理方法。这种技术的规模化使用以及商业化的可行性需在未来进一步研究。
[1] 洪佳敏, 何炎森, 郑云云, 等. 香蕉成分及其保健功能研究进展[J]. 中国农学通报, 2016, 32(10): 176-181
HONG Jia-min, HE Yan-sen, ZHENG Yun-yun, et al. Research Progress of Ingredients and Health Function of Banana[J]. Chinese Agricultural Science Bulletin, 2016, 32(10): 176-181
[2] 李胤楠, 刘程惠, 胡文忠, 等. 柠檬酸处理抑制鲜切香蕉褐变的研究[J]. 食品工业科技, 2013, 34(16): 304-307
LI Yin-nan, LIU Cheng-hui, HU Wen-zhong, et al. Study on Effect of Citric Acid Treatment on the Browning Prevention of Fresh-Cut Banana[J]. Science and Technology of Food Industry, 2013, 34(16): 304-307
[3] 王阳, 佟伟, 张文江, 等. 植物提取物在葡萄保鲜中的应用研究进展[J]. 保鲜与加工, 2022, 22(4): 116-120.
WANG Yang, TONG Wei, ZHANG Wen-jiang, et al. Advances on Application of Plant Extracts in Grape Preservation[J]. Storage and Process, 2022, 22(4): 116-120.
[4] 甘洪. 海藻酸钠低温等离子体改性对其抑菌效能及生鲜调理猪肉保鲜效应研究[D]. 南京: 南京农业大学, 2018.
GAN Hong. Study on Antibacterial Effect of Sodium Alginate Modified by Low Temperature Plasma and Fresh-Keeping Effect of Fresh-Prepared Pork[D]. Nanjing: Nanjing Agricultural University, 2018.
[5] 陈月圆, 赵武奇, 贾梦科, 等. 低温等离子体处理的鲜切猕猴桃片货架期预测模型[J]. 中国食品学报, 2022, 22(1): 179-188.
CHEN Yue-yuan, ZHAO Wu-qi, JIA Meng-ke, et al. Shelf Life Prediction Model of Fresh-Cut Kiwifruit Slices Treated with Low-Temperature Plasma[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(1): 179-188.
[6] GU Y, SHI W, LIU R, et al. Cold Plasma Enzyme Inactivation on Dielectric Properties and Freshness Quality in Bananas[J]. Innovative Food Science & Emerging Technologies, 2021, 69: 102649.
[7] MISRA N N, PATIL S, MOISEEV T, et al. In-Package Atmospheric Pressure Cold Plasma Treatment of Strawberries[J]. Journal of Food Engineering, 2014, 125: 131-138.
[8] 唐林, 王松, 郭柯宇, 等. 低温等离子体活化水在食品杀菌保鲜中的应用[J]. 中国食品学报, 2021, 21(12): 347-357.
TANG Lin, WANG Song, GUO Ke-yu, et al. The Application of Low-Temperature Plasma Activated Water in Food Sterilization and Preservation[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(12): 347-357.
[9] ZHOU Ren-wu, ZHOU Ru-sen, WANG Pei-yu, et al. Microplasma Bubbles: Reactive Vehicles for Biofilm Dispersal[J]. ACS Applied Materials & Interfaces, 2019, 11(23): 20660-20669.
[10] QIAN Jing, YAN Long-fei, YING Ke-qin, et al. Plasma-Activated Water: A Novel Frozen Meat Thawing Media for Reducing Microbial Contamination on Chicken and Improving the Characteristics of Protein[J]. Food Chemistry, 2022, 375: 131661.
[11] 袁园, 黄明明, 魏巧云, 等. 等离子体活化水对鲜切生菜杀菌效能及贮藏品质影响[J]. 食品工业科技, 2020, 41(21): 281-285.
YUAN Yuan, HUANG Ming-ming, WEI Qiao-yun, et al. Effect of Plasma Activated Water on Microbial Decontamination and Storage Quality of Fresh-Cut Lettuce[J]. Science and Technology of Food Industry, 2020, 41(21): 281-285.
[12] MA R, YU S, TIAN Y, et al. Effect of Non-Thermal Plasma-Activated Water on Fruit Decay and Quality in Postharvest Chinese Bayberries[J]. Food and Bioprocess Technology, 2016, 9(11): 1825-1834.
[13] CHEN C, LIU C, JIANG A, et al. The Effects of Cold Plasma-Activated Water Treatment on the Microbial Growth and Antioxidant Properties of Fresh-Cut Pears[J]. Food and Bioprocess Technology, 2019, 12(11): 1842-1851.
[14] TAPPI S, BERARDINELLI A, RAGNI L, et al. Atmospheric gas plasma treatment of fresh-cut apples[J]. Innovative Food Science & Emerging Technologies, 2014, 21: 114-122.
[15] LUKES P, DOLEZALOVA E, SISROVA I, et al. Aqueous-Phase Chemistry and Bactericidal Effects from an Air Discharge Plasma in Contact with Water: Evidence for the Formation of Peroxynitrite Through a Pseudo-Second-Order Post-Discharge Reaction of H2O2and HNO2[J]. Plasma Sources Science and Technology, 2014, 23(1): 015019.
[16] ZHAO Y, CHEN R, LIU D, et al. Effect of Nonthermal Plasma-Activated Water on Quality and Antioxidant Activity of Fresh-Cut Kiwifruit[J]. IEEE Transactions on Plasma Science, 2019, 47(11): 4811-4817.
[17] KANG J H, ROH S H, MIN S C. Inactivation of Potato Polyphenol Oxidase Using Microwave Cold Plasma Treatment[J]. Journal of Food Science, 2019, 84(5): 1122-1128.
[18] JAITI F, VERDEIL J L, EL HADRAMI I. Effect of Jasmonic Acid on the Induction of Polyphenoloxidase and Peroxidase Activities in Relation to Date Palm Resistance Against Fusarium Oxysporum f. sp. Albedinis[J]. Physiological and Molecular Plant Pathology, 2009, 74(1): 84-90.
[19] TAPPI S, GOZZI G, VANNINI L, et al. Cold Plasma Treatment for Fresh-Cut Melon Stabilization[J]. Innovative Food Science & Emerging Technologies, 2016, 33: 225-233.
[20] CONG K P, LI T T, WU C E, et al. Effects of Plasma-Activated Water on Overall Quality of Fresh Goji Berries During Storage[J]. Scientia Horticulturae, 2022, 293: 110650.
[21] CHEN H, BAI F, XIU Z. Oxidative Stress Induced in Saccharomyces Cerevisiae Exposed to Dielectric Barrier Discharge Plasma in Air at Atmospheric Pressure[J]. IEEE Transactions on Plasma Science, 2010, 38(8): 1885-1891.
[22] BRUGGEMAN P, LEYS C. Non-Thermal Plasmas in and in Contact with Liquids[J]. Journal of Physics D: Applied Physics, 2009, 42(5): 053001.
[23] CHEN H H, CHEN Y K, CHANG H C. Evaluation of Physicochemical Properties of Plasma Treated Brown Rice[J]. Food Chemistry, 2012, 135(1): 74-79.
[24] SARANGAPANI C, DEVI Y, THIRUNDAS R, et al. Effect of Low-Pressure Plasma on Physico-Chemical Properties of Parboiled Rice[J]. LWT-Food Science and Technology, 2015, 63(1): 452-460.
Effect of Ultrasonic Osmosis Plasma Activated Water on Fresh-cut Quality of Banana Slices
ZHANG Teng, JIANG Hao
(College of Food Science and Engineering, Northwest A&F University, Shaanxi Xianyang 712100, China)
The work aims to treat banana slices with plasma activated water for different time to achieve color protection and investigate the pattern of change in properties during storage. Plasma activated water (PAW) was generated by treating deionized water with cold plasma (CP), and the changes in microstructure, storage properties, flavor substances, key enzymatic browning enzymes and reactive oxygen species levels of banana slices were measured after ultrasound-assisted PAW treatment. Compared with the control, PAW treatment enhanced the activities of polyphenol oxidase (PPO) and peroxidase (POD) during storage and improved storage properties such as hardness, moisture content, and color value of slices. According to the fluorescence results of confocal laser scanning microscope, PAW treatment promoted the level of reactive oxygen specie (ROS) in the cells of the slices. In addition, gas chromatography-mass spectrometry results showed that PAW treatment increased the percentage of esters in banana slices, while no alcohols were detected after the treatment. Scanning electron microscopy characterized that PAW treatment affected the surface microstructure of banana slices, causing the surface of banana slices to become rough, accompanied by the appearance of damage. Banana slices treated with PAW-30 s show strong antioxidant activity, better storage quality and less effect on flavor substances and microstructure. Therefore, PAW has a positive effect on the fresh-cut quality of fruits and vegetables, and the use of PAW-30 s for processing and storage of fresh-cut fruits and vegetables has a broad prospect and more environmentally friendly economic benefits.
plasma activated water (PAW); banana slices; reactive oxygen species (ROS); enzyme activity; storage quality
TS255.36
A
1001-3563(2023)05-0065-10
10.19554/j.cnki.1001-3563.2023.05.009
2022−07−03
国家自然科学基金(3207161197);
陕西省重点产业链一般项目(2021NY–166,2022ZDLNY04–02);
中国高校科学基金(2452019066)
张腾(1999—),男,硕士生,主攻食品加工方向。
江昊(1986—),男,博士,副教授,主要研究方向为农产品加工。
责任编辑:曾钰婵
猜你喜欢香蕉切片活性阳桃根化学成分及其体外抗肿瘤活性中成药(2021年5期)2021-07-21快手香蕉饼家教世界·V家长(2019年3期)2019-06-11简述活性包装的分类及应用(一)上海包装(2019年2期)2019-05-20金丝草化学成分及其体外抗HBV 活性中成药(2018年2期)2018-05-09瓶里有香蕉小天使·三年级语数英综合(2017年11期)2017-12-05香蕉阅读与作文(小学高年级版)(2017年10期)2017-10-11基于SDN与NFV的网络切片架构电信科学(2016年11期)2016-11-23肾穿刺组织冷冻切片技术的改进方法中国组织化学与细胞化学杂志(2016年3期)2016-02-27基于镜像对称参考切片的多扫描链测试数据压缩方法电子与信息学报(2015年6期)2015-07-12冰冻切片、快速石蜡切片在中枢神经系统肿瘤诊断中的应用价值比较中国当代医药(2015年17期)2015-03-01本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0917/655446.html




