【www.zhangdahai.com--其他范文】
高一波,李佳妍,石子琪,宁 青*,韦英杰*
1.南京中医药大学附属中西医结合医院,江苏 南京 210028
2.江苏省中医药研究院,国家中医药管理局中药释药系统重点研究室,江苏 南京 210028
3.南京中医药大学第三临床医学院,江苏 南京 210028
4.烟台毓璜顶医院 药学部,山东 烟台 264000
补骨脂为豆科植物补骨脂Psoralea corylifoliaL.的干燥成熟果实,温肾助阳、纳气平喘、温脾止泻,用于治疗肾阳不足、阳痿遗精、遗尿尿频、腰膝冷痛、肾虚作喘、五更泄泻;
外用消风祛斑,治疗白癜风、斑秃[1]。补骨脂始载于《雷公炮炙论》,临床应用历史悠久广泛,据药智数据库统计,含补骨脂的中成药方剂有224 种,保健食品达52 种。补骨脂常作为传统补益类中药,亦为骨伤科要药,但近年来含补骨脂的复方制剂如骨康胶囊、仙灵骨葆口服制剂等的肝损伤风险引起关注[2-3]。合理配伍使用是其临床应用安全有效的重要手段。武文星等[4]采用数据挖掘分析了补骨脂的配伍特点,杜仲是与补骨脂配伍的第4 位高频药味,2 味药物配伍组合中支持度最高的为补骨脂-当归(28.61%)和补骨脂-杜仲(28.44%)。青娥丸为杜仲配伍补骨脂的代表补肾良方,首载于宋代《太平惠民和剂局方》,现收载于《中国药典》2020年版一部,且未见临床肝损伤相关不良反应报道,探讨补骨脂-杜仲配伍减毒作用对临床安全用药具有意义。
课题组前期用斑马鱼高效筛选验证杜仲为补骨脂配伍减毒的较优药味,并探讨了代表成分桃叶珊瑚苷对补骨脂素(psoralen,PS)的减毒作用[5]。补骨脂化学成分复杂,主要含香豆素类、黄酮类和单萜酚类,其中香豆素类包括苷元[以PS 和异补骨脂素(isopsoralen,IPS)为代表]及其糖苷[补骨脂苷(psoralenoside,PSS)和异补骨脂苷(isopsoralenoside,IPSS)为代表],是抗骨质疏松的主要活性成分[6-7],也是补骨脂水煎液中主要成分(约为香豆素类、黄酮类和单萜酚类3 类成分含量之和的90%以上),其中糖苷含量约是苷元的8.2 倍[8]。近年研究表明,香豆素是补骨脂潜在肝损伤风险成分之一,PS 和IPS 都能对大鼠的肝脏系数造成一定负面影响且会引起丙氨酸代谢、甘氨酸代谢、尿素循环等通路的混乱,还可能通过抑制胆汁酸在肝脏中的排泄,使得毒素大量堆积在肝细胞中,引发肝损伤[9-11]。体内代谢转化至关药物的效/毒产生,补骨脂糖苷成分可脱糖基转化成苷元使毒性增加[12]。因此,关注杜仲配伍后补骨脂香豆素类特别是糖苷成分的代谢及效/毒的多模态变化,对揭示杜仲补骨脂配伍特性与机制具有意义。
中药成分特别是量微成分的抗骨质疏松活性、毒性和代谢的在体、高效评价一直是哺乳动物试验难以克服的瓶颈。新兴的模式动物斑马鱼遗传生物特性与人类高度保守,并几乎具备人体所有主要的器官和系统,体型小,繁殖能力较强且易于饲养,适合大规模筛选[13]。课题组前期建立斑马鱼骨质疏松模型和代谢等方法,实现多种壮骨中药及其量微成分的代谢与效/毒的多模态高效评价[14-15]。本研究采用斑马鱼进行代谢、毒性、抗骨质疏松活性的多模态评价,探讨杜仲富含木脂素提取物(lignan extract ofEucommiae Cortex,LEEC)与补骨脂香豆素提取物(coumarin extract ofPsoraleae Fructus,CEPF)配伍以及各自代表成分配伍,对香豆素提取物及代表糖苷的代谢转化及效/毒影响,以揭示二药配伍的特性。
1.1 动物
斑马鱼成鱼购自南京尧顺禹生物科技有限公司,为德国Tuebingen 品系。
1.2 药品与试剂
盐补骨脂(产地为四川,批号201019,南京松龄中药饮片有限公司)、盐杜仲(产地为贵州,批号20210902-01,贵州同德药业有限公司)由江苏省中西医结合医院采购,以上药材经江苏省中医药研究院韦英杰研究员分别鉴定为豆科植物补骨脂P.corylifoliaL.的干燥成熟果实、杜仲科植物杜仲Eucommia ulmoidesOliv.的干燥树皮;
对照品PSS(批号210306,质量分数>98%)、IPSS(批号200930,质量分数>98%)购自上海融禾医药科技有限公司;
对照品PS(批号110739-201918,质量分数为99.6%)、IPS(批号110738-202016,质量分数为99.4%)购自中国食品药品检定研究院;
对照品松脂醇二葡萄糖苷(pinoresinol diglucoside,PDG,批号20011401,质量分数为98.64%)购自成都普菲德生物技术有限公司;
LEEC 为课题组自制,PDG质量分数为4.02%;
CEPF(批号D191021-3)为课题组自制,PS、IPS、PSS、IPSS 质量分数之和为68.17%;
茜素红(批号K08J9C63243)、依替膦酸二钠(批号K22A8M34493)购自上海源叶生物科技有限公司;
色谱级乙腈(批号20095191、22035238)购自阿拉丁试剂有限公司、美国天地试剂公司;
色谱级甲酸(批号G1826012)购自阿拉丁试剂有限公司;
泼尼松龙(批号FD050193,质量分数为98%)购自萨恩化学技术上海有限公司;
多聚甲醛(批号20140901)购自上海展云化工有限公司。
1.3 仪器
SMZ800N 型显微镜(日本Nikon 公司);
SPX-80 型生化培养箱(宁波海曙赛褔实验仪器厂);
1260型系列高效液相色谱仪(美国Agilent 公司);
NEVAPTM112 型氮吹仪(美国 Origanomation Associates 公司);
KQ3200B 型超声波清洗器(昆山市超声仪器有限公司);
MS105DU 型分析天平(瑞士Mettler Toledo 公司)。
2.1 HPLC 分析补骨脂代表香豆素成分
Agilent Zorbax Extend C18色谱柱(250 mm×4.6 mm,5 µm),流动相为乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱:0 min,10% A;
0~30 min,10%~50% A;
30~40 min,50%~60% A。柱温25 ℃;
体积流量1.0 mL/min;
检测波长246 nm;
运行时间40 min;
进样量20 μL。分析CEPF 配伍LEEC 以及PSS、IPSS 分别配伍PDG(杜仲木脂素代表成分)经斑马鱼作用前后的4 个代表香豆素成分(PSS、IPSS、PS、IPS)。
2.2 用斑马鱼评价杜仲对补骨脂香豆素类成分安全性的影响
2.2.1 供试液配制 精密称取CEPF和LEEC 适量,分别用培养基(2.9% NaCl、0.125 8% KCl、0.485 1%CaCl2·2H2O、0.811 8% MgSO4·7H2O)配制成质量浓度分别为100、200、400、600、800 μg/mL(以CEPF计)的CEPF、LEEC、CEPF-LEEC(1∶4)、CEPFLEEC(1∶2)、CEPF-LEEC(1∶1)和CEPF-LEEC(2∶1)供试液。
精密称取PSS、IPSS 以及PDG 适量,分别用培养基配制成1 mg/mL 的母液,将PSS、IPSS 的母液分别稀释成质量浓度为100、200、300、400、500 μg/mL 的溶液,PDG 的母液稀释成质量浓度为100、200、400、600、800 μg/mL 的溶液,PSS、IPSS 的母液分别与PDG 的母液按5∶2 的比例稀释成质量浓度为100、200、300、400、500 μg/mL 的溶液(分别以PSS 或IPSS 计)。
2.2.2 斑马鱼给药 胚胎由斑马鱼成鱼自由交配产生,将胚胎放置培养基中,在28.5 ℃培养箱中培养24 h。取受精后1 d(one day after fertilization,1 dpf)的斑马鱼胚胎置24 孔板中,每孔10 个胚胎,30 个胚胎/组,分别暴露于不同质量浓度的供试液中,每孔2 mL 溶液,用培养基作空白对照。每天记录死亡鱼数,于显微镜下观察鱼的形态,并于3 dpf 或3~6 dpf 时于显微镜下拍照,一直记录到6 dpf。
2.2.3 数据分析 利用SPSS 16.0 软件计算6 dpf 的斑马鱼亚致死浓度(20% lethal concentration,LC20)和半数死亡浓度(LC50)。
2.3 用斑马鱼评价杜仲配伍补骨脂对其香豆素类成分代谢的影响
2.3.1 斑马鱼分组与给药 将1 dpf 的斑马鱼胚胎放于24 孔板中,设置CEPF(50 μg/mL)组、1CEPF∶2LEEC(50 μg/mL,以CEPF 计)组、LEEC(100 μg/mL)组、PSS(10 μg/mL)组、IPSS(10 μg/mL)组、5PSS∶2PDG(10 μg/mL,以PSS 计)组、5IPSS∶2PDG(10 μg/mL,以IPSS 计)组,另设置未加鱼的相应空白药物组。每孔10 个胚胎,各质量浓度设2 个平行组,每孔给药液2 mL,放于28.5 ℃恒温培养箱中培养至6 dpf。分别于斑马鱼暴露药液后0、1、2、3、4、5 d 时吸取药液2 mL,置于-20 ℃冰箱中保存。
2.3.2 样品处理 将上述给药后0~5 d 代谢液、空白药液,室温空气吹干,加80%甲醇1 mL 溶解,进样20 μL,进行HPLC 分析。
2.4 用斑马鱼评价杜仲配伍补骨脂对其香豆素类成分抗骨质疏松活性的影响
2.4.1 溶液配制
(1)泼尼松龙溶液配制:精密称取泼尼松龙9 mg,加入二甲基亚砜(dimethyl sulfoxide,DMSO)1 mL 溶解,配制成25 mmol/L 泼尼松龙储备液。取泼尼松龙储备液适量,稀释1000 倍得到25 μmol/L溶液。
(2)依替膦酸二钠溶液配制:精密称取依替膦酸二钠6 mg,加入培养基1 mL 溶解,得6 mg/mL依替膦酸二钠储备液。取依替膦酸二钠储备液和泼尼松龙储备液适量,用培养基稀释得含25 μmol/L泼尼松龙的30 μg/mL 依替膦酸二钠溶液。
(3)供试液的配制:分别取CEPF、LEEC 和25 mmol/L 泼尼松龙储备液适量,配制成含25 μmol/L 泼尼松龙的CEPF(0.1、0.5、2.5 μg/mL)、LEEC(0.1、0.5、2.5 μg/mL)及1CEPF∶2LEEC(0.1、0.5、2.5 μg/mL,以CEPF 计),供抗斑马鱼骨质疏松作用研究。分别取PSS、IPSS、PDG 和25 mmol/L 泼尼松龙储备液适量,配制成含25 μmol/L 泼尼松龙的PSS(0.08、0.4、2 μg/mL)、IPSS(0.08、0.4、2 μg/mL)、PDG(0.08、0.4、2 μg/mL)、5PSS∶2PDG(0.08、0.4、2 μg/mL,以PSS 计)及5IPSS∶2PDG(0.08、0.4、2 μg/mL,以IPSS 计),供抗斑马鱼骨质疏松作用研究。
2.4.2 斑马鱼分组与给药 将3 dpf 的斑马鱼胚胎放入24 孔板中,每孔10 个胚胎,每组20 个胚胎,设置0.4% DMSO 溶媒对照组、模型组(25 μmol/L泼尼松龙)、阳性药物组(30 μg/mL 依替膦酸二钠)及各供试液组,每孔加入各质量浓度溶液2 mL。将24 孔板放入28.5 ℃恒温培养箱中培养5 d,隔天换1 mL 新溶液,培养至8 dpf。
2.4.3 斑马鱼幼鱼的固定、骨骼染色与分析 斑马鱼幼鱼培养至8 dpf,用4%多聚甲醛处死固定过夜后,采用1% KOH 配制的含1.5% H2O2漂白剂将鱼体漂白后,用茜素红对斑马鱼幼鱼头部骨骼染色,最后用1% KOH-甘油(1∶1)的透明液清洗,去除多余的染色剂。用Image pro plus 6.0 软件计算头骨染色矿化面积和累积吸光度值。
2.4.4 数据分析 用Excel 软件统计分析头骨染色矿化面积和累积吸光度值数据,计算各组数据的平均值、标准偏差以及变异系数(n=15~20),以ttest 比较两组间的结果差异;
运用SPSS 16.0 软件以单因素方差分析多组间结果比较,方差齐性时用最小显著性差异法(LSD)进行组间两两比较,方差非齐性时用Dunnett’sT3 法进行组间两两比较。
3.1 杜仲配伍补骨脂对其香豆素提取物/成分的安全性影响
3.1.1 LEEC 配伍CEPF 及二者代表成分配伍对斑马鱼致畸作用的影响 斑马鱼受精3 dpf 后孵化成幼鱼,各脏器发育基本完全,鱼体透明,在载玻片上易侧卧,显微镜下检视脏器形态清晰、直观。对3 dpf 或3~6 dpf 斑马鱼幼鱼进行动态检视并拍照,如图1所示,与对照组比较,CEPF(600、800 μg/mL)组鱼出现心包肿大,卵黄囊肿大、变黑;
LEEC(100~800 μg/mL)组鱼未见明显心包、卵黄囊等形态畸变;
二者不同比例(CEPF∶LEEC 为1∶4~2∶1)配伍后,鱼主要器官心包、卵黄囊畸变与CEPF 的剂量相关,当CEPF∶LEEC 为1∶4 和1∶2 时,100~800 μg/mL 给药组鱼未见明显心包、卵黄囊等形态畸变;
当CEPF 所占比例增加,CEPF∶LEEC 为1∶1 和2∶1 时,600、800 μg/mL 给药组鱼出现心包肿大、卵黄囊肿大或变黑,有时鱼体弯曲。提示LEEC 在适当质量浓度时可改善CEPF 引起的斑马鱼主要器官畸变。

图1 CEPF、LEEC 及二者配伍组3 dpf 斑马鱼幼鱼显微检视图Fig.1 Micrograph of zebrafish larvae exposed to CEPF,LEEC and their compatibility groups at 3 dpf
补骨脂香豆素代表成分PSS、IPSS,杜仲木脂素代表成分PDG 及配伍各质量浓度组3 dpf 斑马鱼心包、卵黄囊等形态未见明显变化(图2),提示此时各药物尚未使鱼明显致畸,与此时无鱼死亡结果相对应。随着给药时间增加到5~6 dpf 时,400~500 μg/mL PSS、IPSS 及配伍组鱼出现死亡,且500 μg/mL PSS 或IPSS 组鱼产生明显畸变,如鱼身体弯曲,鱼鳔消失;
配伍PDG 后,鱼形态均明显改善,与培养基组鱼相当。
3.1.2 LEEC 配伍CEPF 及二者代表成分配伍对斑马鱼死亡率的影响 LEEC 配伍CEPF 致斑马鱼的死亡率与给药质量浓度和时间基本呈相关性,其给药时间-剂量-死亡率关系见图3。根据死亡率曲线得出6 dpf斑马鱼死亡率为20%时各给药组的LC20[16],LC20从小到大依次为 CEPF(159.8 µg/mL)<2CEPF∶1LEEC(222.2 µg/mL)<1CEPF∶1LEEC(552.3 µg/mL)<1CEPF∶2LEEC(650.2 µg/mL)<1CEPF∶4LEEC(696.9 µg/mL)<LEEC(726.4µg/mL)。LC20越高,安全性越好,可见LEEC 安全性最好,CEPF 安全性最差,二者配伍后,随着CEPF所占比例增加,安全性相应变差。

图3 LEEC 配伍CEPF 及二者代表成分配伍致鱼死亡的时间-剂量-死亡率Fig.3 Time-dose-mortality of zebrafish death caused by compatibility of LEEC with CEPF and coumarin representative components of Psoraleae Fructus
如图3所示,CEPF 单独给药48 h 后,各质量浓度组鱼在2 dpf 和3 dpf 死亡率都小于20%,在72~120 h 后,200~800 μg/mL 组鱼死亡率随着给药时间增加而增加,于6 dpf 达43.3%~100.0%,100.0%死亡最低质量浓度为400 μg/mL;
LEEC 单独给药,除800 μg/mL 组6 dpf 鱼死亡率达33.3%,其他各质量浓度组鱼给药期间死亡率均低于20%;
二者配伍(CEPF∶LEEC 为1∶4~1∶1)给药72 h(4 dpf)后,除1CEPF∶4LEEC(800 μg/mL)组鱼死亡率为33.3%,其他各质量浓度组鱼死亡率均小于20%,在120 h 后,600~800 μg/mL 给药组鱼死亡率增加大于20%,100.0%死亡最低质量浓度为600 μg/mL,但当CEPF∶LEEC 为2∶1 时,鱼死亡的时间-剂量关系与CEPF 单独给药基本相当。提示二者配伍在一定比例(CEPF∶LEEC 为1∶4~1∶1)时,致鱼死亡质量浓度提高,死亡时间延迟,具有减毒作用。
补骨脂香豆素代表成分PSS 和IPSS 与杜仲木脂素代表成分PDG 分别配伍的6 dpf 斑马鱼LC20从小到大依次为:PSS(268.8 µg/mL)<IPSS(304.7µg/mL)<5PSS∶2PDG(512.3 µg/mL)<5IPSS∶2PDG(538.6 µg/mL)。PDG 各质量浓度组鱼给药期间几乎无死亡(死亡率<6.7%)。可见PSS 和IPSS配伍PDG 后,LC20值增加近1 倍。
PSS、IPSS 及分别配伍PDG,给药96 h(5 dpf)后,各质量浓度组斑马鱼死亡率均低于20%;
给药120 h 后,PSS(400、500 μg/mL)组死亡率上升为46.7%、66.7%,分别比配伍PDG 组高6.7%、13.4%;
IPSS(400、500 μg/mL)组死亡率上升为46.7%、96.7%,分别比配伍PDG 组高23.4%、56.7%。
3.1.3 LEEC 配伍CEPF 及二者代表成分配伍对斑马鱼LC50的影响 测试药对斑马鱼的LC50越小,表明其致鱼死亡的给药质量浓度越低,毒性越大。如图4所示,LC50以给药总量计,CEPF 的LC50值(209.3 μg/mL)最小,毒性最大,配伍LEEC 后,组合物的LC50值随着CEPF 的比例减小而增加,其中1CEPF∶2LEEC 和1CEPF∶4LEEC 组合物的LC50值大于二药单用,是CEPF 的LC50值的8.3、14.3倍,提示LEEC 可明显降低CEPF 的毒性。
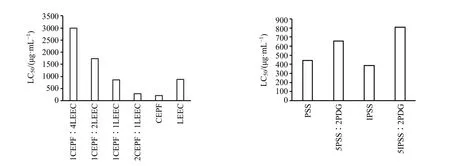
图4 LEEC 配伍CEPF 及二者代表成分配伍对斑马鱼LC50 的影响Fig.4 Effect of compatibility of LEEC with CEPF and coumarin representative components of Psoraleae Fructus on LC50 of zebrafish(6 dpf)
补骨脂香豆素代表成分PSS 与IPSS 单用至6 dpf 鱼的LC50值分别为441.7、387.5 μg/mL,配伍杜仲代表木脂素成分PDG 后,LC50值均增加,分别为654.9、809.1 μg/mL,提示配伍PDG 后毒性减小。PDG 单用安全性好,各质量浓度致斑马鱼死亡率低(小于10%),未能计算出LC50值。
3.2 LEEC 配伍CEPF 及二者代表成分配伍对斑马鱼代谢的影响
LEEC 与CEPF 及代表成分配伍经斑马鱼作用后0~5 d 的HPLC 图见图5。以补骨脂香豆素糖苷(PSS、IPSS)及其代谢物(PS、IPS)为指标,计算各自占4 种香豆素成分含量总和的百分比计为相对质量分数[12],结果见图6。
图5 LEEC 配伍CEPF 及二者代表成分配伍经斑马鱼作用0~5 d 的HPLC 图Fig.5 HPLC chromatogram of LEEC,CEPF,representative components and their respective combination after exposing to zebrafish for 0—5 d
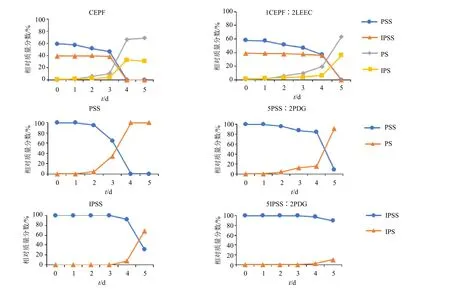
图6 斑马鱼作用后补骨脂香豆素代表成分(PSS、IPSS、PS、IPS)含量变化Fig.6 Changes in contents of representative components of Psoraleae Fructus coumarin(PSS,IPSS,PS,IPS)after zebrafish treatment
CEPF 单独给予1 dpf 斑马鱼1~3 d(2~4 dpf)后,少部分PSS(约12.9%)和IPSS(约1.0%)缓慢脱糖基分别转化为PS 和IPS,至给药后4 d(5 dpf)后代谢速率明显增加,PSS 和IPSS 全部转化为PS 和IPS,其相对质量分数分别为67.0%和33.0%;
至给药后5 d(6 dpf),PS、IPS 含量相对稳定不变。配伍LEEC 后,PSS 和IPSS 代谢速率明显减慢,至给药后4 d(5 dpf),仅少部分PSS(约20.9%)和IPSS(约2.9%)转化为PS 和IPS,直至给药后5 d(6 dpf)才全部转化为PS 和IPS。
补骨脂香豆素糖苷代表成分PSS 和IPSS,分别单独给予1 dpf 斑马鱼2 d(3 dpf)或3 d(4 dpf)后均相对稳定,相应代谢物PS 或IPS 检测不到或很少(小于5.0%)。PSS 在给药后3~4 d(4~5 dpf)代谢速率加快,相对质量分数分别降至65.1%和0.0%,其代谢物PS 的相对质量分数相应增加至34.9%和100.0%,配伍PDG 后,PSS 代谢速率减慢,在给药后4 d 的相对质量分数仍为84.0%,直至给药后5 d(6 dpf)才降至8.3%;
IPSS 在给药后5 d(6 dpf)代谢速率加快,相对质量分数由4 d(5 dpf)的92.3%降至32.1%,其代谢物IPS 的相对质量分数由7.7%增加至67.9%,配伍PDG 后,IPSS代谢速率亦减慢,给药后5 d(6 dpf)相对质量分数仅降至89.9%,较单独给药高出57.8%。
3.3 杜仲配伍补骨脂对其香豆素提取物/成分的抗骨质疏松活性影响
各组斑马鱼幼鱼(8 dpf)头骨茜素红染色的显微成像结果见图7,图像分析软件所得结果见图8。与溶媒对照组比较,模型组的斑马鱼头骨染色矿化面积和累积吸光度值明显降低(P<0.05、0.001),表明25 μmol/L 泼尼松龙造模成功;
与模型组比较,依替膦酸二钠组矿化面积或累积吸光度值显著升高(P<0.05、0.01、0.001),CEPF(0.1 μg/mL)组、LEEC(0.5 μg/mL)组以及二者配伍(0.5、2.5 μg/mL)组矿化面积显著增加(P<0.05),CEPF、LEEC 及二者配伍1CEPF∶2LEEC 各质量浓度(0.1、0.5、2.5 μg/mL)组累积吸光度值均显著增加(P<0.01、0.001),CEPF 配伍LEEC(0.5、2.5 μg/mL)组的矿化面积和累积吸光度值高于相同质量浓度CEPF、LEEC 单独给药,其中2.5 μg/mL 配伍组的累积吸光度值显著高于CEPF 或LEEC 单独给药(P<0.05),0.5 μg/mL 配伍组的累积吸光度值显著高于CEPF 单独给药(P<0.05)。

图7 斑马鱼幼鱼头骨(8 dpf)茜素红染色显微成像图(×120)Fig.7 Ventral view of alizarin red whole-mount preparations of juvenile zebrafish cranium(8 dpf,× 120)
PSS(0.4、2.0 μg/mL)组、PDG(2.0 μg/mL)组以及0.4、2.0 μg/mL 二者配伍(5PSS∶2PDG)组矿化面积较模型组显著增加(P<0.05、0.01),PDG及其与PSS 配伍(0.4、2.0 μg/mL)组累积吸光度值均显著增加(P<0.05、0.01、0.001),且配伍组累积吸光度值高于二者相同质量浓度单独给药,其中0.4、2.0 µg/mL 配伍组累积吸光度值显著高于PSS单独给药(P<0.05)。
IPSS(0.08、0.4 μg/mL)组、PDG 各质量浓度组以及0.4、2.0 μg/mL 二者配伍(5IPSS∶2PDG)组矿化面积较模型组均显著增加(P<0.05、0.01),除IPSS(2.0 μg/mL)组外,各质量浓度(0.08、0.4、2.0 μg/mL)的IPSS、PDG 及二者配伍组累积吸光度值均显著增加(P<0.05、0.01),且配伍组累积吸光度值高于二者相同质量浓度单独给药,其中2.0µg/mL 配伍组累积吸光度值显著高于IPSS 单独给药(P<0.05)。
近年来,含补骨脂相关制剂引起的肝损伤不良反应受到关注,配伍减毒是其临床安全用药的有效手段。源于宋代《太平惠民和剂局方》的青娥丸以杜仲-补骨脂药对为君药和臣药,临床用药安全有效,故研究杜仲配伍补骨脂的减毒作用具有代表性,为补骨脂临床安全配伍用药提供参考。
药物的毒/效产生与其在体内的代谢转化紧密相关,故综合考虑代谢-效/毒的变化能更好体现药物配伍的整合作用。而采用活体动物实验是确定药物的有效性与安全性的必需环节。如何实现高效、规模化的评价至关重要,近年来斑马鱼因遗传特性与人类高度保守等优点而被广泛用于探索药物药理、毒理及代谢等研究,此外斑马鱼易于饲养,繁殖能力较强,体外受精卵发育迅速,主要器官在受精后5 d 均已基本形成,头骨在受精后8~9 d 也已发育完整,幼鱼全身透明,适合显微镜下实时动态观察,体小适合微板中实验,实现大规模筛选[17-18]。
广义上讲,模态是指通过不同渠道和媒介获得的模式数据或符号系统,包括文字、图像、视频、声音甚至知识图谱。而2 种以上模态的交叉或者一种模态下多类测量指标的融合均可称为多模态。多模态在药物筛选、多模态影像、多模态单细胞组学等方兴未艾[19]。张伯礼院士团队[19]从中医药整体观出发,提出中药药效物质多模态辨识,指综合运用化学分析、影像学、多组学以及信息学等学科技术,在微观、介观、宏观等多个尺度辨析中药化学组成与生物效应间的相关性,并运用模式识别、机器学习等智能计算方式融合多模态信息,从而辨识中药药效物质及其整合调节作用。斑马鱼模型具有活体成像优势,对1 个或多个图像指标进行观测,结合分子生物学变化,越来越多地用于多模态水平开展中药药效物质研究[20]。本研究整合斑马鱼活体成像,头骨染色图像、致死量、成分转化等多指标分析,实现反应代谢-毒/效的多模态评价。
以糖苷(PSS 和IPSS)为代表的补骨脂香豆素类成分是其传统水煎液的主要成分,故本研究探讨LEEC 配伍CEPF 及二者代表成分配伍后的代谢、毒性及抗骨质疏松活性变化,以期揭示二药配伍的机制。斑马鱼毒性评价发现,CEPF 单独用药致斑马鱼的死亡率和致心包、卵黄囊等形态畸变均大于LEEC,200~800 μg/mL CEPF 致鱼死亡主要在给药72~120 h(4~6 dpf)逐渐增加,二者不同比例组合后,随着LEEC 的占比增加(50%~80%),致鱼死亡质量浓度(600~800 μg/mL)较CEPF 单用提高,死亡时间延迟约24 h,死亡率也相应降低,且6 dpf 斑马鱼的LC50值相应逐步提高,提示具减毒作用。杜仲木脂素代表成分PDG 配伍补骨脂香豆素代表糖苷PSS 和IPSS 致斑马鱼死亡具有相似减毒结果,给药120 h 后,明显降低PSS 或IPSS(400、500 μg/mL)组鱼死亡率(最高降低56.7%),6 dpf的LC50值也分别增加。
斑马鱼代谢研究发现,CEPF 单独给予1 dpf 斑马鱼,主要成分PSS 和IPSS 在给药后4 d(5 dpf)代谢速率明显增加,分别全部脱糖基转化为PS 和IPS,配伍LEEC 后,PSS 和IPSS 代谢速率明显减慢,直至给药后5 d(6 dpf)才全部转化为PS 和IPS。同样杜仲木脂素成分PDG 配伍可减慢PSS 和IPSS 的代谢速度。PS 和IPS 是补骨脂肝损伤相关成分[21-23],补骨脂CEPF 及PSS 和IPSS 致鱼死亡或畸变与代谢物PS 和IPS 的产生密切相关,杜仲LEEC 及PDG 配伍使PS 和IPS 产生减慢,是减毒的重要因素。
用泼尼松龙诱导斑马鱼骨质疏松模型评价,以8 dpf 斑马鱼头骨矿化面积和累积吸光度值为指标,结果表明,LEEC 配伍CEPF(0.5、2.5 μg/mL)组的累积吸光度值显著高于相同质量浓度CEPF 和/或LEEC 单独给药。PDG 配伍PSS 或IPSS(0.4、2.0 μg/mL)组累积吸光度值显著高于PSS 或IPSS 单独给药。斑马鱼头骨累积吸光度值相当于骨质疏松评价金指标“骨密度”,可见上述配伍组合有一定增强抗骨质疏松活性的作用。
综上,用斑马鱼评价发现杜仲配伍对补骨脂香豆素类成分的代谢、毒性及抗骨质疏松活性的多模态变化,发现配伍使糖苷转化为毒性苷元的速度减慢与减毒作用相关,配伍尚能增强抗骨质疏松活性。该方法对中药配伍的效/毒作用起到了快速与精准的辨识,为评价壮骨中药配伍组合的减毒增效作用提供了有意义的方法与构想。
利益冲突所有作者均声明不存在利益冲突
猜你喜欢补骨脂香豆素杜仲补骨脂的化学成分和药理作用研究进展临床医药文献杂志(电子版)(2020年30期)2020-02-281-[(2-甲氧基-4-乙氧基)-苯基]-3-(3-(4-氧香豆素基)苯基)硫脲的合成农药科学与管理(2019年8期)2019-11-23枳中异戊烯基化的黄酮及香豆素类成分天然产物研究与开发(2018年10期)2018-11-06补骨脂果皮和种子中化学成分的分布规律研究*天津中医药(2018年9期)2018-09-14HPLC法同时测定杜仲-当归药对中5种成分中成药(2018年8期)2018-08-29GPR35受体香豆素类激动剂三维定量构效关系研究天然产物研究与开发(2018年6期)2018-07-09香豆素类化合物的抑菌活性研究天然产物研究与开发(2018年2期)2018-04-043种补骨脂炮制品水煎液中4种成分含量的比较中成药(2017年9期)2017-12-19略阳杜仲陕西画报(2016年1期)2016-12-01殃及池鱼小雪花·小学生快乐作文(2015年9期)2015-09-29本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0917/655660.html




