【www.zhangdahai.com--其他范文】
姜鹏飞,于文静,朱凯悦,李 双,董秀萍,温成荣,鲍志杰,孙 娜
(国家海洋食品工程技术研究中心 大连工业大学食品学院 辽宁大连 116034)
罗非鱼 (Oreochromis niloticus) 是一种淡水鱼,作为世界水产业重点培养的养殖鱼类,被誉为未来动物性蛋白质的主要来源之一。
我国现已发展成为全球最大的罗非鱼生产国和出口国[1]。据联合国粮农组织(FAO)统计,2019年我国罗非鱼产量为164.17 万t[2]。
罗非鱼生长速度快、产量高、肌肉加工性能好,极具市场潜力,作为鱼糜生产的主要淡水鱼来源之一[3]。
目前,有文献报道未漂洗鱼糜存在凝胶强度差,凝胶易劣化等问题,国内外研究者已开展较多的研究工作,通过优化加工工艺(超高压、微波、超声辅助等)[4-5]或添加外源物,如某些非肌肉蛋白质[6]、淀粉、盐类[7-8]和酶制剂[9]等来改善鱼糜凝胶品质。
多糖是地球上极为丰富的天然生物高聚物,通常具有显著的流变学特性,如增稠性、稳定性和胶凝性。由于其具有无毒、广泛的可获得性和可再生性等特点,因此作为食品品质改良剂,将其越来越多地应用于食品加工领域[10-11]。
研究显示,与单一蛋白质凝胶体系相比,多糖-蛋白质复合凝胶通常具有更优异的成胶性能和更稳定的凝胶结构[12-13]。因此,多糖-蛋白质复合凝胶被广泛应用于鱼糜加工。然而,多糖种类繁多、结构性质各异,根据带电性的不同可分为阳离子多糖(壳聚糖)、阴离子多糖(如卡拉胶、结冷胶等)和中性多糖(如可得然胶、魔芋胶等)[14]。
不同离子型的多糖结构和性质不同,与蛋白质的复合成胶性能也存在差异,将导致最终产品品质的不同。
本研究以罗非鱼为研究对象,分别加入不同添加量的卡拉胶、魔芋胶和壳聚糖3 种离子型多糖,制备多糖-未漂洗罗非鱼鱼糜。利用物性学、流变学、低场核磁共振技术、显微成像技术等方法,探究3 种多糖对未漂洗罗非鱼鱼糜凝胶的影响。
1.1 材料与试剂
冷冻罗非鱼片,海南翔泰渔业有限公司;
卡拉胶、魔芋胶、壳聚糖,北京宝希迪有限公司。
1.2 仪器与设备
测色仪(UltraScan PRO),美国HunterLab 公司;
物性仪(TA.XT.plus),英国SMS;
核磁共振成像分析仪(MesoQMR23-060H),苏州纽迈电子科技有限公司;
双目生物显微镜(WF10X),扬州精辉试验机械有限公司;
流变仪(CP5000),常州德杜精密仪器有限公司;
傅里叶变换红外光谱仪 (FTIR-650S),天津港东科技股份有限公司。
1.3 试验方法
1.3.1 样品处理方法 冷冻罗非鱼片于4 ℃的冷藏冰箱缓化12 h,使用斩拌机将罗非鱼肉进行第1 次斩拌,时间为5 min,加入3%的NaCl,再进行第2 次斩拌,时间为5 min,以使鱼肉中的盐溶性蛋白充分溶出,添加不同的多糖后,最后再斩拌5 min。
整个试验过程温度需在10 ℃环境中,将斩拌好的鱼糜灌入直径26 mm、 长度50 mm 的胶原蛋白肠衣,用棉线封口。
熟制采用两段加热法,分别是40 ℃加热30 min,90 ℃加热20 min。
加热完成后置于冰水中冷却至室温,4 ℃冰箱中放置过夜,以备后续试验。
1.3.2 白度的测定 将样品切成直径2.5 mm、高25 mm 的圆柱体。
采用色差计测定样品的L*、a*和b*值,每组样品平行测定3 次,计算其白度值,按公式(1)计算:
1.3.3 持水特性 (Water holding capacity,WHC)测定 参照尚珊等[15]的方法,将5 g(W0)的样品用滤纸包裹,使用离心机于6 500×g、10 ℃下离心10 min,离心后样品去除滤纸后称重,记W1。
每组样品测定4 次,取平均值。
按公式(2)计算:
式中,WHC——持水率(%);
W0——样品的原始质量(g);
W1——样品离心后的质量(g)。
1.3.4 低场核磁共振技术 (Low field nuclear magnetic resonance,LF-NMR)测定 将4 g(直径25 mm,高10 mm) 的样品放入40 mm 的核磁管内,测定样品的自旋-自旋弛豫时间(T2),参数设置为P1=23 μs,P2=44 μs,SW=100 kHz,Tw=3 000,NECH=10 000,利用核磁共振弛豫时间反演拟合软件得到T2图像。
1)掌握机插秧龄,做到分批次育秧,及时栽插。把握栽插密度,栽插行距25厘米,株距14~15厘米,对于连续缺穴3穴以上应及时进行人工补苗。
1.3.5 鱼糜凝胶的核磁共振成像(Magnetic resonance imaging,MRI) 采用T2加权成像,通过成像软件中的多层自旋回波(SE)序列来实现。
T2加权成像的重复时间TR=2 000 ms,回波时间TE=20 ms。
1.3.6 质地剖面分析 参考Jiao 等[16]方法稍作修改,样品大小为直径25 mm、高10 mm,探头选取P50,参数设置为:测前速率为1 mm/s,测试速率为1 mm/s,测后速率为1 mm/s,下压比例为50%,触发力为5 g,2 次压缩间隔时间为5 s,每个样品测6 次,取平均值。
1.3.7 凝胶强度测定 凝胶强度测试选取P/5s球形探头,参数设置为:测前速率为1 mm/s,测试速率为1 mm/s,测后速率为1 mm/s,下压比例为50%,触发力为5 g,每个样品测6 次,取平均值。
1.3.8 流变特性测定 参照黄颖等[17]的方法,采用鱼糜糊进行测定,测试条件为变温扫描:振荡频率1 Hz,在1%应变下,温度从25 ℃升温到40 ℃,40 ℃保持30 min,温度从40 ℃升温到90 ℃,90 ℃保持20 min,升温速率为1 ℃/min,测定频率扫描过程中储能模量(G′)和耗能模量(G″)的变化。
1.3.9 傅里叶红外光谱 (Fourier infrared spectroscopy,FTIR)分析 根据Oujifard 等[18]的方法,先将样品冷冻干燥,然后将其研磨至粉末,取粉末与无水溴化钾按照质量比1 ∶100 充分研磨混匀,再于压片机下压成透明薄片,最后使用FTIR 进行样品扫描并采集图谱,采集完成后使用软件OMNIC 8.2.0.387 对图谱进行分析。
1.3.10 切片染色观察 参照梁峰[19]的方法稍作修改,将鱼糜凝胶修整为π25 mm2×10 mm 的圆柱,放入一次性塑料包埋框中并固定,将其经过质量分数80%,95%,100%的乙醇进行梯度脱水,再分别用二甲苯/无水乙醇混合液和二甲苯进行透明。
在烘箱中倒入预熔的石蜡,进行浸蜡操作,待其冷却后将蜡块修整,然后使用切片机切片,切成厚约7 μm 的蜡带,随后进行脱蜡,洗脱,采用苏木素-伊红(HE)溶液染色90 s,随后在显微镜下观察拍照。
1.3.11 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoreses,SDS-PAGE)测定 称取样品2 g,加入18 mL 的5%SDS 溶液,在10 000 r/min 的匀浆机下均质1 min,放入85 ℃水浴锅保温1 h。
样品冷却后用离心机在4 ℃,6 100×g 条件下离心15 min,取上清液。
电泳条件为:分离胶浓度15%,浓缩胶4%。
上样量为10 μL,时间1.5 h。
电极缓冲液:Tris 3.0 g,甘氨酸14.4 g,SDS 1.0 g,加去离子水定容到1 000 mL。
2.1 3 种多糖对罗非鱼鱼糜凝胶白度的影响
随着多糖添加量的提升,罗非鱼鱼糜凝胶的白度均呈先增加后降低趋势,在添加量为1%时白度最大。与空白组样品相比,当添加不同量的卡拉胶和壳聚糖时,白度值均显著增加,可能是由于多糖极易填充到鱼糜凝胶缝隙中,使得光线在通过凝胶结构时发生折射,进而影响罗非鱼鱼糜凝胶白度[20]。
而添加魔芋胶后,与空白样品相比,在添加量为0.5%时变化不显著(P>0.05),继续增大添加量,在1%时白度最大,而在添加量为2%与1%时差异不显著(P>0.05),对鱼糜凝胶白度的影响较小,这可能是因为魔芋胶本身颜色较浅,对鱼糜凝胶白度影响不大。在添加量相同的组间,卡拉胶的白度均大于其它2 种多糖,这可能是因为加入卡拉胶之后凝胶强度较好,从而形成的网络结构较致密,导致光的散射增大,因此白度较大[21]。
上述结果表明,添加卡拉胶后对改善罗非鱼鱼糜凝胶色泽的效果最好。
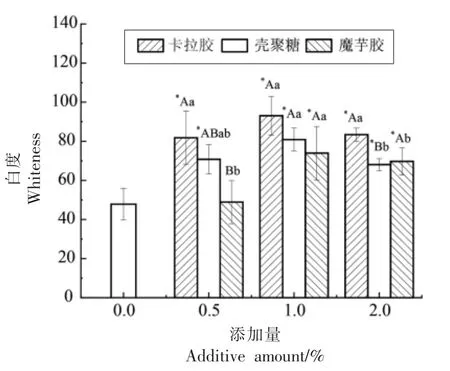
图1 不同添加量下3 种多糖罗非鱼鱼糜凝胶的白度值Fig.1 The whiteness value of three kinds of polysaccharide tilapia surimi gel under different supplemental levels
2.2 3 种多糖对罗非鱼鱼糜凝胶持水性的影响
如图2 所示,添加不同多糖的罗非鱼鱼糜凝胶持水性趋势各有不同。
与空白组相比,添加0.5%~2.0%卡拉胶的鱼糜凝胶持水性均显著升高(P<0.05),而且随着添加量的增加,鱼糜凝胶持水性呈先增加后降低的趋势,在添加量为1%时,呈现最大的持水性。卡拉胶是亲水胶体,分子结构中存在许多亲水基团,这些基团可以与水结合聚集到凝胶网络结构中,鱼糜凝胶网络结构对水分的保持与鱼糜凝胶的强度呈正相关[22]。
对于添加魔芋胶的鱼糜凝胶来说,随着魔芋胶添加量的增加,鱼糜凝胶持水性的增加速率呈先较平缓而后变大的趋势,且在添加量为1%时持水性达到最高;
这与Jian 等[3]研究结果较为一致,其研究发现当魔芋胶添加量超过1.5%后,鱼糜凝胶的保水性增加不显著。添加壳聚糖后,鱼糜凝胶持水性与空白组差异不显著(P>0.05)。
由此可见,添加卡拉胶后,罗非鱼鱼糜凝胶持水性最高,其次是魔芋胶,最低的是壳聚糖。
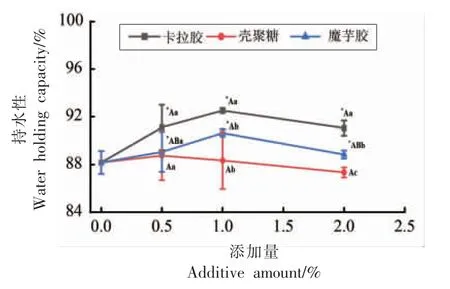
图2 不同添加量3 种多糖罗非鱼鱼糜凝胶的持水性Fig.2 Water holding capacity of tilapia surimi gel with different polysaccharide contents
2.3 3 种多糖对罗非鱼鱼糜凝胶水分分布及组成的影响
LF-NMR 能够反映热诱导鱼糜凝胶水分内部的流动性[23]。
由图3 观察可知,添加3 种多糖的罗非鱼鱼糜凝胶在T2弛豫时间分布均出现了3 个峰,T21、T22和T23,分别对应着结合水、不易流动水和自由水。T21(0.1~1 ms)代表能与大分子表面极性基团相结合的单层水,T22(10~300 ms)代表束缚在凝胶网络中的水,T23(300~1 000 ms)代表存在于鱼糜凝胶网络结构以外的可以任意流动的自由水[24]。3 种多糖的P21、P22和P23的峰面积比例如表1 所示。

表1 卡拉胶对罗非鱼鱼糜凝胶峰面积比例的影响Table 1 Effect of κ-carrageenan on the proportion of gel peak area of tilapia surimi

图3 不同添加量3 种多糖罗非鱼鱼糜凝胶的水分分布Fig.3 Water distribution of surimi gels of three kinds of polysaccharides in tilapia with different supplemental levels
凝胶持水性结果显示,添加卡拉胶与魔芋胶均可提高鱼糜凝胶的持水性,而添加壳聚糖后鱼糜凝胶持水性不存在明显差异,因此为了避免使用离心法对鱼糜凝胶持水性测定所造成的误差,通过核磁共振技术来预测鱼糜凝胶保水性,测定其T2值,观察其水分分布及组成[25]。
结果表明:数据中显示P21弛豫峰的峰面积不存在显著性差异,并且所占的比例几乎可以忽略,因此对鱼糜凝胶持水性影响较小。而影响最大的是P22弛豫峰峰面积,从表中可以看出卡拉胶的不易流动水含量较高,表明其凝胶网络更致密、有序,其次是魔芋胶,而壳聚糖的不易流动水含量较低,自由水含量较高,可能是由于不易流动水转化成了自由水。鱼糜凝胶水分分布和组成分析结果表明,卡拉胶可以有效改善凝胶品质。

表2 壳聚糖对罗非鱼鱼糜凝胶峰面积比例的影响Table 2 Effect of chitosan on the proportion of gel peak area of tilapia surimi
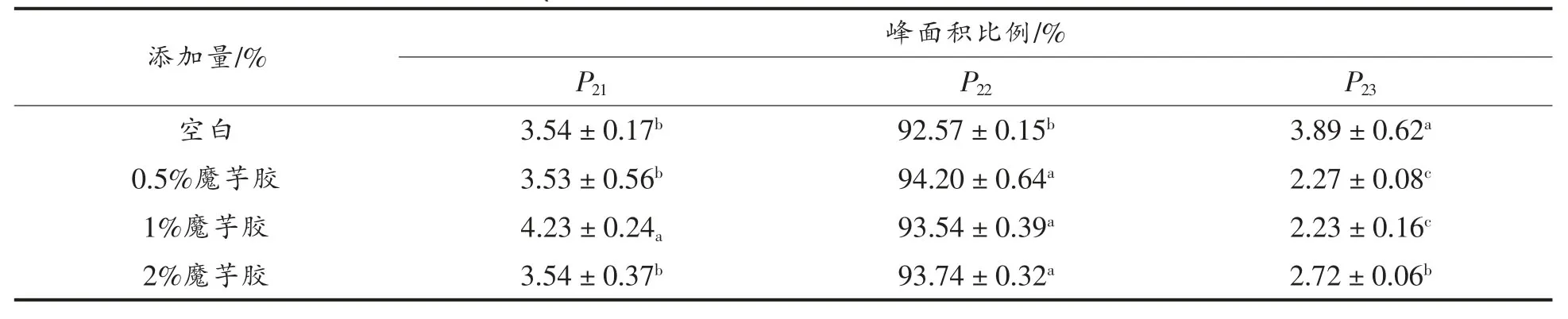
表3 魔芋胶对罗非鱼鱼糜凝胶峰面积比例的影响Table 3 Effect of konjac gum on the proportion of gel peak area of tilapia surimi
2.4 3 种多糖对罗非鱼鱼糜凝胶样品水质子密度(伪彩色图像)的影响
核磁共振成像是在强磁场中利用氢原子激发射频脉冲所产生的磁共振现象,通过空间编码技术对氢原子发出的射频信号相关的质子密度、弛豫时间等参数进行变换,最终由计算机生成图像的技术[26]。图像中红色越深,表明质子密度越高[27]。图4 为罗非鱼鱼糜凝胶样品的MRI 图像,通过观察其颜色分布,可以直观比较T2的水分分布情况。从图中可以观察到空白组样品体积分布不均,鱼糜呈现的孔洞较大,水分保持较差。随着多糖添加量的增加,鱼糜凝胶中的红色部分面积逐渐缩小,表示氢质子的信号强度逐渐下降,其中壳聚糖的水分质子密度最低,并且体积在缩小,水分减少趋势是由外向内减少。
而添加卡拉胶和魔芋胶的试验组鱼糜凝胶水分质子密度相对较高,这可能与鱼糜凝胶的含水量有关,一般来说,含水率与水分质子密度呈正比[28],此MRI 结果与上述的持水性结果一致。

图4 不同添加量3 种多糖罗非鱼鱼糜凝胶样品水质子密度Fig.4 Sub-density of water quality of three kinds of polysaccharide surimi gel samples of tilapia
2.5 3 种多糖对罗非鱼鱼糜凝胶质构的影响
质构特性是评价鱼糜凝胶感官品质的重要参数,它可以间接反映出蛋白质基质的结构完整性以及与其它成分的结合状态[29]。3 种多糖的添加均影响了罗非鱼鱼糜凝胶的质构特性,而弹性特性无明显变化,见图5c。
硬度及咀嚼性的变化如图5a、5b 所示。
与未添加多糖的空白组相比,添加卡拉胶能够显著增加鱼糜凝胶硬度(P<0.05),当添加量为0.5%,1%,2%时,硬度分别增加了155.44,1 168.21,2 252.2 g;
咀嚼性依次增加了93.53,700.99,1 108.22,说明不同添加量的卡拉胶均能显著提高鱼糜的硬度及咀嚼性。
而添加壳聚糖与魔芋胶时,在添加量为0.5%时,并没有提高鱼糜的硬度及咀嚼性,在添加量为1%时,硬度及咀嚼性分别增加了281.14,336.43 g 和172.86,333.14;
添加量为2%时,分别增加了1 006.46,617.45 g 和712.91,427.16。
这表明多糖的加入使得鱼糜在发生相同形变时所产生的应力增大[30],并保持鱼糜凝胶结构的紧密连接,口感得以改善,且多糖添加量≥1%能显著提高鱼糜凝胶质构特性。
由数据可知,加入卡拉胶后,罗非鱼鱼糜凝胶硬度、咀嚼度的提升效果最佳。
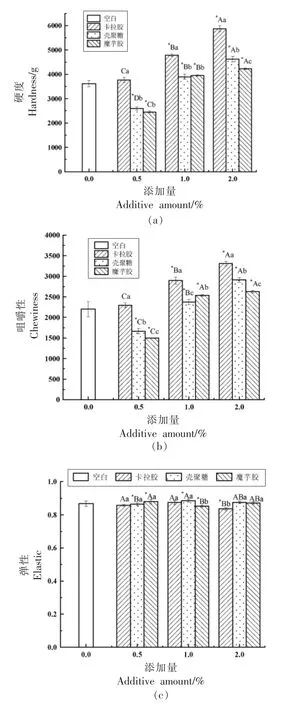
图5 不同添加量3 种多糖罗非鱼鱼糜凝胶质构Fig.5 Gelation of tilapia surimi with different amounts of polysaccharide
2.6 3 种多糖对罗非鱼鱼糜凝胶强度的影响
从图6a 可以看出,添加3 种多糖后,罗非鱼鱼糜凝胶的破断力出现显著变化,均随着添加量的增加逐渐增加,尤其是添加卡拉胶后,其破断力显著增强。与空白组相比,添加卡拉胶的鱼糜凝胶破断力显著高于其它2 种多糖(P<0.05),在2%时达到最大值(490.60 g),其次是壳聚糖(409.27 g),最低为魔芋胶(268.51 g)。
不同多糖对鱼糜凝胶破断距离的影响略有不同,见图6b,不同添加量下的卡拉胶和壳聚糖的破断距离均高于空白组样品,而魔芋胶组随着添加量的增加,破断距离呈不断下降趋势。Zhang 等[31]研究结果表明当多糖浓度较高时,可能会发生热力学不相容的现象,会与鱼糜凝胶中的蛋白出现相分离,分为多糖相和蛋白相,最终导致鱼糜凝胶破断距离下降。凝胶强度是破断力和破断距离的乘积,是评价鱼糜制品凝胶特性的重要指标[32]。
图6c 显示了3 种多糖对鱼糜凝胶强度的影响。
与未添加多糖的空白组样品比较,卡拉胶和壳聚糖的凝胶强度都有显著的提高(P<0.05)。
不同添加量的魔芋胶并未引起凝胶强度的增加(P>0.05)。贾丽娜[33]研究发现无论哪一种加热温度,分子质量为923.8 ku 的魔芋胶与肌原纤维蛋白形成的复合凝胶凝胶强度显著低于空白组,可能由于魔芋胶的添加,魔芋胶与肌原蛋白发生反应,导致蛋白内部结构发生变化,蛋白间的相互作用变弱。
在添加量相同的组间,添加量为0.5%时,不同多糖的鱼糜凝胶强度之间的差异不显著(P>0.05),而继续增加多糖,卡拉胶的凝胶强度表现出较大的提升,并且与空白组样品1 585.54 g·mm 的凝胶强度相比,添加量为2%的鱼糜凝胶达到3 765.35 g·mm,凝胶强度显著提高(P<0.05)。
3 种多糖,添加卡拉胶凝胶强度最大,与质构的研究结果一致。

图6 不同添加量3 种多糖罗非鱼鱼糜凝胶强度Fig.6 Gelation strength of tilapia surimi with three polysaccharides added at different levels
2.7 3 种多糖对罗非鱼鱼糜凝胶流变性质的影响
流变学特性是指在外力作用下鱼糜的黏弹性变化,通常储能模量G" 可以作为鱼糜凝胶形成的指标,能反映鱼糜凝胶形成过程中三维网络结构的形成[34]。由图7 可以看出,鱼糜中的损耗模量G"随温度变化的增速慢于储能模量G",而趋势基本一致,因此主要以分析弹性特性为主。在相同的温度范围内,所有试验组的G" 值的变化趋势基本保持一致,均出现先上升后下降再升高的趋势。从图7(1a)、(2a)、(3a)中可以看出,与空白值(3 959.41 Pa)相比,添加3 种多糖后均能提高罗非鱼糜凝胶最终的储能模量,说明多糖的添加可以提高未漂洗鱼糜的流变学特性。
而由图7(1b)可以看出,相对于空白组,在升温过程中只有添加2%卡拉胶才能使鱼糜G"提高。一般来说,G"值越大,凝胶强度越强,这与凝胶强度的测试结果一致。
由图7(2b)可得不同壳聚糖鱼糜凝胶G" 均低于空白组。
然而,随着温度G" 的升高,2%的壳聚糖明显高于其它两种多糖组与空白组,这说明高温更有利于鱼糜形成凝胶。
由图7(3b)可以看出添加魔芋胶的试验组与其它多糖组趋势一致,然而其G" 与空白组较为接近,说明直接添加魔芋胶并不利于凝胶内部结构的形成。
原因可能是因为黏性很强的魔芋胶易于填充在鱼糜蛋白间,导致与鱼糜蛋白接触机会减少,从而阻碍凝胶网络结构的形成[35]。


图7 3 种多糖对罗非鱼鱼糜凝胶流变性质的影响。
(a)升温过程;
(b)恒温过程-前30 min 为40 ℃,后20 min 为90 ℃Fig.7 Effect of three kinds of polysaccharides on rheological properties of tilapia surimi gel.(a) the heating process;
(b) constant temperature process- 40 ℃for the first 30 min and 90 ℃for the second 20 min
2.8 3 种多糖对罗非鱼鱼糜凝胶蛋白二级结构的影响
研究蛋白质二级结构的常用方法之一就是傅里叶红外光谱技术。
由图8a 可以看出,添加不同多糖的鱼糜凝胶吸收峰的位置差异较小,而特征峰形存在一定变化。
其中二级结构中最有研究意义的区域是酰胺Ⅰ带,包括β-折叠(1 610~1 640 cm-1)、无规则卷曲(1 640~1 650 cm-1)、α-螺旋(1 650~1 658 cm-1)和β-转角(1 660~1 670 cm-1)。图8 中的柱状图是不同波长所对应的二级结构以及根据各特征峰的面积计算出的二级结构的含量。
添加多糖后,鱼糜凝胶的蛋白构象发生了变化。
由图8(1b)可知,鱼糜样品在卡拉胶添加量为0.5%和1%,α-螺旋含量为0%,与空白组相比,β-折叠含量依次增加了2.63%和6.43%,无规则卷曲结构含量依次增加了0.85%和3.87%,β-转角含量依次减少了6.06%和13.25%。由于β-折叠的稳定性高于α-螺旋,因此含有较高β-折叠含量的凝胶及其质构特性更好。
2%的卡拉胶鱼糜凝胶蛋白质相对含量与空白组差异不显著,说明2%卡拉胶加入并没有改变蛋白质二级结构。
图8(2b)可以发现0.5%~1%的壳聚糖鱼糜凝胶蛋白质二级结构与空白组相比无明显差异,继续增加添加量,α-螺旋的相对含量变为0%,原因可能是蛋白质受热变性之后破坏了蛋白内部的螺旋结构,导致蛋白结构由不稳定变为稳定,从而使α-螺旋的含量降低,β-折叠含量增加[36]。
在图8(3b)中添加魔芋胶鱼糜凝胶蛋白质与空白相比,α-螺旋和β-折叠相对含量呈现减少趋势,β-转角增加,无规则卷曲结构无明显差异。整体来说,添加魔芋胶对鱼糜凝胶的二级结构影响差异不显著。在所有处理组中,多糖的加入改变了鱼糜蛋白的构象,添加卡拉胶更有利于形成凝胶强度更强和持水性更高的鱼糜网络结构。

图8 不同添加量3 种多糖罗非鱼鱼糜凝胶蛋白二级结构Fig.8 Secondary structure of gelatinous protein of tilapia surimi with different dosage of three polysaccharides
2.9 3 种多糖在罗非鱼鱼糜凝胶中的空间分布
伊红是一种生物染料,染色后可以使细胞质和细胞外基质呈红色。
鱼糜样品经过伊红染色之后,红色部分是由肌肉蛋白质所形成的部分,而添加多糖之后呈无色。在加热过程中,多糖可能会与肌肉蛋白相结合,然而当浓度较高时,多糖自身会吸水溶胀,并与肌肉蛋白出现相分离[19]。
因此,此法可以用来观察鱼糜凝胶中蛋白相和多糖相的分布。随着3 种多糖添加量的增加,未染色区域面积逐渐增多且逐渐增大,空白组样品未染色区域很少,并且比较均匀,仅有一些小孔隙可能与样品处理中的气泡有关。
3 种多糖中,添加卡拉胶后红色区域结构较均匀,孔洞数量较少,微观结构较致密,而多糖相部分随着添加量的增加而增大。添加壳聚糖后微观结构中存在孔洞,随着添加量的增多,未染色区域逐渐增大。添加魔芋胶后未染色区域面积最大且最多,此外红色区域呈现的蛋白相结构不均一,网格孔隙较大,这也导致添加魔芋胶后,鱼糜凝胶的破断力和凝胶强度显著降低。也有可能是水分的变化影响罗非鱼鱼糜凝胶结构,在凝胶形成的过程中,加入多糖后会与原本鱼糜凝胶中的水分相结合,这可能也是导致鱼糜凝胶持水性变化的原因[19]。
2.10 多糖对罗非鱼鱼糜凝胶SDS-PAGE 电泳图谱的影响
鱼糜以肌球蛋白重链 (MHC) 和肌动蛋白(Actin)为主要蛋白[37]。一般而言,鱼糜凝胶能力与其主要蛋白的含量呈正相关,蛋白条带颜色的深浅代表了蛋白含量的高低。图10 显示了添加不同量卡拉胶的罗非鱼鱼糜凝胶电泳图谱。
从图中可以看出,空白组和试验组的MHC 和Actin 条带颜色均未发生明显的变化,说明卡拉胶不会影响鱼糜凝胶的蛋白组分,推测卡拉胶可能是以填充剂的形式存在鱼糜凝胶网络结构中,对于蛋白质之间的交联和聚集影响较小[22]。汤嘉慧[22]的研究结果显示添加卡拉胶和卡拉胶+KCl 凝胶体系的鱼糜蛋白电泳条带跟空白对照组一样,加热均导致了MHC 条带的消失。
说明卡拉胶和卡拉胶+KCl 凝胶体系的添加对蛋白质的聚合和降解没有影响,不能抑制蛋白质的降解。
王聪[20]研究了不同含量羟丙基淀粉添加后白鲢鱼糜的凝胶电泳图谱,研究结果显示淀粉的添加未使蛋白条带发生明显变化,说明淀粉可能以填充剂的形式存在于鱼糜凝胶结构中,对于蛋白组分影响不大。
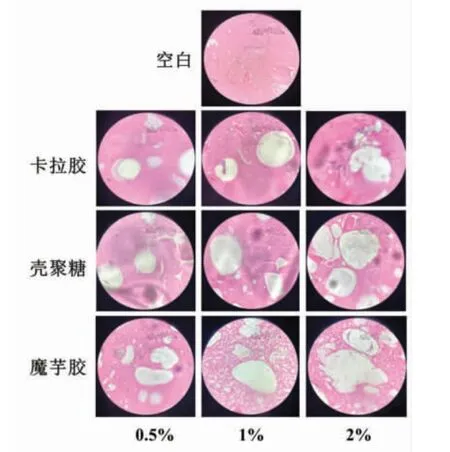
图9 不同添加量3 种多糖在罗非鱼鱼糜凝胶中的空间分布Fig.9 Spatial distribution of three polysaccharides with different supplemental levels in tilapia surimi gel

图10 不同添加量卡拉胶罗非鱼鱼糜凝胶蛋白SDS-PAGE 电泳图谱Fig.10 SDS-PAGE electrophoresis of gelatine protein of tilapia surimi with different levels of carrageenan
不同多糖及其添加量对罗非鱼鱼鱼糜的凝胶特性具有显著影响,3 种多糖均可改善鱼糜的凝胶强度、持水性、白度、质构,且卡拉胶在改善鱼糜凝胶特性方面具有更好的效果。
在鱼糜凝胶水分分布的研究中显示卡拉胶的添加能充分吸收罗非鱼鱼糜凝胶中的水分,提高鱼糜凝胶的持水性。动态流变特性测定结果表明,在升温阶段添加卡拉胶的罗非鱼鱼糜G"值最大。二级结构的结果显示添加卡拉胶的罗非鱼鱼糜二级结构以稳定的β-折叠结构为主,微观结构结果表明添加卡拉胶后的罗非鱼鱼糜凝胶具有较好的凝胶网格,组织结构致密,因此卡拉胶的添加能有效增强罗非鱼鱼糜凝胶特性。然而,SDS-PAGE 电泳结果显示卡拉胶的添加对罗非鱼鱼糜凝胶蛋白组分影响较小。该研究结果可作为后续试验的基础,并为鱼糜产品新原料的开发提供数据支持。
猜你喜欢鱼糜卡拉胶罗非鱼卡拉胶多糖的分子修饰:卡拉胶酶和硫酸化酶的研究进展食品与生物技术学报(2022年10期)2022-11-30什么是卡拉胶?大自然探索(2022年10期)2022-11-27水合温度、胶用量和氯化钾用量对kappa-卡拉胶胶液黏度的影响食品与机械(2022年10期)2022-11-01卡拉胶酶的来源、性质、结构与应用研究进展生物加工过程(2022年5期)2022-10-24鱼糜及鱼糜制品中水分研究进展中国食品学报(2019年12期)2020-01-02罗非鱼养殖模式当代水产(2019年4期)2019-05-16贸易战,罗非鱼首当其冲!面临众多不利因素,昔日的王者罗非鱼还能打一场翻身战吗?当代水产(2018年8期)2018-11-02金鲳鱼加工技术与综合利用研究进展肉类研究(2018年2期)2018-05-14新技术对鱼糜凝胶特性的影响安徽农业科学(2018年25期)2018-05-14罗非鱼 年总产量全国第三位农家之友(2018年12期)2018-03-12本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0918/656257.html




