【www.zhangdahai.com--其他范文】
包涛涛,鲜思美,顾庆林,杨 倩,梁 倩,杨先富,吴通奎,王正文,廖 飞
(1.贵州大学 动物科学学院,贵州 贵阳 550025;
2.贵州省黔东南州农业农村局,贵州 黔东南 556000;
3.贵州省动物疫病研究所,贵州 贵阳 550025;
4.贵州农业职业学院,贵州 贵阳 550000)
鸭疫里默氏杆菌(Riemerllaanatipstifer,RA),是一种可引起雏鸭、鹅和火鸡等多种禽类发病的重要细菌性病原。通常由RA感染所引起的疾病又称为鸭疫里默氏杆菌病、鸭传染性浆膜炎及鸭败血症等[1-2]。作为禽类养殖生产环节中危害养禽业最为严重的细菌性传染病之一,该病在世界各地广为流行,为养殖户带来了巨大的经济损失,严重制约着养禽业的快速发展。目前国际上公认RA的血清型至少有21种[3],不同血清型之间无明显的交叉保护为RA的防控增加了难度[4]。
外膜微孔蛋白(outer membrane porin protein,Porin)是一种膜通道蛋白,其暴露于革兰阴性菌的表面,具有高度免疫原性,也可诱导宿主产生免疫应答、参与细菌耐药及补体活化等[5-6]。有研究表明porin基因具有高度保守性,可应用于菌株的鉴定,是菌体重要的抗原成分,能够为各型菌株提供交叉免疫保护[7-10]。Porin蛋白在其他不同血清型的细菌中作为共同抗原成分研究较为广泛,且均已取得较好的研究成果。而关于RA共同抗原成分研究则主要集中在外膜蛋白A(OmpA)及脂质蛋白(Lpp)上,对RA的Porin蛋白研究甚少。么乃全[11]针对RA的Porin蛋白做了前期初步研究,证实porin基因为8种血清型RA所共有且具有较高保守性,同时也通过构建重组真核表达质粒免疫小鼠证实了Porin蛋白具有良好的免疫原性,为后期RA各种血清型的免疫交叉保护反应及“抗原-抗体”反应提供了一定的试验依据。
RA的血清学检测方法主要包含琼脂凝胶免疫扩散试验、凝集试验、荧光抗体法、间接免疫酶组织化学法、免疫亲和传感器检测技术、ELISA检测技术及免疫胶体金检测技术等方法,其中以间接ELISA最为常用,因其具有简单、快捷、敏感性高且无需借助价格高昂的仪器等优点使其更易于在基层推广。目前国内外关于RA抗体检测的ELISA方法大多以菌体裂解蛋白、外膜蛋白A、脂多糖、PN45蛋白、P25蛋白及Cam蛋白等为包被抗原[12],而使用RA的Porin蛋白作为包被抗原建立ELISA用于RA抗体水平检测尚未见报道。为建立一种高效便捷可适用于基层防控RA的血清学诊断技术,本研究以RA的porin基因为研究对象,通过构建重组原核表达质粒pET-32a-porin,将其转化至E.coliBL21(DE3),加入IPTG后诱导表达出重组Porin蛋白,以其为包被抗原,采用方正滴定法对不同反应条件加以优化,建立一种可用于RA抗体检测的间接ELISA方法(Porin-ELISA),旨在为RA的诊断及血清学监测提供技术支持。
1.1 菌株、质粒、血清及主要试剂大肠杆菌感受态细胞(DH5α)、BL21(DE3)、限制性内切酶BamHⅠ、Xho Ⅰ、PrimeSTAR HS DNA Polymerase及连接酶SolutionⅠ购自天根生化科技(北京)有限公司;
血清2型RA贵州分离株、pET-32a、经商品化试剂盒鉴定的RA阳性/阴性血清、禽流感病毒(AIV)H5亚型、AIV H7亚型、新城疫病毒(NDV)、鸭圆环病毒(DuCV)、鸭坦布苏病毒(DTMUV)及E.coli阳性血清由贵州省动物疫病与兽医公共卫生重点实验室保存,其他样品血清采自贵州部分地区规模化及偏远山区养鸭场;
2×Taq PCR Master Mix及DL Plus 2000 DNA Marker购自GenStar公司;
DNA凝胶回收及质粒小量提取试剂盒购自Omega公司;
SDS-PAGE凝胶配制试剂盒、BeyoGoldTMHis-tag Purification Resin蛋白纯化试剂盒、特超敏ECL化学发光试剂盒、BCA蛋白浓度测定试剂盒购自碧云天生物技术有限公司;
预染蛋白Marker、IPTG、PVDF膜、脱脂奶粉及牛血清白蛋白购自Solarbio公司;辣根过氧化物酶(HRP)标记兔抗鸭IgG购自Immunoway公司;
鸭传染性浆膜炎抗体(serositis Ab)ELISA试剂盒购自上海雅吉生物科技有限公司。
1.2 RA DNA核酸的提取将血清2型RA贵州分离株取10 μL接种至5 mL TSB液体培养基(含4%新生牛血清),37℃、160 r/min培养14 h后收集细菌悬液。参照细菌基因组DNA提取试剂盒提取RA的DNA,-20℃保存备用。
1.3 引物设计与合成根据GenBank所登录RA的phosphate-selectiveporinO和P基因序列(登录号:CP002346.1),弃去porin基因序列前端54 bp(18个氨基酸)信号肽序列,在上、下游引物的5′端分别引入BamHⅠ及XolⅠ酶切位点并添加保护碱基(矩形框内部分)。引物porin(F):5′-TAGGATCCCAAGAAGTTAAAGTACCAGATAC-3′;
porin(R):5′-CGCTCGAGTTAAATTCCTATT-TCTACTTG-3′。预扩增基因大小为1 216 bp,引物由生工生物工程(上海)有限公司合成。
1.4porin基因的扩增及重组表达质粒pET-32a-porin的构建以1.2中提取的细菌DNA为模板进行PCR扩增,PCR产物与pET-32a原核表达载体分别用BamHⅠ、XhoⅠ进行双酶切,回收后连接,构建重组表达质粒pET-32a-porin。对重组表达质粒pET-32a-porin进行双酶切验证,同时将重组质粒送测序公司测序鉴定。
1.5 Porin蛋白的纯化及Western blot鉴定经鉴定正确的pET-32a-porin转化至E.coliBL21(DE3),挑取阳性克隆子转为液体培养,使用IPTG诱导表达出Porin蛋白,先经梯度复性再经BeyoGoldTMHis-tag Purification Resin蛋白纯化试剂盒纯化蛋白,取20 μL纯化后的Porin蛋白进行SDS-PAGE分析纯化效果。以鸭RA阳性血清为一抗血清,兔抗鸭IgG为二抗血清,开展Western blot鉴定。
1.6 间接ELISA方法(Porin-ELISA)的建立
1.6.1抗原最佳包被质量浓度及血清最佳稀释倍数的筛选 采用方正滴定法对重组Porin蛋白包被浓度及一抗稀释倍数进行优化:用碳酸盐包被液对蛋白(原质量浓度为0.153 g/L)分别进行160,320,640,1 280,2 560,5 120,10 240,20 480倍(对应蛋白质量浓度分别为0.956,0.478,0.239,0.119,0.060,0.030 mg/L)稀释,包被于96孔酶标板,4℃过夜,洗涤3次,每次1~2 min,用5%的脱脂奶粉封闭2 h;
将鸭RA阳性及阴性血清分别按1∶25,1∶50,1∶100,1∶200稀释作为一抗孵育1 h;
洗涤3次,每次1~2 min,加入HRP标记的兔抗鸭IgG(1∶4 000)孵育1 h;
洗涤4次,每次1~2 min,加入100 μL TMB显色液避光显色10 min;
使用50 μL终止液终止显色,酶标仪测定D450 nm值。根据样本P/N值(阳性血清D450 nm值/阴性血清D450 nm值)最大值对应孔的相关条件作为最佳反应条件,筛选出最佳抗原包被质量浓度及一抗稀释倍数。
1.6.2最佳抗原包被条件的优化 以上述筛选出的条件开展试验,设置4℃包被过夜、37℃ 作用1 h后再于4℃包被过夜及37℃ 1 h包被3种包被条件,其余步骤同上,筛选出最佳抗原包被条件。
1.6.3封闭液的选择 以上述筛选出的条件开展试验,取5%脱脂奶粉及1% BSA 2种封闭液进行封闭液优化,以优化的一抗稀释倍数进行孵育,其余步骤同上,筛选出最佳封闭液。
1.6.4最佳封闭时间的优化 以上述筛选出的条件开展试验,分别采用37℃ 0.5 h,37℃ 1 h,37℃ 1.5 h及37℃ 2 h不同封闭时间进行封闭,其余步骤同上,筛选出最佳封闭时间。
1.6.5一抗及酶标二抗最佳孵育时间的优化 以上述筛选出的条件开展试验,分别对一抗及酶标二抗孵育时间进行优化,孵育时间设置为0.5,1.0,1.5,2.0 h,其余步骤同上,筛选出一抗及酶标二抗最佳孵育时间。
1.6.6最佳酶标二抗稀释倍数的优化 以上述筛选出的条件开展试验,将HRP标记的兔抗鸭IgG分别进行4 000,8 000,12 000,16 000稀释,其余步骤同上,筛选出最佳酶标二抗稀释倍数。
1.6.7TMB最佳显色时间的优化 以上述筛选出的条件开展试验,设置5,10,15,20 min 4种TMB显色时间,其余步骤同上,筛选出最佳TMB显色时间。

1.6.9敏感性试验 对Porin-ELISA方法进行敏感性试验,将RA阳性血清分别进行100,200,400,800,1 600,3 200,6 400,12 800,25 600,51 200倍稀释,分析Porin-ELISA敏感性。
1.6.10特异性试验 对Porin-ELISA方法开展特异性试验,检测AIV H5亚型、AIV H7亚型、NDV、DuCV、DTMUV及E.coli的阳性血清,同时设立阴阳性对照,每个样本3个重复,分析Porin-ELISA特异性。
1.6.11重复性验证 对Porin-ELISA方法开展重复性试验,选取7份RA不同滴度的阳性血清,进行批内及批间重复性试验验证,计算变异系数(CV),评价该方法重复性。
1.7 符合性试验使用商品化ELISA抗体检测试剂盒与本试验建立的Porin-ELISA同时检测73份血清样品,比较2种方法的符合率。
1.8 临床应用采用Porin-ELISA对采集的801份血清开展抗体检测分析(626份为已免疫鸭传染性浆膜炎二价灭活疫苗“血清1型+血清2型”的样品血清,175份为未免疫任何鸭传染性浆膜炎疫苗的样品血清),同时设立阴、阳性对照,掌握RA病在贵州部分地区的免疫抗体水平及流行情况。
2.1 pET-32a-porin重组质粒的鉴定双酶切后获得5 900,1 216 bp的pET-32a空载体及目的基因片段(图1)。经测序证实结果正确。

M.DL5000 DNA Marker;
1.pET-32a-porin质粒酶切产物
2.2 重组蛋白的纯化和Western blot结果分析超声裂解菌液,SDS-PAGE分析蛋白主要以包涵体形式存在,Porin蛋白大小约为63 kDa,与预估蛋白大小较为一致(图2)。使用RA阳性血清分析其抗原性,Western blot结果表明该蛋白能与RA阳性血清发生特异性反应(图3)。

M.蛋白Marker;
1.菌体裂解沉淀;
2.菌体裂解上清;
3.蛋白上柱后的穿流液;
4.纯化后的Porin蛋白

M.蛋白Marker;
1.重组Porin蛋白;
2.pET-32a空载体
2.3 间接ELISA方法的建立
2.3.1ELISA方法抗原及抗体的最佳工作质量浓度及反应条件 通过方正滴定法筛选最佳蛋白包被浓度、待检血清与酶标二抗稀释倍数、包被条件、封闭液、封闭时间、待检血清与酶标二抗反应时间及TMB显色时间等。结果显示,当蛋白包被质量浓度为0.478 mg/L,37℃ 1 h后4℃包被过夜,1% BSA 于37℃封闭2 h,待检血清以1∶100倍稀释,与包被抗原在37℃反应1 h,酶标二抗以1∶8 000倍稀释,与待检血清在37℃反应1 h,加入TMB置于37℃避光显色10 min,P/N值达到最大。


图4 阴性血清检测结果
2.3.3敏感性试验 使用Porin-ELISA方法检测RA阳性血清,当血清按照1∶6 400倍稀释时,血清样本D450 nm值为0.66,仍大于临界值0.458,结果仍为阳性(图5),表明所建立的ELISA方法敏感性较好。
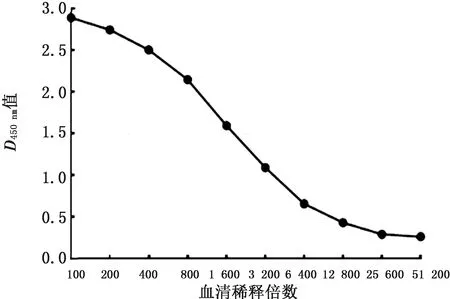
图5 敏感性检测结果
2.3.4特异性试验 使用Porin-ELISA方法进行特异性试验,结果显示,阴、阳性结果成立,且AIV H5亚型、AIV H7亚型、NDV、DuCV、DTMUV、E.coli及RA阴性血清的D450 nm值均小于临界值0.458(表1),结果表明所建立的ELISA方法特异性较好。

表1 特异性试验
2.3.5重复性试验 分别以相同及不同批次Porin重组蛋白作为包被抗原,开展批内及批间重复性试验,结果显示,批内CV在1.27%~4.90%之间,批间CV在2.59%~5.43%之间(表2),两者其CV均符合国家标准《生物制品质量控制分析方法验证技术审评一般原则》中所规定的20%,结果表明所建立的ELISA方法具有良好的重复性及稳定性。

表2 重复性试验
2.4 符合性试验使用本研究建立的Porin-ELISA与商品化ELISA抗体试剂盒对采集的73份鸭血清样本开展检测,计算2种方法符合率。由表3可见,Porin-ELISA检测样本中有20份阴性血清及53份阳性血清,商品化ELISA抗体试剂盒检测样本中有18份阴性血清及55份阳性血清。商品化ELISA抗体试剂盒阳性样本中经Porin-ELISA检测有2份为阴性血清样本,商品化ELISA抗体试剂盒阴性样本中经Porin-ELISA检测全为阴性血清样本。同为阴性样本有18份,同为阳性样本有53份,2种方法符合率为97.26%(71/73)。

表3 符合性试验
2.5 临床样品的检测结果使用建立的Porin-ELISA对801份临床采集的血清样品进行抗体检测,其中626份鸭血清采自已经免疫鸭传染性浆膜炎二价灭活疫苗(血清1型+血清2型)的商品鸭,其余175份鸭血清采自未免疫鸭传染性浆膜炎疫苗的商品鸭。由表4可见,在检测已免疫鸭传染性浆膜炎二价灭活疫苗的鸭血清中,有564份为抗体阳性,检出阳性率为90.10%(564/626);
在检测未免疫鸭传染性浆膜炎二价灭活疫苗的鸭血清中,有36份为抗体阳性,检出阳性率为20.57%(36/175)。
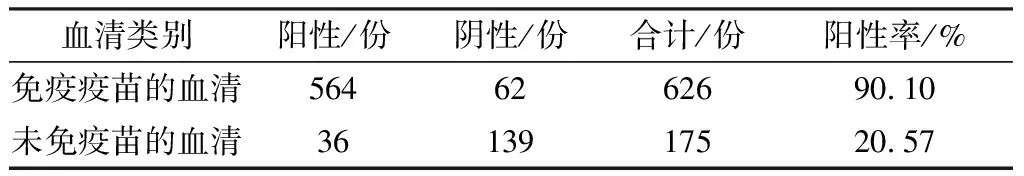
表4 临床样本检测结果
革兰阴性菌的外膜是一种由蛋白质、脂多糖及磷脂等多种物质构成的复合性结构,约占细胞壁干重的80%,是革兰阴性菌中重要组成部分。而其中的外膜蛋白具有良好的免疫原性,可以同时诱导机体产生细胞免疫及体液免疫,在不同血清型细菌之间可发生免疫交叉保护,是一种存在于异种血清型细菌中潜在的共同抗原成分,故当前以外膜蛋白的研究较为多见[13]。OmpA、Lpp及Porin等是外膜蛋白中主要成分[14]。其中微孔蛋白作为外膜蛋白中一种典型的膜通道蛋白,具有高度的免疫原性及保守性[15]。YADAV等[16]用重组表达的嗜水气单胞菌孔蛋白OmpF免疫小鼠,在免疫49 d的小鼠体内仍可检测到较高的免疫球蛋白IgG滴度,同时也发现,孔蛋白OmpF的抗血清与不同亲水性的嗜水气单胞菌均能发生特异性反应。LI等[17]研究表明,副溶血弧菌的孔蛋白VP1061和VP2850对鱼类及小鼠溶藻弧菌、嗜水气单胞菌及荧光假单胞菌的感染具有交叉抗性,有望成为新型多价疫苗。TAN等[18]皮下及腹腔注射B型多杀性巴氏杆菌(Pasteurellamultocida,Pm)孔蛋白OmpH免疫小鼠,可分别对小鼠提供80%及100%抗同型Pm株的抗感能力。有研究表明,弧菌及嗜水气单胞菌均具有porin基因,且其在两者之间具有较好的种属特异性及保守性,可广泛用于弧菌及气单胞菌的分子鉴定[7,19]。焦红梅等[20]通过PCR技术扩增并获得淋病奈瑟菌WHO株孔蛋白PorB基因,将其与GenBank公布的MS11等多株不同血清型淋病奈瑟菌的孔蛋白PorB序列进行比对,结果发现,所克隆的WHO株PorB基因与其他PorB基因同源性为100%,通过原核表达方式获得大小约为40 kDa的淋病奈瑟菌孔蛋白Por B,Western blot分析其反应原性,间接ELISA检测免疫血清的抗体水平,所得的重组蛋白Por B可适用于淋病奈瑟菌疫苗诱导后抗体应答的检测,该研究为淋病奈瑟菌的感染诊断及其疫苗研发奠定了基础。
本试验前期将血清2型RA贵州分离株的微孔蛋白porin基因克隆并与么乃全[11]报道的8种血清型RA的porin基因进行比对分析,结果显示其同源性高达100%,以此证实porin基因具有较高的保守性,Porin蛋白极有可能成为RA多种血清型共同抗原的潜质。为将Porin蛋白原核表达方式尽量转为上清表达,保证其完整的抗原活性,故本试验使用原核表达载体pET-32a,最初选择原因是因其自带2个纯化标签,分别为Thioredoxin标签及His标签,且Thioredoxin标签具有较强的促溶作用,更加有利于重组蛋白的上清表达[21],而His标签纯化试剂盒在当前使用较为广泛且其价格低廉,基于其双重优点,故本研究选择pET-32a作为原核表达载体,但最终表达出的Porin蛋白表达形式仍为包涵体。本试验表达出的Porin蛋白可溶性形式与么乃全[11]所表达RA的Porin蛋白可溶性形式结果一致。试验后期拟通过改变温度、IPTG浓度及诱导时间对Porin蛋白表达形式加以改变,但最终结果并不理想。分析其原因,可能是由于RA的Porin蛋白在原核表达系统中表达量过高、蛋白合成速度过快以至于其无足够的时间进行蛋白折叠,从而使重组蛋白之间出现过多的非特异性结合,最终导致其不能及时溶解而产生了包涵体蛋白。通过对蛋白表达条件的优化、改造宿主细胞及融合蛋白是当前改变包涵体表达的主要方式,尝试以上方法有可能将包涵体表达方式转为可溶性表达[22]。因此,在后期开展对抗原活性要求较高如蛋白功能性试验时,需进一步对其表达方式加以摸索研究。
对本试验纯化的Porin蛋白开展Western blot分析,Porin蛋白能与鸭RA阳性血清发生特异性反应,证实Porin蛋白具有较好的反应原性。在ELISA检测方法建立过程中,影响其试验结果的因素较多,如重组蛋白纯度、包被质量浓度。重组蛋白纯度高低对ELISA试验结果影响较为显著,低纯度会导致试验结果出现假阳性,而高纯度才能保证试验达到理想效果[23]。本试验中,一方面梯度洗涤及洗脱纯化出重组Porin蛋白,经SDS-PAGE分析纯度尚可,另由于多次洗涤作用,所得蛋白浓度偏低,但好在ELISA方法所需包被蛋白较少;
另一方面根据研究表明,用于ELISA方法建立的最适蛋白包被质量浓度一般以0.5~20 mg/L为宜,以原蛋白1∶160倍稀释(0.956 mg/L)作为最高包被质量浓度依次倍比稀释,ELISA方正滴定法确定最佳抗原包被质量浓度为0.458 mg/L,后期试验证实,并未出现明显假阳性及假阴性等异常现象[24-25]。此外,若因包被抗原浓度过高,蛋白之间的频繁作用通常就会导致蛋白分子多层化,在洗涤时极易将包被蛋白洗脱,从而导致试验结果出现非特异性[26]。当包被蛋白质量浓度过低,则固相载体内的吸附抗原量就会不足,从而导致试验结果出现假阴性。因此,在建立ELISA检测方法时,需要严格控制抗原包被质量浓度。
使用AIV H5亚型、AIV H7亚型、NDV、DuCV、DTMUV、E.coli阳性血清对本研究建立的Porin-ELISA进行交叉反应研究,结果证实,Porin-ELISA具有良好的特异性;
对Porin-ELISA敏感性进行检测,当RA阳性血清按照1∶6 400倍稀释时,其D450 nm值为0.66,大于Cut-off临界值0.458,以此证实Porin-ELISA具有较高的敏感性;
批内及批间重复试验结果显示,Porin-ELISACV均小于10%,低于国家标准20%,说明该方法具有较好的重复性和稳定性。此外,Porin-ELISA与商品化ELISA抗体试剂盒的检测符合率较高,可达97.26%。本试验建立的Porin-ELISA具有良好的重复性、敏感性及特异性,且与商品化试剂盒具有较高的符合率,可以初步用于临床上RA的抗体检测分析。
使用建立的Porin-ELISA对801份临床采集的血清样品进行RA抗体检测,结果显示,在已免疫鸭传染性浆膜炎二价灭活疫苗的鸭血清抗体中,检出阳性率为90.10%(564/626),在未免疫鸭传染性浆膜炎二价灭活疫苗的鸭血清抗体中,检出阳性率为20.57%(36/175),表明此法可用于临床采集的血清样本中的抗体检测。最后,因本实验室尚缺乏其他血清型RA阳性血清,虽扩增出血清2型RA的porin基因与么乃全[11]研究的8种血清型RA同源性均高达100%,但并不足以表明所建立的Porin-ELISA可用于所有血清型RA抗体检测的相关研究,关于其是否可用于RA所有血清型抗体的检测,有待进一步试验证实。
本试验成功建立了一种可用于RA的抗体检测ELISA方法Porin-ELISA;
该方法具有良好的特异性、敏感性及重复性;
Porin-ELISA可用于免疫抗体及感染抗体的检测,该方法的建立为RA病的免疫抗体评估及快速诊断提供了新的检测方法。





