【www.zhangdahai.com--其他范文】
王春美,任艳娇,盛光耀 (郑州大学第一附属医院儿童医院,河南 郑州 450052)
急性髓系白血病(acute myeloid leukemia, AML)是儿童常见的一种血液系统恶性肿瘤,因其较高的复发率及治疗相关的死亡率,5 a无病存活率仅为40~50%左右[1-3],伴有FMS样酪氨酸激酶3-内部串联重复(FMS-like tyrosine kinase 3-internal tandem duplication, FLT3-ITD)突变的患者预后更差[4-6]。虽然FLT3抑制剂索拉菲尼、舒尼替尼、吉瑞替尼已经广泛应用于临床,但因为药物的安全性及耐药性问题,部分患者不能使用上述药物治疗。同时对于肿瘤的治疗,单个药物的作用是有限的,临床上多采取多种药物联合化疗方案。我们前期研究证实,AML细胞株THP-1细胞中存在FLT3/p65/核辅抑制子维甲酸/甲状腺受体沉默因子(silencing medtiator for retinoic acid and thyroid hormone receptor, SMRT)信号通路的异常活化,p65小干扰RNA(small interfering RNA,siRNA)、FLT3 siRNA均可有效抑制THP-1细胞的增殖,并诱导细胞凋亡[7-8]。本研究拟在前期研究的基础上,进一步探讨联合阻断FLT3、p65对THP-1细胞的影响。
1.1 细胞株THP-1细胞株购自上海中科院细胞库,使用含体积分数10%胎牛血清、100 u/mL青霉素、100 mg/L链霉素、0.05 mol/L 2-巯基乙醇的RPMI-1640培养基,置于37 ℃、体积分数5% CO2培养箱中培养。
1.2 主要试剂FLT3 siRNA、p65 siRNA、control siRNA、鼠抗人FLT3单克隆抗体、鼠抗人核因子κB (nuclear factor κappa B, NF-κB)p65单克隆抗体和山羊抗人SMRT多克隆抗体均购自美国Santa Cruz公司,山羊抗鼠IgG-辣根过氧化物酶(horseradish peroxidase, HRP)、兔抗山羊IgG-HRP和3,3’-二氨基联苯胺(3,3’-Diaminobenzidine, DAB)显色试剂盒购自北京中杉金桥生物技术有限公司,细胞总RNA提取试剂盒购自北京天根生化科技有限公司,细胞计数试剂-8(cell counting kit-8, CCK-8)试剂盒和Annexin V-FITC凋亡检测试剂盒购自碧云天生物技术研究所。
1.3 细胞增殖的检测收集处于指数期生长的THP-1细胞,制成细胞悬液,在96孔板中接种细胞悬液(100 μL/孔),100 μL含有4 000个细胞。设对照组(未转染组)、NC-siRNA组(control siRNA转染组)、FLT3 siRNA组、P65 siRNA组及FLT3 siRNA+p65 siRNA转染组(联合组),每组设3复孔,分别于0、24、48、72、96、120、144、168 h取1块培养板,每孔加10 μL CCK-8溶液,培养箱内孵育4 h,上酶标仪检测450 nm波长处的吸光值(A450)。以时间为横坐标、细胞密度为纵坐标,绘制细胞增殖曲线。
1.4 细胞凋亡的检测本研究采用Annexin V-FITC细胞凋亡检测试剂盒检测细胞凋亡。具体步骤如下:按照siRNA转染试剂盒的说明书的要求转染细胞,调整细胞密度为5×105个/mL,接种于6孔培养板中,分别将含有FLT3 siRNA、p65 siRNA、FLT3 siRNA+p65 siRNA和siRNA转染试剂的混合液与细胞共孵育6 h,后更换正常血清和抗生素2倍的培养基,孵育18 h后更换为正常培养基,继续培养48 h收获细胞。1 000 r/min离心5 min,弃上清液,用1 mL预冷的磷酸缓冲盐溶液(phosphate buffer saline, PBS)重悬细胞,调细胞密度为2~5×105个/mL,取195 μL 细胞悬液至一个干净无菌的试管中,并加入5 μL Annexin V-FITC,暗室中孵育10 min;
室温1 000 r/min离心5 min,弃去上清液,重悬细胞于190 μL的结合液中;
加入5 μL的PI染色液,混匀后上流式细胞仪检测。Annexin-V染色阳性、PI染色阴性的细胞早期凋亡细胞。
1.5 细胞周期的检测离心收集FLT3 siRNA、p65 siRNA、FLT3 siRNA+p65 siRNA处理48 h的细胞,PBS洗涤后离心,弃上清,加入预冷的体积分数70%乙醇1 mL,4 ℃过夜孵育。次日再次离心、弃上清、重悬细胞,依次加入RNaseA(终浓度50 mg/L)、PI(100 mg/L),室温避光孵育30 min;
上流式细胞仪检测各周期的细胞。
1.6 实时荧光定量PCR(real-time polymerase chain reaction, RT-PCR)检测FLT3、p65和SMRT mRNA的表达根据基因库中靶基因序列设计相应引物,β-actin基因作为内部参照。细胞总RNA提取试剂盒提取收获的细胞总RNA,按照实验操作说明反转成cDNA第一链,然后取l μL cDNA、0.5 μL的FLT3、p65、SMRT及β-actin上下游引物进行PCR扩增30个循环,体积分数2%的琼脂糖凝胶电泳分析各PCR产物。各目的基因mRNA相对含量(M)=目地基因吸收峰面积/β-actin吸收峰面积。见表1。

表1 RT-PCR引物序列
1.7 Western blotting检测p65和SMRT蛋白的表达离心收集FLT3 siRNA、p65 siRNA、FLT3 siRNA+p65 siRNA处理48 h的THP-1细胞,提取细胞总蛋白,-80 ℃冰箱冻存。Bradford法测定蛋白浓度。蛋白样本经体积分数10%的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分离,然后转至聚偏氟乙烯膜上,使用含体积分数5%脱脂奶粉的TBST溶液于4 ℃环境中封闭过夜。一抗(鼠抗人NF-κB p65单克隆抗体,山羊抗人SMRT多克隆抗体,1:200稀释)室温孵育2 h,依次使用TBST溶液、TBS溶液洗涤,对应的二抗(1∶3 000稀释)室温孵育2 h,依次使用TBST溶液、TBS溶液洗涤,ECL发光液处理后暗室内曝光,胶片扫描后使用Image-Pro Plus 5.0软件分析灰度值结果。
1.8 流式细胞术(flow cytometry, FCM)检测FLT3蛋白的表达离心收集FLT3 siRNA、p65 siRNA、FLT3 siRNA+p65 siRNA处理48 h的THP-1细胞,分组同前,分别加入10 μL的FLT3抗体,室温避光反应30 min;
PBS洗涤后重悬细胞;
每管加入10 μL山羊抗鼠IgG1-FITC二抗10 μL,混匀后避光反应30 min;
PBS洗涤后重悬细胞,上流式细胞仪检测FLT3蛋白的表达。
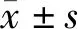
2.1 THP-1细胞增殖曲线的比较FLT3 siRNA、p65 siRNA及联合组的细胞增殖明显受抑制,增殖曲线低平,缺乏指数增殖的特征,以联合组的细胞增殖曲线最为显著;
第6天后,当细胞密度≥1×106个/mL,对照组的死亡细胞数量增加,A450明显下降。见图1。

图1 各组THP-1细胞增殖曲线比较
2.2 各组细胞凋亡的比较FLT3 siRNA、p65 siRNA及联合组处理THP-1细胞后,细胞的早期凋亡率分别为(11.05±3.87)%、(14.2±4.57)%和(21.29±4.74)%,较对照组[(1.36±1.03)%]及NC-siRNA组[(1.56±0.94)%]均显著增加(F=22.311,P<0.001),以联合组最为明显。
2.3 各组细胞周期的比较FLT3 siRNA、p65 siRNA及联合组处理THP-1细胞后,G0/G1期的细胞比例显著增加(F=32.705,P<0.001),S期的细胞比例显著减少(F=42.611,P<0.001),但G2/M期的细胞比例无明显变化(F=0.967,P=0.467),以联合组的作用最为明显,提示细胞出现G0/G1期至S期的阻滞。见表2。
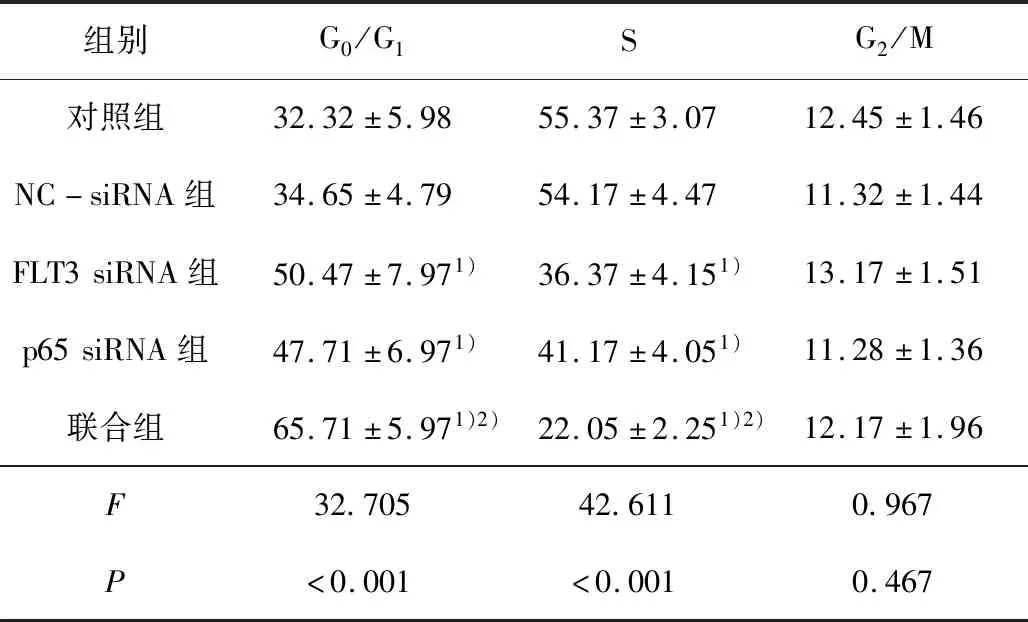
表2 各组THP-1细胞周期比较 %
2.4 各组FLT3、p65和SMRT mRNA的表达FLT3 siRNA、p65 siRNA及联合组中FLT3 mRNA的表达明显降低(F=22.311,P<0.001),以联合作用最为明显;
p65 siRNA及联合组中p65 mRNA的表达明显降低(F=88.911,P<0.001);
p65 siRNA及联合组中SMRT mRNA的表达均明显增高(F=7.736,P=0.005)。见表3。
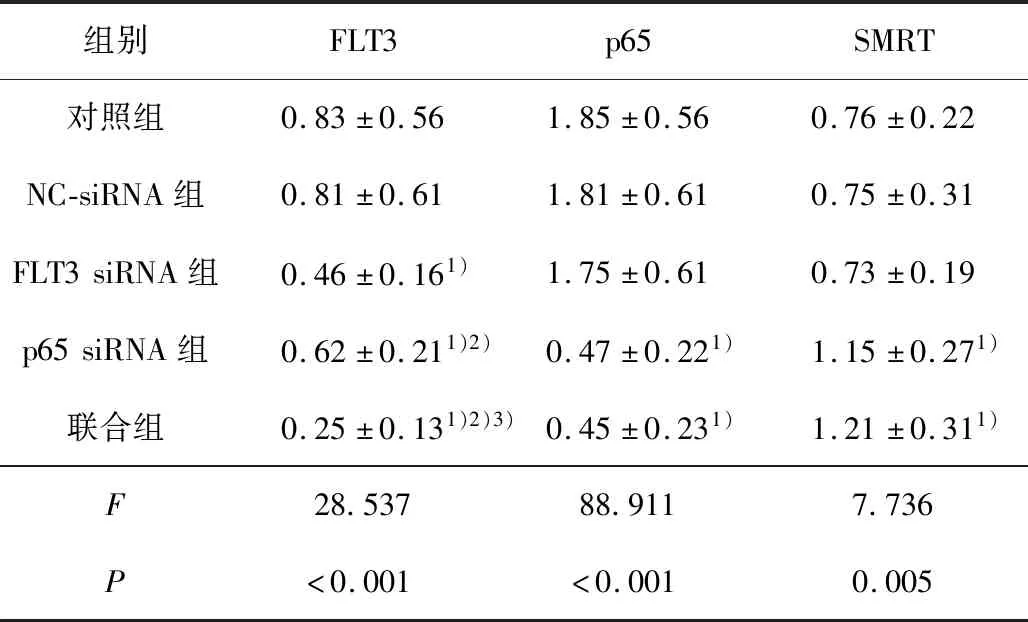
表3 各组THP-1细胞中FLT3、p65和SMRT mRNA表达比较
2.5 各组FLT3、p65和SMRT蛋白的表达FLT3 siRNA、p65 siRNA及联合组中FLT3蛋白的表达明显降低(F=128.78,P<0.001),以联合作用最为明显;
p65 siRNA及联合组中p65蛋白的表达明显下降(F=27.591,P<0.001);
p65 siRNA及联合组中SMRT蛋白的表达均明显增高(F=6.123,P=0.009)。见表4。
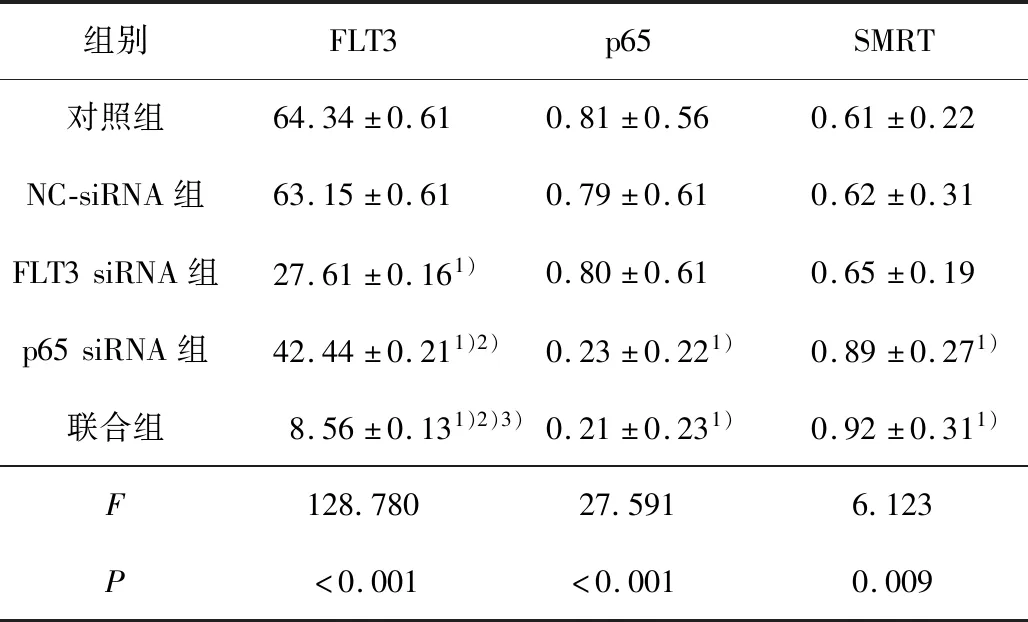
表4 各组THP-1细胞中FLT3、p65和SMRT蛋白表达比较
AML的发生是涉及多基因参与、多步骤累及、多因素影响的复杂的过程[9]。近年来,随着分子生物学技术的发展及基因检测的开展,对AML分子机制的研究越来越深入,小分子靶向治疗也纳入了儿童AML的常规化疗过程中[10]。目前已发现了200多种与AML发病有关的基因重排及基因突变,部分已明确与AML的不良预后有关[5,11]。目前针对不良预后基因的分子靶向治疗是肿瘤研究的热点,但是任何一种药物的作用是有限的,多靶点联合用药阻断肿瘤的发生发展才有可能是根治肿瘤的有效手段[12]
目前临床上已研发出FLT3特异性抑制剂,包括第1代的索拉菲尼、舒尼替尼等,第2代的吉瑞替尼、奎扎替尼等,但是只作为常规治疗的联合用药,提示FLT3抑制剂的抗肿瘤作用是有限的[13-15]。我们前期研究发现,FLT3和p65均可作为THP-1细胞FLT3/p65/SMRT信号通路中的分子靶标,分别抑制FLT3、p65表达均可有效抑制THP-1细胞增殖、阻滞细胞周期,诱导细胞凋亡,并可影响下游相关信号分子的表达。本研究在前期研究的基础上,进一步探讨了联合抑制FLT3和p65表达对THP-1细胞的影响。结果发现,FLT3 siRNA、p65 siRNA及两者联合作用均可有效抑制THP-1细胞的增殖并诱导其凋亡,并导致细胞发生G0/G1期到S期的阻滞,联合组的作用效果最为显著,但并不是FLT3 siRNA、p65 siRNA单独作用的简单叠加,提示FLT3 siRNA、p65 siRNA可能通过某种未知机制存在的协同作用。
通过对FLT3/p65/SMRT信号通路中相关分子的研究还发现,FLT3 siRNA、p65 siRNA及联合组中FLT3 mRNA和蛋白表达水平均显著下降,以联合组的结果最为明显;
p65 siRNA及联合组中p65mRNA和蛋白表达明显减少,但两者间无显著差异;
p65 siRNA及联合组中SMRT mRNA和蛋白的表达均明显增高,2组间的表达无明显差异;
FLT3 siRNA组p65和SMRT mRNA和蛋白的表达无明显变化,提示虽然联合抑制FLT3和p65表达的作用更强,但FLT3/p65/SMRT信号转导途径并不是FLT3 siRNA、p65 siRNA影响THP-1细胞的唯一途径,具体机制仍需要进一步深入研究。
综上所述,本研究在细胞水平证实了联合抑制FLT3和p65表达治疗AML的有效性,因此同时以FLT3和p65为分子靶点的靶向治疗可作为AML治疗策略的研究方向之一。
猜你喜欢 孵育试剂盒抗体 免疫性因素对常见血型意外抗体产生的影响探讨中国临床新医学(2022年8期)2022-09-08病原菌多重核酸检测试剂盒分析性能质量评价研究传染病信息(2022年3期)2022-07-15玻璃珠-涡旋振荡改良法用于硅藻DNA 提取法医学杂志(2022年1期)2022-06-21全血标本孵育时间及温度对糖化血红蛋白检测结果的影响中国药学药品知识仓库(2021年11期)2021-11-25输血前不规则抗体筛查的临床意义探讨健康之家(2021年2期)2021-07-01为什么确诊新冠肺炎需要核酸检测试剂盒?保健与生活(2020年6期)2020-03-20用课程“孵育”会“发光”的教室中小学德育(2020年11期)2020-03-18全国唯一人源化抗体小鼠 进入药物开发应用阶段祝您健康(2018年12期)2018-11-2718F—FDG配套试剂盒的开发中国卫生产业(2018年12期)2018-05-14一种用于抗体快速分离的嗜硫纳米粒子的制备及表征分析化学(2018年12期)2018-01-22本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0430/591783.html




