【www.zhangdahai.com--其他范文】
张有辰, 李慧文, 金福**
(1.中国人民解放军总医院海南医院 儿科, 海南 三亚 572022;
2.延边大学附属医院 新生儿科, 吉林 延吉 133000)
近年来,氧疗在围生期围生儿脑损伤以及早产儿抢救治疗中发挥重要作用,能够显著提高早产儿以及新生儿的存活率。但是,由于新生儿器官发育不完善,长时间的高氧暴露会造成其他器官和神经系统的损伤,如肺损伤、脑损伤等[1-2]。研究表明,长时间的高氧气暴露能够促进钠尿肽受体(natriuretic peptide,NRP)-环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)信号系统活化诱导大鼠脑损伤[3];
另外,高氧亦可以通过促进内质网氧化应激(endoplasmic reticulum stress,ERS)相关氨基末端蛋白激酶(c-jun N-terminal protein kainse,JNK)蛋白和磷酸化氨基末端蛋白激酶(p-jun N-terminal protein kainse,p-JNK)蛋白诱导新生大鼠脑损伤[4]。王叶等[5]研究发现前列腺素E1能够通过抑制JNK和p-JNK蛋白表达,从而发挥高氧诱导的新生大鼠脑损伤保护作用。因此,通过抑制ERS相关JNK、p-JNK蛋白可能是防治新生儿以及早产儿氧疗的重要途径。最新研究表明,人参皂苷Rg1(ginsenoside Rg1,GRg1)能够减少新生大鼠缺血性脑损伤(hypoxic ischemic brain damage,HIBD)海马神经元凋亡,有效地改善HIBD新生大鼠学习能力和记忆能力[6];
另外,GRg1对神经细胞缺血再灌注损伤大鼠的保护作用与抑制海马神经元凋亡、调节JNK及p-JNK蛋白表达有关[7]。多项研究表明GRg1能够改善多种诱因引起的大鼠脑损伤,但是有关GRg1对高氧诱导的新生大鼠脑损伤的影响及其作用机制尚不清楚。因此,本研究拟通过构建高氧诱导新生大鼠脑损伤模型,腹腔注射GRg1探究其对新生大鼠脑损伤的影响及其对JNK、p-JNK蛋白表达作用。
1.1 实验材料
1.1.1动物来源 新生Wistar大鼠,50只,体质量8~10 g,雌雄不限,动物由延边大学医学院实验动物学部提供[SCXK(吉)2017-001],本研究获得动物实验医学伦理委员会批准(LLSC20200716)。
1.1.2主要药物与试剂 人参皂苷Rg1(上海顺勃,纯度≥98%),苏木素-伊红(hematoxylin and eosin staining,HE)染色液及末端脱氧核糖转移介导的生物素化脱氧尿嘧啶缺刻标记(terminal deoxy nucleo tidyl transferase mediated dUTP-biotin nick-end labeling,TUNEL)细胞凋亡检测试剂盒(碧云天生物),JNK及p-JNK兔单克隆抗体(美国Cell Signaling Technology),兔免疫组化试剂盒(北京中杉金桥),一抗和二抗稀释液、β-actin小鼠单克隆抗体、山羊抗小鼠、山羊抗兔及极超敏发光试剂盒(江苏碧云天)。
1.1.3主要仪器 G22-W型高速离心机(湖南湘仪),SuPerMax 3000FA型多功能酶标仪(美国Thermo),M371450型组织涡旋仪(武汉维塞尔),TC-XDS-500C型荧光倒置显微镜(日本Olympus),Western blotting检测装置和GoodLook-1000型成像系统(美国Bio-Rad)。
1.2 实验方法
1.2.1动物造模与分组 采用高氧诱导法制备大鼠脑损伤模型[8]。50只新生Wistar大鼠随机均分为对照组、高氧组及10 mg/kg (低剂量)GRg1组、20 mg/kg (中剂量)GRg1组、40 mg/kg (高剂量)GRg1组,对照组大鼠常规饲养,其余各组大鼠置于高压氧仓内、常规压力,吸入氧气浓度100%、氧气流量为2 L/min,采用数字测氧仪监测舱内氧气浓度,使氧气浓度维持在(85±2)%,舱内温度为25 ℃,相对湿度为60%~65%,将生石粉末放置舱内,吸收多余的CO2和水蒸气;
GRg1各剂量组大鼠,自造模第1天开始,予10、20及40 mg/kg GRg1腹腔注射,1次/d,连续7 d;
对照组和高氧组大鼠给予等量的生理盐水注射。
1.2.2标本采集 造模结束时,乙醚蒸汽麻醉,固定,剪下头部,剥开颅骨,完全暴露脑组织并将其整体取出;
取左脑1/2行脑组织检测含水量,取右脑行HE染色、TUNEL染色及免疫组织化学检测。
1.2.3脑组织含水量 取“1.2.2”项下各组大鼠脑组织、冲洗、称量,记录为脑组织湿重质量;
置于80 ℃烤箱内,烘烤,直至水分蒸干,质量恒定、称量,记录为脑组织干重质量;
计算脑组织含水量[脑组织含水量(%)=(湿重质量-干重质量)/湿重质量×100]。
1.2.4HE染色 取“1.2.2”项下各组大鼠脑组织,4%多聚甲醛固定,脱水、透明、包埋、石蜡切片,并按照HE染色试剂盒进行脑组织染色,显微镜下观察各组大鼠脑组织形态学变化。
1.2.5TUNEL染色 取“1.2.2”项下各组大鼠脑组织,按照TUNEL法测定脑细胞凋亡,细胞核呈棕色的细胞为凋亡细胞。石蜡切片置于60 ℃烤箱内脱蜡,二甲苯浸洗2次、5 min/次;
梯度乙醇溶液(100%、95%、80%及70%)各清洗1次,3 min/次;
采用Proteinase K工作液处理脑组织切片20 min,室温下加细胞通透液孵育10 min;
磷酸盐缓冲液(phosphate buffered saline,PBS)清洗切片,滴加TUNEL反应混合液,反应30 min;
切片风干后,加 Converter-POD 50 μL,加上盖玻片,37 ℃孵育30 min;
PBS清洗切片后,加二氨基联苯胺(diaminobenzidine,DAB)显色液,孵育10 min,光学显微镜下拍照、观察TUNEL阳性细胞数目并计算细胞凋亡率。
1.2.6免疫组织化学检测大鼠脑组织JNK、p-JNK蛋白表达 取“1.2.2”项下各组大鼠脑组织、脱水、透明、包埋、组织切片为3~5 μm,3%H2O2溶液孵育10 min、85 ℃抗原修复,加10%BSA溶液封闭20 min;
加JNK和p-JNK兔单克隆抗体(工作液体积稀释比例为1 ∶200),4 ℃孵育过夜;
加对应山羊抗兔二抗,室温孵育30 min;
滴加DAB显色液,于400倍视野下随机选取6个视野进行拍照,利用Image Pro Plus软件进行图像分析,检测光密度(optical density,OD)值并计算蛋白阳性表达率。
1.3 统计学分析

2.1 组织学特征
HE染色显示(图1),对照组大鼠脑组织未见明显的病理改变,神经细胞数目较多,形态以及结构完整;
高氧组和低剂量GRg1组大鼠脑组织可见大量的坏死细胞,细胞质出现严重的水肿以及空泡,神经细胞形态及结构不规则;
中剂量GRg1组和高剂量GRg1组大鼠脑组织病理损伤减轻,神经细胞空泡变性减少,形态结构较为完整。

注:红色箭头表示水肿和空泡变性神经元。图1 各组大鼠脑组织的组织学特征(HE,×400)Fig.1 Histological characteristics of rat brain tissues in each group (HE,×400)
2.2 脑组织含水量和细胞凋亡
与对照组相比,高氧组大鼠脑组织含水量明显增加(P<0.01);
与高氧组相比,低、中及高剂量GRg1组大鼠脑组织含水量降低(P<0.05或P<0.01)。与对照组相比,高氧组大鼠脑组织细胞凋亡指数明显升高(P<0.01);
与高氧组相比,中和高剂量GRg1组大鼠脑组织细胞凋亡指数明显降低(P<0.01),但低剂量GRg1组大鼠的差异无统计学意义(P>0.05)。见表1和图2。

表1 各组大鼠脑组织含水量和凋亡指数Tab.1 Water content and apoptosis index of rat brain tissues in each

注:红色箭头表示海马神经元凋亡。图2 各组大鼠脑组织的细胞凋亡情况(TUNEL,×400)Fig.2 Cellular apoptosis in rat brain tissues in each group (TUNEL,×400)
2.3 脑组织JNK和p-JNK蛋白的表达
与对照组相比,高氧组大鼠脑组织中海马神经元细胞JNK和p-JNK蛋白阳性表达率升高,差异有统计学意义(P<0.01);
与高氧组相比,低、中及高剂量GRg1组大鼠脑组织海马神经元细胞胞浆JNK和p-JNK蛋白阳性表达率均降低,差异有统计学意义(P<0.05或P<0.01)。见图3和表2。
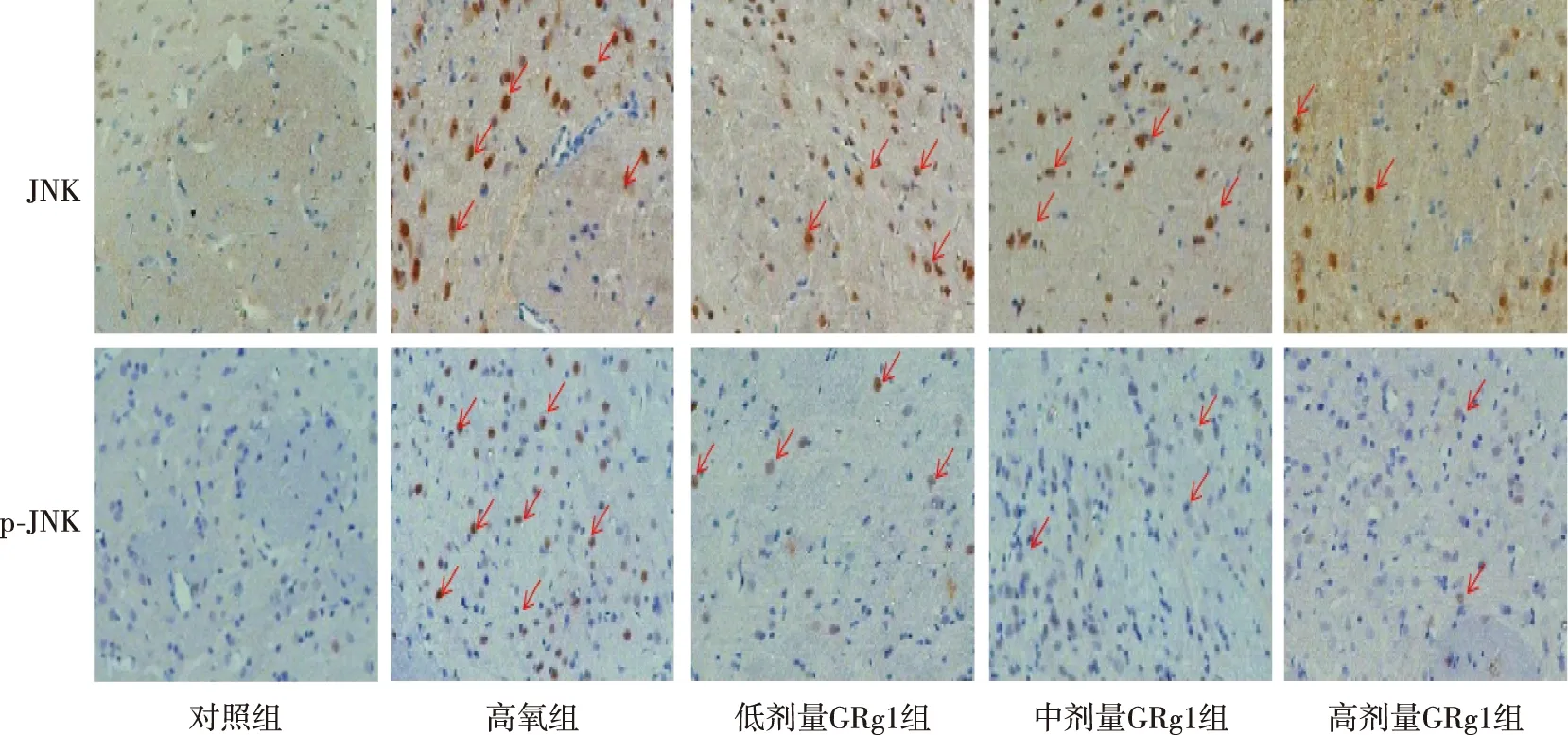
注:红色箭头表示海马神经细胞蛋白质着色。图3 各组大鼠脑组织JNK和p-JNK蛋白的表达(免疫组织化学,×400)Fig.3 Expressions of JNK and p-JNK proteins in rat brain tissues in each group (immunohistochemistry, ×400)

表2 各组大鼠脑组织JNK和p-JNK蛋白的阳性表达Tab.2 The positive expression rates of JNK and p-JNK proteins in rat brain tissues in each
氧疗是救治新生儿,尤其是早产儿的重要方式[9]。既往研究表明,早产儿高氧可能是导致脑性瘫痪和运动神经功能障碍的原因之一[10]。另外,新生后1周龄的大鼠相当于早产出生的新生儿[11-12]。本研究首先通过高氧诱导新生大鼠脑损伤模型模拟新生儿高氧暴露下诱发的脑损伤,研究结果显示高氧组新生大鼠病理切片脑组织可见大量的坏死细胞,细胞质出现严重的水肿和空泡,神经元细胞形态及结构不规则,与以往研究结果一致[11,13],表明高氧诱导新生大鼠脑损伤模型造模成功。
GRg1是人参皂苷中含量最高的成分之一,已研究表明GRg1对老年大鼠记忆能力有明显的促进作用,能够促进学习记忆的获取[14];
GRg1能够促进幼鼠的身体发和脑神经发育,改善学习和记忆功能障碍的动物[15];
以上研究表明GRg1在脑神经发育中发挥重作用。但是目前有关GRg1对高氧诱导新生大鼠脑损伤的影响尚不清楚。本研究结果显示中、高剂量GRg1组大鼠脑组织病理损伤减轻,神经元细胞空泡变性减少,形态结构较为完整;
与高氧组相比,低剂量、中及高剂量GRg1组大鼠脑组织含水量降低,表明GRg1能够发挥高氧诱导新生大鼠脑损伤保护作用。王巧云等[7]发现GRg1对神经细胞缺血再灌注损伤大鼠的保护作用与抑制海马神经元凋亡,调节JNK、p-JNK蛋白表达有关;
黄天文等[16]研究表明GRg1可通过JNK通路减轻寡聚肽Aβ1-42诱导的神经元凋亡;
这些研究均表明GRg1可能通过JNK通络抑制细胞凋亡,从而改善高氧诱导的新生大鼠脑损伤。
细胞凋亡是高氧诱导脑损伤的重要原因之一,ERS是启动细胞凋亡的重要途径[17]。研究发现,ERS诱导的细胞凋亡与众多心脑血管疾病密切相关[18];
ERS可通过磷酸化细胞外调节蛋白激酶(phosphorylated extracellular regulated protein kinase,p-ERK)、激活转录因子 6(activating transcription factor 6,ATF6)等信号活化,诱导并激活若C/EBP-同源蛋白(C/EBP-homologous protein,CHOP)、JNK及Caspase,从而引起细胞凋亡[19]。JNK是哺乳动物细胞促分类原活化蛋白酶家族成员之一,又称为应激活化蛋白激酶,可参与Capase和线粒体途径诱导的细胞凋亡[20]。另外,高氧能够通过上调JNK、p-JNK蛋白表达,促进脑组织细胞凋亡,诱导新生大鼠脑损伤,体外细胞研究发现抑制JNK信号通路活化能够有效降低高氧诱导的神经元凋亡[21]。以上研究表明,JNK信号在高氧诱导新生大鼠脑损伤中扮演重要作用。因此,本研究TUNEL染色结果显示,与高氧组相比,低剂量GRg1组大鼠脑组织细胞凋亡指数无差异,中、高剂量GRg1组大鼠脑组织细胞凋亡指数降低;
免疫组织化学检测结果显示,与高氧组相比,低、中及高剂量GRg1组大鼠脑组织JNK、p-JNK蛋白阳性表达率均降低。这些研究结果与GRg1下调p-JNK、抑制细胞凋亡,从而减轻低氧复氧诱导大鼠神经元损伤一致。
综上所述,本研究结果显示当GRg1剂量>20 mg/kg时可抑制JNK信号活化,降低神经元凋亡,并最终减轻高氧诱导的新生大鼠脑损伤。
猜你喜欢 脑损伤脑组织神经元 Quintero分期、CHOP分级与TTTS脑损伤的相关性对比分析中国临床医学影像杂志(2022年5期)2022-07-26电针对慢性社交挫败抑郁模型小鼠行为学及脑组织p11、5-HTR4表达的影响中国中医药信息杂志(2022年6期)2022-06-27右美托咪定抑制大鼠创伤性脑损伤后神经细胞凋亡昆明医科大学学报(2021年2期)2021-03-29AI讲座:神经网络的空间对应电子产品世界(2021年8期)2021-01-16仿生芯片可再现生物神经元行为中国计算机报(2019年49期)2019-02-07这个神经元负责改变我们的习惯中国新闻周刊(2017年36期)2017-10-21研究人员精确定位控制饮酒的神经元创新时代(2016年8期)2016-10-21山楂叶总黄酮对大鼠缺血脑组织p38蛋白表达的影响药学研究(2015年11期)2015-12-19山楂叶总黄酮对2型糖尿病大鼠脑组织的保护作用医学研究杂志(2015年12期)2015-06-10血浆渗透压和APACHEⅡ评分对心肺复苏后患者脑损伤的评估医学研究杂志(2015年12期)2015-06-10本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0611/609822.html




