【www.zhangdahai.com--其他范文】
侯夏沛,刘 芬(西北妇女儿童医院口腔科,西安 710061;
通讯作者,E-mail:fenfen2alei@163.com)
随着干细胞技术、分子生物学和组织工程的快速发展,牙周组织再生技术已经成为牙周疾病治疗中的热点技术[1]。人牙周膜干细胞(human periodontal ligament stem cells, hPDLSCs)是再生工程技术的种子细胞之一[2]。其他研究者报道,将hPDLSCs移植到免疫低下的啮齿动物体内时,hPDLSCs会逐渐形成牙本质的骨样和牙周结构[3]。因此,hPDLSCs的成骨分化可能有助于牙周再生和修复。然而,当hPDLSCs应用于牙周组织再生时,其数量和功能有限[4]。因此,寻找促进hPDLSCs增殖和成骨分化的药物是牙周再生和修复成功与否的关键。紫草素(shikonin,SHI)是一种从紫草中提取的活性成分,分子式为C16H16O5,其抗炎特性已被广泛报道[5-7]。据报道,紫草素通过下调白细胞介素-1(interleukin-1, IL-1)、IL-6和肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的表达来防止中波紫外线诱导的角质形成细胞炎症[8]。紫草素可降低骨髓来源的树突细胞中的IL-4、IL-5和TNF-α的表达[9]。紫草素可下调骨关节炎小鼠的关节中IL-1和TNF-α的表达[10]。炎性细胞因子在牙周炎中的重要性已被广泛证实。在牙周炎的发展过程中,IL-1、IL-6和TNF-α的过度表达可破坏牙周支持组织[11]。有研究报道,紫草素可抑制脂多糖诱导的人牙周膜细胞中IL-1、IL-6和TNF-α的过度表达[12],提示紫草素可能具有抗牙周炎的作用。基于上述研究背景,本课题组推测紫草素可能是一种牙周组织再生的辅助药物。因此,本研究考察了紫草素对人hPDLSCs增殖和分化的影响,从而为牙周组织重建提供候选药物。
1.1 材料
紫草素(HPLC≥98%)购自北京索莱宝科技有限公司。二甲基亚砜(DMSO)、胎牛血清(FBS)、胰蛋白酶、茜素红染色液均购自美国Sigma-Aldrich公司。STRO-1、CD-146、CD34、CD45、Runt相关转录因子2(RUNX2)、骨钙素(OCN)、Smad4和β-actin一抗、山羊抗兔IgG H&L(HRP)二抗、FITC标记的荧光二抗均购自英国Abcam公司。MTT试剂盒购自北京索莱宝科技有限公司。α-MEM培养基购自美国HyClone公司。碱性磷酸酶染色试剂盒、碱性磷酸酶活性测定试剂盒均购自南京建成生物工程研究所。RIPA细胞裂解液购自碧云天生物技术研究所。TRIzol总RNA提取缓冲液、Revertaid First Strand cDNA合成试剂盒、增强化学发光(ECL)底物试剂盒均购自美国ThermoFisher公司。TB Green PreMix Ex Taq II(Tli RNAseH Plus)购自日本TaKaRa公司。
1.2 方法
1.2.1 hPDLSCs的培养和鉴定 牙周膜组织临床标本(n=10)采集于西北妇女儿童医院口腔科收治的接受正畸治疗的10名12~27岁健康人,均无牙周病。本研究已获得西北妇女儿童医院伦理委员会的批准(批准号:No.2020-5-09-1007),所有研究对象均签署了知情同意书。收集10个因正畸治疗拔除的健康第三磨牙或第一前磨牙,用0.01 mol/L的PBS冲洗牙齿,用刀片刮取根中1/3区域的牙周膜组织,将牙周膜组织剪成1 mm3左右的组织块,然后贴在培养皿底部,并与30 ml α-MEM(其中含有10%胎牛血清和1%青霉素/链霉素)在37 ℃、5% CO2一起孵育。培养基每3 d更换1次。在细胞达到90%汇合后,用PBS冲洗细胞并用胰蛋白酶消化2 h。然后,将细胞以1 000 r/min离心5 min。弃去上清液后,将细胞重悬。培养基每3 d更新1次。细胞达到90%汇合后按1 ∶3的比例传代。OLYMPUS TH4-200倒置显微镜下观察hPDLSCs的形态,然后通过流式细胞仪鉴定hPDLSCs,方法如下:取第3代hPDLSCs胰蛋白酶消化,将细胞以1 200 r/min离心5 min,除去上清液。将细胞在PBS中稀释至1×106个/ml。将100 μl细胞悬液分别与STRO-1(1 ∶500稀释)、CD-146(1 ∶500稀释)、CD34(1 ∶500稀释)和CD45(1 ∶500稀释)特异性一抗在4 ℃下孵育1 h,然后与FITC标记的荧光二抗(1 ∶500稀释)室温孵育1 h。使用Beckman Coulter FC500流式细胞仪分析STRO-1、CD-146、CD34和CD45的阳性细胞百分比。
1.2.2 hPDLSCs的增殖测定 通过MTT试剂盒检测hPDLSCs的活性。将紫草素用0.1%二甲基亚砜(DMSO)溶解。然后将hPDLSCs在96孔板(5×103个细胞/孔)中与不同浓度的紫草素(0,0.1,1,10,100 μmol/L)在37 ℃、5%CO2条件下孵育24 h后,再与100 μl的MTT孵育4 h,弃去上清液,每孔加入100 μl的DMSO。用酶标仪测定572 nm处的吸光度。
1.2.3 hPDLSCs的分组处理和成骨分化诱导 hPDLSCs以5×103个细胞/孔的密度在96孔板中培养至80%汇合。然后,按照不同紫草素浓度将细胞分为5组,即0 μmol/L组、0.1 μmol/L组、1 μmol/L组、10 μmol/L组、100 μmol/L组。成骨诱导液为含有100 ml/L FBS、10 mmol/L β-甘油磷酸钠、50 mg/L抗坏血酸和10 nmol/L地塞米松的α-MEM培养液,各组细胞分别用含有指定浓度的紫草素的成骨诱导液在37 ℃、5% CO2条件下培养21 d,每2 d更换培养基。
1.2.4 hPDLSCs的碱性磷酸酶(ALP)染色和活性测定 在hPDLSCs用成骨分化诱导培养基和紫草素联合培养21 d后,将0.2% Triton-X100添加到hPDLSCs中,然后以10 000 r/min离心10 min。使用碱性磷酸酶染色试剂盒对hPDLSCs进行染色。使用4%多聚甲醛固定细胞30 min后,用PBS洗涤hPDLSCs 3次。配制5 ml的染色工作液(2.5 ml 0.2 mol/L的Tris-HCl、3 mg FBBsalt、0.5 mg AS-MX、0.025 ml DMF,ddH2O定容至终体积为5 ml)。在黑暗中将工作液添加到hPDLSCs中避光孵育20 min。显微镜下观察ALP染色。实验重复6次。使用碱性磷酸酶活性测定试剂盒检测hPDLSCs中ALP活性。hPDLSCs用成骨分化诱导培养基和紫草素联合培养21 d后,除去培养液,PBS清洗3次,用RIPA细胞裂解液裂解hPDLSCs。10 000 r/min离心15 min后,吸取上清液并加入50 μl发色底物孵育10 min,再加入100 μl反应停止液停止反应。用酶标仪检测520 nm波长处的OD值。
1.2.5 茜素红染色观察钙化结节 在hPDLSCs用成骨分化诱导培养基和紫草素联合培养21 d后,4%多聚甲醛固定20 min,PBS洗3次。hPDLSCs用1 g/L茜素红染色液在室温下染色10 min,然后PBS冲洗3次。在倒置显微镜下观察钙化结节。使用1 ml 1%氯化十六烷基吡啶溶解钙化结节,酶标仪检测590 nm波长处的OD值。
1.2.6 qRT-PCR检测成骨相关基因RUNX2、OCN和Smad4的转录水平 在hPDLSCs用成骨分化诱导培养基和紫草素联合培养21 d后,通过qRT-PCR测定hPDLSCs成骨分化过程中RUNX2、OCN和Smad4的mRNA表达。hPDLSCs的总RNA通过TRIzol总RNA提取缓冲液提取,裂解液用氯仿分离,并在4 ℃下12 000g离心15 min。然后,使用异丙醇沉淀裂解物,在4 ℃下12 000g离心10 min。DEPC洗涤裂解液沉淀后,重悬于75%乙醇中,4 ℃下12 000 r/min离心10 min,最后溶解于20 μl DEPC中。用Revertaid First Strand cDNA合成试剂盒合成cDNA。用TB Green PreMix Ex Taq II(Tli RNAseH Plus)在ABI 7500实时荧光定量PCR仪上进行qRT-PCR。反应条件:95 ℃ 2 min;
95 ℃ 15 s,60 ℃ 15 s,72 ℃ 30 s,40个循环。β-actin作为内参基因,用2-ΔΔCt法计算基因相对表达水平。引物序列见表1。实验重复6次。

表1 引物序列Table 1 Primer sequence
1.2.7 Western blot检测成骨相关蛋白RUNX2、OCN和Smad4的表达水平 在hPDLSCs用成骨分化诱导培养基和紫草素联合培养21 d后,通过Western blot测定RUNX2、OCN和Smad4的蛋白表达。使用含有1%苯甲基磺酰氟和1%磷酸酶抑制剂的RIPA裂解缓冲液裂解hPDLSCs,10 000 r/min离心10 min后,用BCA蛋白测定试剂盒测定蛋白质浓度。然后将40 μg蛋白质通过12%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)在100 V下电泳90 min分离。然后,将蛋白质转移到聚偏二氟乙烯膜上,室温下将膜用5%脱脂牛奶封闭1 h。然后将膜与RUNX2(1 ∶1 000稀释)、OCN(1 ∶500稀释)、Smad4(1 ∶2 000稀释)和β-actin(1 ∶2 000稀释)一抗在4 ℃孵育过夜。然后将膜与山羊抗兔IgG H&L(HRP)二抗(1 ∶2 000稀释)室温孵育1 h。使用增强化学发光(ECL)底物试剂盒显影。β-actin作为内参蛋白。在Image J软件上分析蛋白质条带的灰度值。
1.3 数据统计分析
2.1 hPDLSCs的形态学观察和鉴定
培养的hPDLSCs主要呈束状长梭形,少量呈椭圆形或纺锤形(见图1)。流式细胞术检测hPDLSCs表面标记物,结果显示hPDLSCs中STRO-1(99.64%)和CD146(99.83%)主要为阳性,CD34(0.11%)和CD45(1.04%)主要为阴性(见图2)。证实分离的hPDLSCs具有干细胞特性。

图1 倒置显微镜下的第3代hPDLSCs形态 (×40)Figure 1 Morphology of 3rd generation hPDLSCs under inverted microscope (×40)
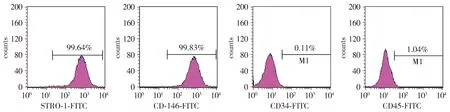
图2 流式细胞仪检测hPDLSCs中STRO-1、CD146、CD34和CD45的表达Figure 2 Expression of STRO-1, CD146, CD34 and CD45 in hPDLSCs byflow cytometry
2.2 紫草素对hPDLSCs增殖的影响
各组间hPDLSCs的相对活力差异有统计学意义(F=29.614,P<0.001),与0 μmol/L组相比,1 μmol/L组和10 μmol/L组hPDLSCs的相对细胞活力均升高(P<0.05),分别升高了12.00%和23.31%;
0.1 μmol/L组和100 μmol/L组hPDLSCs的相对细胞活力与0 μmol/L组相比差异无统计学意义(P>0.05,见图3)。
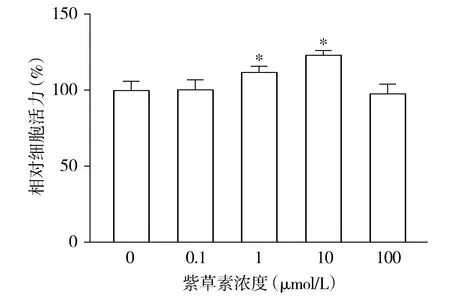
与0 μmol/L组比较,*P<0.05图3 MTT法检测不同浓度的紫草素对hPDLSCs增殖的影响Figure 3 Effect of different concentrations of shikonin on the proliferation of hPDLSCs by MTT
2.3 紫草素对hPDLSCs ALP染色和活性的影响
各组hPDLSCs的ALP染色结果显示,1 μmol/L组和10 μmol/L组ALP染色较0 μmol/L组明显更深(见图4)。各组hPDLSCs的相对ALP活性差异有统计学意义(F=29.807,P<0.001),与0 μmol/L组相比,1 μmol/L组和10 μmol/L组hPDLSCs的相对ALP活性均升高(P<0.05),分别升高了12.32%和24.19%;
0.1 μmol/L组和100 μmol/L组hPDLSCs的相对ALP活性与0 μmol/L组相比差异无统计学意义(P>0.05,见图4)。
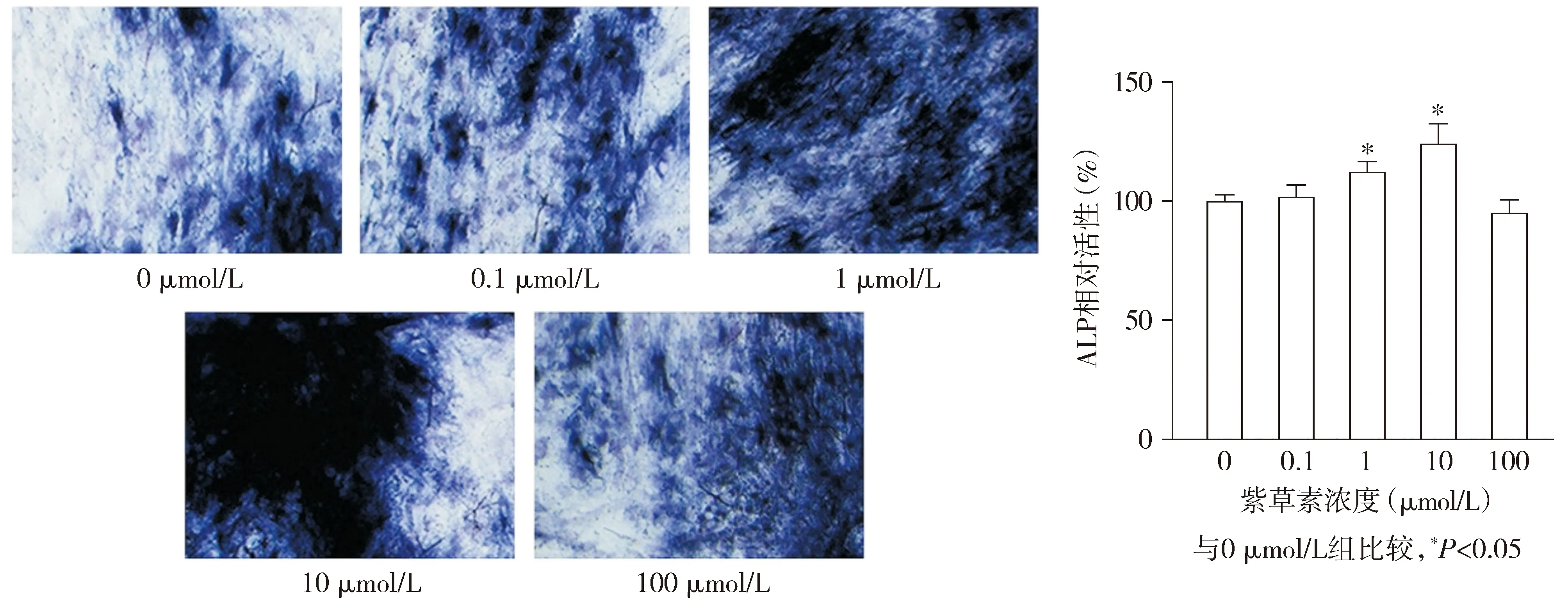
图4 不同浓度的紫草素对hPDLSCs中ALP活性的影响 (ALP染色,×200)Figure 4 Effect of different concentrations of shikonin on ALP activity in hPDLSCs (ALP staining,×200)
2.4 紫草素对hPDLSCs钙化结节形成的影响
各组hPDLSCs的钙化结节形成量(OD590 nm)差异有统计学意义(F=12.500,P<0.001),与0 μmol/L组相比,1 μmol/L组和10 μmol/L组hPDLSCs的钙化结节形成量(OD590 nm)均升高(P<0.05),分别升高了10.85%和24.63%;
0.1 μmol/L组和100 μmol/L组hPDLSCs的钙化结节形成量(OD590 nm)与0 μmol/L组相比差异无统计学意义(P>0.05,见图5)。
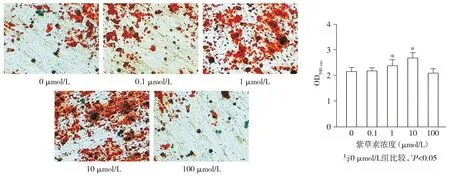
图5 不同浓度的紫草素对hPDLSCs钙化结节形成的影响 (茜素红染色,×200)Figure 5 Effect of different concentrations of shikonin on the formation of calcified nodules in hPDLSCs (Alizarin red staining,×200)
2.5 紫草素对hPDLSCs中成骨相关基因和蛋白表达的影响
各组hPDLSCs中RUNX2(F=746.660,P<0.001)、OCN(F=767.637,P<0.001)和Smad4(F=729.021,P<0.001)mRNA水平差异有统计学意义。与0 μmol/L组相比,1 μmol/L组和10 μmol/L组hPDLSCs的RUNX2、OCN和Smad4的mRNA水平均显著升高(P<0.05),100 μmol/L组Smad4的mRNA水平显著降低(P<0.05);
0.1 μmol/L组和100 μmol/L组hPDLSCs的RUNX2和OCN的mRNA水平与0 μmol/L组相比差异无统计学意义(P>0.05,见图6)。

与0 μmol/L组比较,*P<0.05图6 不同浓度的紫草素对hPDLSCs中成骨相关基因转录的影响Figure 6 Effect of shikonin at different concentrations on the transcription of osteogenic genes in hPDLSCs
各组hPDLSCs中RUNX2(F=428.122,P<0.001)、OCN(F=1 417.675,P<0.001)和Smad4(F=1 322.665,P<0.001)蛋白表达水平差异有统计学意义,与0 μmol/L组相比,1 μmol/L组和10 μmol/L组hPDLSCs中RUNX2、OCN和Smad4蛋白相对表达量均显著升高(P<0.05),100 μmol/L组Smad4蛋白相对表达量显著降低(P<0.05)。0.1 μmol/L组和100 μmol/L组hPDLSCs中RUNX2和OCN蛋白相对表达量与0 μmol/L组相比差异无统计学意义(P>0.05,见图7)。

与0 μmol/L组比较,*P<0.05图7 Western blot检测不同浓度的紫草素对hPDLSCs中成骨相关蛋白表达的影响Figure 7 Effect of different concentrations of shikonin on the expression of osteogenic related proteins in hPDLSCs by Western blot
本研究中分离的细胞主要呈束状长梭形,符合hPDLSCs的形态特征。Seo等[3]报道,hPDLSCs表达间充质干细胞表面抗原STRO-1及血管周围细胞表面标记物CD146。另外,CD34和CD45是造血干细胞表面抗原。本研究通过流式细胞术检测了hPDLSCs中STRO-1、CD146、CD34和CD45的表达,结果显示hPDLSCs中STRO-1和CD146为强阳性表达,CD34和CD45为强阴性表达。这表明所培养的细胞符合成体干细胞的特性。
hPDLSCs在牙周组织再生修复中的效果取决于其数量和功能活性,通过药物处理来增加hPDLSCs的增殖和成骨分化将有助于提高hPDLSCs在口腔医学中的应用成功率,并且,已有文献指出使用具有抗氧化、抗炎的物质对干细胞进行预处理可以影响它们优先分化为特定的细胞谱系[13]。然而,目前临床中缺乏有效的药物。众所周知,牙周病与过度炎症有关,具有抗炎作用的药物不仅可以起到抗炎作用,而且可能是牙周组织再生修复的辅助药物。多项文献报道了紫草素在多种细胞和疾病中的抗炎作用[8-10],并且最近的文献报道已经确认紫草素可抑制脂多糖诱导的人牙周膜细胞中的过度炎症[12]。然而,尚无文献探索紫草素对hPDLSCs增殖的影响,本研究表明,1 μmol/L和10 μmol/L的紫草素促进了hPDLSCs的增殖,而当浓度为0.1 μmol/L或100 μmol/L时,hPDLSCs的增殖未受影响,说明合适浓度的紫草素具有促进hPDLSCs增殖的作用。
成骨分化是牙周组织重建的关键步骤,成骨分化与ALP活性有直接的关系,并且涉及几种成骨相关基因或蛋白的表达,其中包括RUNX2、OCN和Smad4。ALP活性增高可增加细胞内游离的磷离子浓度,从而促进钙盐沉积和钙化结节的形成[14]。RUNX2是成骨和软骨细胞分化和骨形成必不可少的重要转录因子,调节多种相关成骨基因的转录、翻译和定向分化[15]。RUNX2的缺失会降低小鼠的骨形成[16]。此外,RUNX2调节Ⅰ型胶原基因和ALP[17]。OCN也是另一种成骨分化基因,能够和羟磷灰石结合并促进骨的形成和矿化[18],OCN的上调可反映PDLSCs中的成骨细胞表型[19]。有研究报道,Smad4通过与磷酸化的Smad1/5/8结合形成转录复合物来诱导其下游钙化基因的表达[20]。Smad4的下调会降低RUNX2的表达和钙化结节数,并抑制ALP活性,从而抑制成骨分化[21]。本研究检测了紫草素对成骨分化诱导培养基培养的hPDLSCs中ALP活性、钙化结节形成和成骨相关基因和蛋白表达的影响。结果表明,1 μmol/L和10 μmol/L的紫草素升高了hPDLSCs中ALP活性、促进了钙化结节形成,并上调了RUNX2、OCN和Smad4的转录和蛋白表达,而当浓度为0.1 μmol/L或100 μmol/L时,则不能促进hPDLSCs的成骨分化。因此,适当浓度的紫草素可促进hPDLSCs的成骨分化。
综上所述,本研究表明适当浓度的紫草素可促进hPDLSCs的增殖和成骨分化。由于大多数牙周病为炎症性疾病,过度的炎症可导致牙周组织无法再生[22],因此具有抗炎作用的紫草素可能是牙周组织再生修复中具有重要的潜在应用价值。
猜你喜欢 紫草成骨分化 两次中美货币政策分化的比较及启示清华金融评论(2022年4期)2022-04-13经典Wnt信号通路与牙周膜干细胞成骨分化口腔医学(2021年10期)2021-12-02分化型甲状腺癌切除术后多发骨转移一例国际放射医学核医学杂志(2021年10期)2021-02-28鲁政委:房地产同城市场初现分化房地产导刊(2020年7期)2020-08-24不同种类紫草对比研究中国野生植物资源(2020年3期)2020-06-13小儿红屁股涂紫草油特别健康(2018年9期)2018-07-17左、右归丸对去卵巢大鼠BMSCs成骨、成脂分化后Caspase-3/Bcl-2的影响中成药(2017年10期)2017-11-16糖尿病大鼠Nfic与成骨相关基因表达的研究中华老年口腔医学杂志(2016年2期)2017-01-15液晶/聚氨酯复合基底影响rBMSCs成骨分化的研究中国病理生理杂志(2015年8期)2015-12-21不同市场紫草相关质量的比较研究中国当代医药(2015年10期)2015-03-01本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0727/631398.html




