【www.zhangdahai.com--其他范文】
于 汐 刘 醒 赵洁洁 焦 阳 陆 炎 杨琰英 李小英 汤其群
肥胖引起的胰岛素抵抗与巨噬细胞活化和炎症因子释放引起的慢性代谢性炎症有关,被认为是肥胖引起胰岛素抵抗的关键机制[1]。Hotamisligil等[2]的研究结果表明,肥胖脂肪组织产生的TNF-α可导致胰岛素抵抗,抑制TNF-α可减轻胰岛素抵抗,将肥胖与炎症和胰岛素抵抗联系起来。McNelis等[3]的研究揭示了巨噬细胞,包括脂肪组织巨噬细胞(adipose tissue macrophage,ATM)是炎症因子的主要来源,在引发代谢性炎症和胰岛素抵抗方面具有重要作用。
转录因子阴阳1(Yin Yang 1,YY1)表达广泛,属于多梳组蛋白家族。YY1可根据所在环境和募集的特定辅助因子激活或抑制基因转录[4]。YY1可调节约7%的哺乳动物基因,涉及广泛的生物学功能,如细胞增殖、胚胎发生和分化等。本研究团队的前期研究[5-6]结果表明,肝脏YY1通过上调糖皮质激素受体(glucocorticoid receptor,GR)或抑制法尼醇X受体(farnesoid X receptor,FXR)参与葡萄糖和脂质的稳态。YY1可增加前脂肪细胞中脂滴的累积,通过抑制Chop10的表达刺激脂肪生成,表明其在引起肥胖中发挥潜在的作用。此外,小鼠骨骼肌中YY1的缺乏改善了胰岛素/胰岛素样生长因子(insulin-like growth factor IGF)信号传导,并保护其免受雷帕霉素诱导的胰岛素抵抗和血脂异常[7]。
尽管YY1在上述代谢器官中具有多重作用,但是巨噬细胞YY1是否与代谢调节有关仍待研究。本研究旨在阐明巨噬细胞转录因子YY1基因通过调节炎症因子和脂肪因子分泌,影响脂肪组织和全身的胰岛素敏感性。
1.1 实验动物与分组 C57BL/6J的YY1f/f小鼠、lysozyme-Cre[lyz2-cre(+/-)]小鼠(SPF级)均购自美国Jacksonlab公司。繁殖策略:通过Cre-Loxp系统将>8周龄(适当繁殖年龄)的YY1f/f小鼠与lyz2-cre小鼠交配,得到YY1f/-;
lyz2-cre小鼠。将YY1f/-;
lyz2-cre小鼠与YY1f/f小鼠交配,得到YY1f/f;
lyz2-cre小鼠(即巨噬细胞YY1基因特异性敲除小鼠),再将YY1f/f;
lyz2-cre小鼠与YY1f/f小鼠大量繁殖,得到实验组YY1f/f;
lyz2-cre小鼠及对照组YY1f/f小鼠。实验组、对照组各设6~11只雄性小鼠,各小鼠的出生时间相差7 d内。本研究涉及的动物实验均符合国家实验室动物伦理保护标准及相关法规。
将小鼠饲养于复旦大学附属中山医院动物房。正常饮食饲料:舒克贝塔牌SPF级实验鼠粮(货号为1010038,购自江苏省协同医药生物工程有限责任公司)。高脂饮食饲料:Research Diets饲料(货号为D12492,脂肪占总热量的60%,购自上海睿安生物科技有限公司)。饲料均经钴(Co)60辐照灭菌,无沙门菌等致病菌。饮用水经高压蒸馏后使用,每周换水2次。
1.2 小鼠基因型验证 DNA的提取:剪小鼠脚趾或耳朵置于1.5 mL Eppendorf(EP)离心管中,加入裂解液(450 μL)和蛋白酶K(50 μL),确保组织在液面下。将EP离心管置入烘箱60 ℃、4~6 h或者过夜,中间震荡1次,以裂解充分。16 000×g离心10 min,将上清液转入新的1.5 mL EP离心管中,做好标记。每管加入800 μL无水乙醇,颠倒混匀,静置10 min,再以16 000×g离心10 min,弃上清液,倒扣后晾干,每管加入50 μL三聚乙二胺四乙酸(TE)缓冲液溶解,置于4 ℃冰箱储存。DNA浓度一般为100 ng/μL左右。
琼脂糖凝胶电泳:PCR完成后,每管加入6×上样缓冲液2 μL,起指示作用。配制2%琼脂糖凝胶,140 V电泳30~40 min。PCR设置阴性对照,保证体系无污染。YY1条带位置:野生型YY1 223 bp,YY1f/-369/223 bp,YY1f/f369 bp。lyz2-cre条带位置:lyz2-cre(+/-)700/350 bp,lyz2-cre(-/-)350 bp。若琼脂糖凝胶电泳在700 bp处显示条带,即表明lyz2-cre基因成功表达。
1.3 小鼠骨髓来源巨噬细胞(BMDM)提取 小鼠予吸入异氟烷麻醉,断颈处死,取完整腿骨,浸泡于灭菌杜氏磷酸缓冲液(DPBS)中,在DPBS中剥离腿骨上的肉,再将剥好的腿骨浸入含1640培养基的10 cm培养皿中,剪开腿骨两端,用预吸5 mL的注射器(插入1 mL针头)轻轻吹动骨腔,下接15 mL离心管,吹尽红色的巨噬细胞。用1 mL的移液枪反复吹打悬浮的巨噬细胞组织,经70 μm筛网进50 mL离心管,300×g离心10 min,如有红细胞则需要裂解;
将分离好的小鼠巨噬细胞,置于小鼠BMDM诱导培养液(LCM)中,除去上清液铺板,每2 d更换1次培养液,7 d后BMDM诱导基本完成。提取细胞中RNA,反转录为cDNA后,进行实时荧光定量PCR(qRT-PCR)检测。若巨噬细胞YY1基因的mRNA相对表达量(转录水平)显著降低,即表明巨噬细胞YY1基因特异性敲除小鼠模型构建成功。
1.4 qRT-PCR 反转录反应:反转录前将RNA 70 ℃ 10 min充分变性。依据Takara反转录试剂盒说明书,PCR过程:反应阶段42 ℃ 15 min,反转录酶失活阶段95 ℃ 5 s。在反转录产物互补DNA(cDNA)中加入焦碳酸二乙酯处理过并经高温高压灭菌的超纯水(DEPC水)稀释10倍,分装后置于-20 ℃冰箱中冻存。qRT-PCR的反应体系:DEPC水2 μL,正向引物0.5 μL,反向引物0.5 μL,cDNA 2 μL,荧光DNA结合染料(SYBR)5 μL。qRT-PCR程序(反转录后的DNA扩增程序):50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s后62 ℃ 15 s(共40个循环),72 ℃ 30 s。检测正常饮食的两组小鼠BMDM中炎症因子mRNA相对表达量。
1.5 葡萄糖耐量、胰岛素耐量实验 实验组及对照组小鼠均给予高脂饮食和正常饮食喂养至第12~13周龄时,进行葡萄糖耐量和胰岛素耐量实验。葡萄糖耐量实验:空腹16 h后,测定空腹(注射后0 min)血糖水平,注射20%葡萄糖(剂量1 mL/kg),记录注射后15、30、60、90、120 min时的血糖水平。胰岛素耐量实验:空腹6~8 h后,测定空腹(注射后0 min)血糖水平,注射胰岛素(剂量0.75 U/kg),记录注射后15、30、60、90、120 min时的相对血糖变化值。注意小鼠注射操作时间,以保证在给药后指定时间检测血糖,并准备20%葡萄糖救助血糖水平过低的小鼠。
1.6 胰岛素信号通路检测 两组小鼠予高脂饮食后,每组取3只小鼠,注射0.9%氯化钠溶液和胰岛素(剂量均为0.75 U/kg)激活胰岛素信号通路,10 min后用手术剪取小鼠的附睾脂肪、肌肉和肝脏组织,采用免疫印迹法检测3种组织中蛋白激酶B(Akt)-糖原合成酶激酶3β(Gsk3β)通路关键蛋白(Akt、Gsk3β)的磷酸化水平。
1.7 蛋白质电泳 配制10%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)胶。分离胶配方:4.7 mL水、2.5 mL 40%丙烯酰胺/亚甲基双丙烯酰胺溶液(Acr/bis)、2.6 mL 1.5 mol/L Tris-HCL、0.1 mL 10%SDS、0.1 mL 10%过硫酸铵(AP)、0.004 mL四甲基乙二胺(TEMED)。浓缩胶配方:1.48 mL水、0.25 mL 40%Acr/bis、0.25 mL 1.0 mol/L Tris-HCL、0.02 mL 10%SDS、0.02 mL 10%AP、0.002 mL TEMED。上样量为15~20 μg,预染内参(GAPDH)蛋白1.0~2.5 μL。恒压75~80 V 1 h后,将电压调为100~120 V至溴酚兰刚跑出即可终止电泳。将电泳后的SDS-PAGE胶切割至小于或等于6 cm×8 cm大小的滤纸,在胶上平铺已用电泳缓冲液浸湿的大小为6 cm×8 cm的聚偏二氟乙烯(PVDF)膜,恒压90 V 120 min转膜。
1.8 血清胰岛素、瘦素和脂联素水平检测 两组小鼠均予高脂喂养至第20周龄,从其眼球取血,分离血浆,冻存血清,采用ELISA法(ELISA试剂盒购自加拿大Anogen公司)检测血清中胰岛素、瘦素和脂联素水平。

2.1 巨噬细胞YY1基因特异性敲除小鼠模型验证 琼脂糖凝胶电泳见700 bp处显示条带,表明lyz2-cre基因表达成功。见图1。实验组小鼠BMDM中,YY1基因mRNA相对表达量为0.020±0.003,显著低于对照组的1.000±0.060(P<0.001),表明巨噬细胞YY1基因特异性敲除小鼠模型构建成功。

未编号样品为内参蛋白,编号161、162样品未见lyz2-cre条带,编号1、154样品成功表达lyz2-cre基因
2.2 两组小鼠葡萄糖耐量和胰岛素耐量实验结果比较 高脂喂养下,实验组小鼠注射葡萄糖后60、90 min时的血糖水平均显著低于对照组同时间点(P值均<0.05),两组间注射葡萄糖后0、15、30、120 min时血糖水平的差异均无统计学意义(P值均>0.05)。实验组小鼠注射胰岛素后30、60、90 min时的相对血糖值均显著低于对照组同时间点(P值分别<0.05、0.001、0.01),两组间注射胰岛素后0、15、120 min时相对血糖值的差异均无统计学意义(P值均>0.05)。见表1。正常饮食喂养下,两组各时间点间血糖水平和相对血糖值的差异均无统计学意义(P值均>0.05)。见表2。

表1 两组小鼠高脂饮食喂养下葡萄糖耐量(血糖水平)和胰岛素耐量(相对血糖值)实验结果的比较

表2 两组小鼠正常饮食喂养下葡萄糖耐量(血糖水平)和胰岛素耐量(相对血糖值)实验结果的比较
2.3 两组小鼠胰岛素信号通路结果 实验组小鼠附睾脂肪中胰岛素信号通路关键蛋白Akt及Gsk3β磷酸化水平均明显上调,表现为磷酸化Akt(p-Akt)及磷酸化Gsk3β(p-Gsk3β)蛋白质显影较对照组同种处理明显增强;
肌肉和肝脏组织中Akt和Gsk3β磷酸化水平无明显变化,表现为p-Akt及p-Gsk3β的蛋白质显影与对照组同种处理相比无明显差异。见图2。
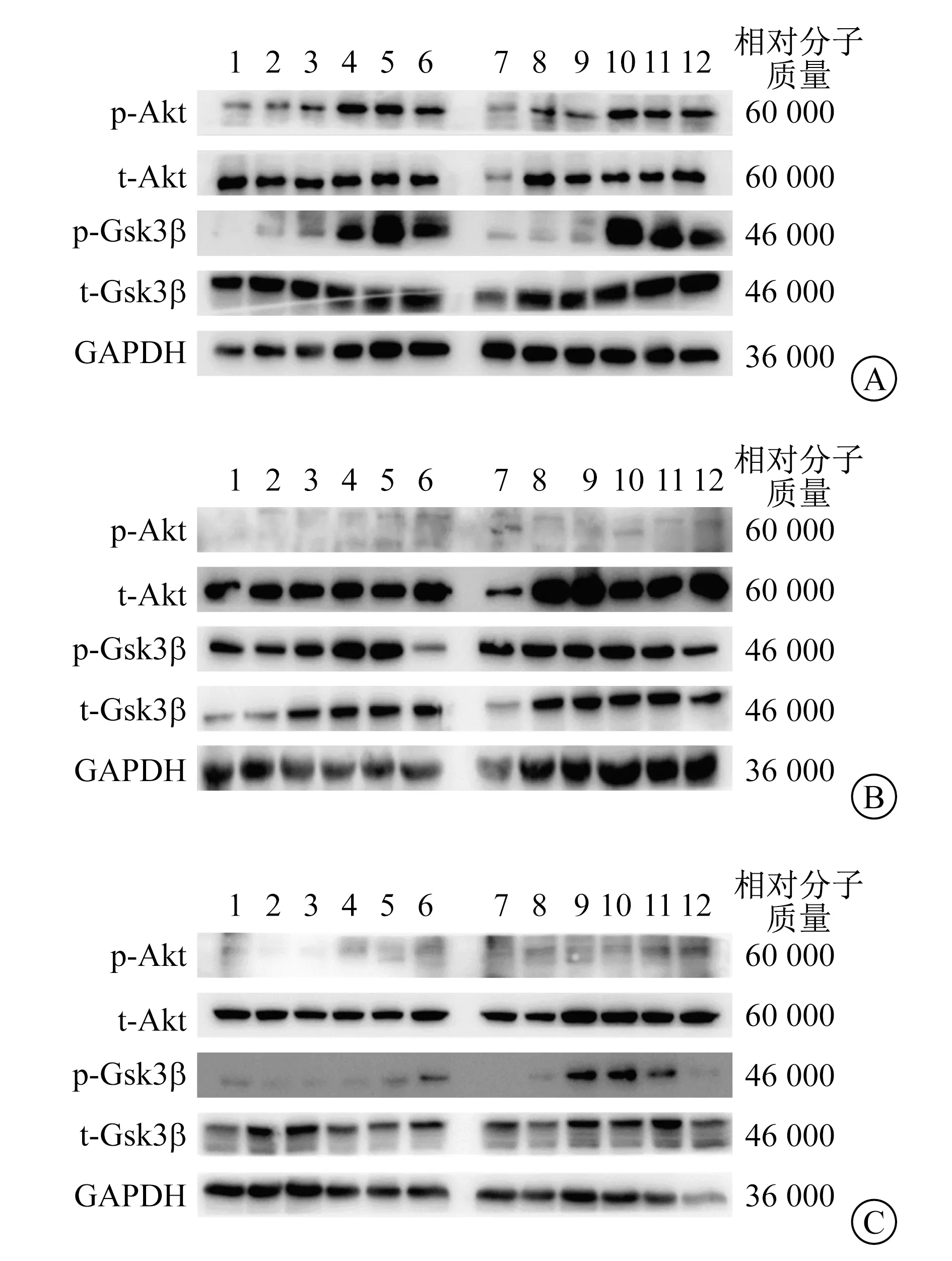
t-Akt:总Akt。t-Gsk3β:总Gsk3β。1、2、3 对照组+0.9%氯化钠溶液 4、5、6 实验组+0.9%氯化钠溶液 7、8、9 对照组+胰岛素 10、11、12 实验组+胰岛素 A 附睾脂肪B 肌肉 C 肝脏组织
2.4 两组高脂饮食喂养小鼠血清胰岛素、瘦素、脂联素水平比较 实验组血清瘦素、脂联素水平均显著高于对照组(P值均<0.05);
实验组血清胰岛素水平较对照组有下降趋势,但差异无统计学意义(P>0.05)。见表3。

表3 两组高脂饮食喂养小鼠血清胰岛素、瘦素、脂联素水平的比较
2.5 两组小鼠BMDM中炎症因子mRNA相对表达量比较 实验组小鼠BMDM中IL-6 mRNA、TNF-α mRNA、IL-1β mRNA相对表达量均显著低于对照组(P值均<0.001)。见表4。

表4 两组小鼠BMDM中炎症因子mRNA相对表达量的比较
现有研究[5-7]结果表明,YY1在肝脏、脂肪组织和肌肉中都具有多种代谢调节功能,但其在巨噬细胞中的作用仍待阐明。本研究分析了巨噬细胞YY1基因敲除小鼠的代谢变化,结果显示:高脂喂养后,实验组小鼠注射葡萄糖后60、90 min时的血糖水平均显著低于对照组同时间点,注射胰岛素后30、60、90 min时的相对血糖值均显著低于对照组同时间点,提示YY1基因敲除改善了小鼠葡萄糖耐量和胰岛素敏感性,表明巨噬细胞中的YY1基因具有影响葡萄糖代谢的作用。
脂联素是白色脂肪组织分泌量最丰富的脂肪因子,具有抗炎和胰岛素增敏特性[8]。研究[9]发现,肥胖的啮齿类动物和人类的血浆脂联素水平降低,脂联素缺乏的小鼠暴露于高脂饮食喂养时会发生葡萄糖不耐受和胰岛素抵抗[10]。相反,脂联素过表达或给予重组脂联素可改善肥胖小鼠的胰岛素敏感性和葡萄糖稳态[11]。此外,脂联素抑制巨噬细胞的TNF-α表达和相关炎症反应,促进巨噬细胞表型转变为抗炎的亚型[12]。本研究结果显示,实验组小鼠血清脂联素水平显著高于对照组,表明了其在抗炎和胰岛素增敏方面具有潜在作用。
胰岛素抵抗是2型糖尿病的标志之一,与胰岛素信号通路下游分子水平密切相关。同时,Gsk3是胰岛素信号通路最重要的分子之一。Akt磷酸化抑制Gsk3β,导致Gsk3β去磷酸化并活化,从而增加糖原合成[13]。Gsk3β受到胰岛素等上游刺激物的抑制,这对于维持胰岛素信号传导至关重要。研究结果表明,Gsk3β过度激活与胰岛素抵抗密切相关[14];
在高脂喂养小鼠的附睾脂肪中,Gsk3β活性增加[15]。此外,新的证据表明,脂肪组织中Gsk3β的功能障碍介导了多种因素对脂肪生成、胰岛素敏感性,甚至炎症的调节作用[16]。本研究结果显示,实验组小鼠附睾脂肪中胰岛素信号通路关键蛋白Akt及Gsk3β磷酸化水平均明显上调,表明实验组小鼠Akt-Gsk3β通路被激活,进而表现为胰岛素敏感性改善,推测其与敲除了巨噬细胞YY1基因有关。脂联素对Gsk3β的调节或相互作用目前仍缺乏研究,推测肥胖小鼠的巨噬细胞YY1基因敲除通过上调脂联素和Akt磷酸化的Gsk3β水平来提高胰岛素敏感性。肥胖的脂肪组织常常有大量的巨噬细胞浸润,以M1巨噬细胞数量增多为主,其中释放的炎症因子与胰岛素抵抗有关。因此,在脂肪组织中比较容易观察到胰岛素信号通路的变化;
而在肌肉和肝脏组织中的巨噬细胞浸润则相对较少,对胰岛素信号通路的影响则较小。
综上所述,巨噬细胞转录因子YY1基因敲除小鼠可能通过减轻巨噬细胞的炎症反应,上调脂联素的表达,从而增强脂肪组织中胰岛素信号通路活性,进一步改善高脂饮食小鼠的胰岛素敏感性。巨噬细胞转录因子YY1基因敲除可通过激活Akt-Gsk3β胰岛素通路来改善葡萄糖耐量和胰岛素敏感性,这可能与脂肪因子的分泌增多和巨噬细胞炎症反应的减轻有关。因此,调节巨噬细胞转录因子YY1基因可能是肥胖相关胰岛素抵抗的潜在治疗策略。
猜你喜欢 耐量脂联素葡萄糖 老年前降支单支病变冠心病病人经皮冠状动脉介入治疗术后运动耐量的影响因素分析实用老年医学(2021年9期)2021-09-28葡萄糖漫反射三级近红外光谱研究中国甜菜糖业(2020年1期)2020-12-07多元化健康教育对血液透析患者健康知识掌握及运动耐量的影响透析与人工器官(2020年1期)2020-11-16葡萄糖对Lactobacillus casei KDL22发酵及贮藏性能的影响中国乳业(2016年4期)2016-11-07酵母源葡萄糖耐量因子的提取纯化研究天然产物研究与开发(2016年11期)2016-06-15自噬与脂联素诱导的人乳腺癌MCF-7细胞凋亡的关系安徽医科大学学报(2015年9期)2015-12-16脂联素与代谢性疾病的关系医学综述(2015年12期)2015-12-1018~F-脱氧葡萄糖PET/CT在胰腺占位诊断与分期中的价值肿瘤影像学(2015年3期)2015-12-09多发性肺硬化性血管瘤18~F-脱氧葡萄糖PET/CT显像1例肿瘤影像学(2015年3期)2015-12-09脂联素、瘦素与2型糖尿病患者轻度认知功能障碍的关系郑州大学学报(医学版)(2015年2期)2015-02-27本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0807/636477.html




