【www.zhangdahai.com--其他范文】
杜 微,王小亭,刘大为
中国医学科学院北京协和医院重症医学科, 北京 100730
人类对重症认知的重要里程碑是从对休克的血流动力学精细化理解开始。经过几十年的发展,血流动力学治疗理念更加完善,监测指标层出不穷且日新月异,使得目标导向的休克复苏策略的临床实施更加可控、更加精准。休克的治疗既有依托于指南的群体化治疗,又有具体到床旁每一位患者的个体化策略,更有深入于血流动力学失衡后再稳态、失调节后重建自调节的器官化治疗策略的层层推进。
休克,是指有效循环内血容量急剧减少,组织灌注不能满足代谢需要。目前,已经明确流量改变是休克形成的本质,并贯穿休克病理生理学改变的始终,即流量携带着氧形成氧输送但未能满足组织氧需求,或者氧未能输送至最需要氧的组织,使得细胞仍处于缺氧状态。而血流,特别是血流中的氧流缺乏,始终与休克捆绑在一起。因此,有必要进一步探讨血流及血流中的氧流,以期在器官化血流动力学治疗理念之下开启更精准的血流动力学治疗时代。
1.1 心输出量的监测与优化
心输出量是复苏中最有价值的监测大循环流量的指标,因其是影响氧输送至全身组织的最关键变量。心输出量可通过肺动脉导管、PiCCO等有创性方法 (如热稀释或Fick法)以及重症超声心动图等无创性方法,实现心排血量的定性和定量测量。心排血量对组织灌注很重要,但所谓足够的心排血量的需求可能是随时变化的。脓毒症早期的心输出量自身代偿性增加,以弥补全身血管张力的减低并维持血压,但这并非最佳化复苏,全身需要的最佳心输出量依然需要滴定化寻找。因此,仅凭“心输出量数值高”并无法证实复苏充分。
1.2 最佳灌注压力
常见的大循环压力灌注的主要指标——平均动脉压,可能有助于指导初始复苏。很明显,如果缺乏基本的系统流量和器官灌注压力,微血管灌注就无法维持,因此器官灌注压力可驱动器官血流灌注。在生理学中,微血管血流取决于每个器官的灌注,而灌注又取决于心输出量、灌注压(不仅取决于上游动脉压,还取决于静脉压和间质压)以及局部血流分布。强调“CVP越低越好”即是为了保障器官静脉回流,此外间质压在体腔中(如颅内、腹内)对灌注压力的影响也十分重要。在器官水平,微血管灌注依赖于基于生物反馈系统的局部调节,需让灌注与代谢需求精细匹配。而在脓毒症患者中,这些调节组织灌注的复杂机制则受到多因素的影响。最近一项研究中,Lamontagne等[1]探究减少血管活性药物暴露对老年脓毒症休克患者90 d死亡率的影响,发现低血压组的90 d死亡率与血压正常组并无差异,提示过高的灌注压力及大剂量血管活性药物暴露可能是有害的。
1.3 微血流的评估
微循环由小血管(小动脉、毛细血管和小静脉)组成,氧在其中弥散,以维持组织灌注和氧合。脓毒症会引起微循环自动调节功能障碍,从而导致血流的异质性异常。当这种情况发生时,一些毛细血管灌注不足,而另一些毛细血管的血流量则不成比例地增加。这种不平衡将导致重症单元缺氧,氧摄取不足和组织灌注不良。此外,由于微血管血栓形成,脓毒症可引起广泛的弥散性血管内凝血。在大循环复苏后,皮肤花斑评分、毛细血管再充盈时间(capillary refill time,CRT)、外周灌注指数可指导脓毒症微血流复苏治疗。
CRT是通过载玻片对示指远端施加压力而获得的测量数值,即甲床发白后保持压力10 s后释放并计算返色时间,正常值≤3 s。ANDROMEDA-SHOCK是第一个比较CRT和乳酸引导复苏的随机对照试验,观察数据显示,CRT时间延长与死亡率增加之间存在关联[2]。
手持显微镜于20世纪90年代引入我国,其可直接显示微循环,目前已被用于临床研究以观察舌下微循环。可视化舌下微循环对红细胞流经毛细血管时的速度和密度进行评估,称为功能性毛细血管密度。Massey等[3]开发了“微循环质量评分”,其可帮助减少伪像,并使这些图像的质量标准化。通常用舌下微循环分析4个参数:微血管流动指数、小血管灌注比、灌注小血管密度和异质性指数,暗视野显微镜等新技术可直接可视化和测量小血管灌注。De Backer等[4]评估了严重脓毒症患者舌下微循环与死亡率之间的关系,结果显示,死亡患者与存活患者的平均动脉压相似。然而,与死亡患者相比,存活患者中灌注血管的比例明显更高,此外,灌注毛细血管比例是ICU预后的最佳预测因子。
休克花斑是指休克时皮肤斑驳状变色,可反映血流量减少和皮肤灌注的异质性。Ait-Oufella等[5]曾用激光多普勒成像分析脓毒症患者的皮肤灌注,结果显示,皮肤灌注与斑点扩大呈负相关,斑点扩大与皮肤灌注及皮肤微循环损伤相关。在临床中,视觉评估的最常见部位为膝盖周围,斑驳评分(0~5分)可基于腿部的斑驳皮肤面积提供半定量评价结果。该评分已得到外部验证,具有很强的评估者间信度。
简便易行的床旁微血流监测指标不多,主要包括膝盖周围的斑驳评分、CRT、中心外周体温差等,这些临床症状体征有助于指导治疗。最近的一项大型临床试验证明CRT可指导早期复苏[2]。
1.4 基于微血流优化的复苏策略
在休克血流动力学复苏中,液体复苏最为重要。低血容量、前负荷依赖与微循环改变相关。液体可改善微血管灌注,但效果并不确定,可能取决于补液时机:确诊脓毒症后,液体复苏可在12~24 h内改善微血管灌注,而后期再复苏对微循环灌注改善作用有限甚至有害[6]。微血管灌注的改善并不依赖于输液量多少而取决于输液时机,似乎在初始阶段给予有限的液体即可改善微循环,而后期给予液体,即便增加了心输出量,效果也可能微乎其微。一般来说,当微循环改善时,器官功能也随之改善,但需注意的是,不同器官的反应可能不同。在腹腔脓毒症患者中,补液可改善舌下微循环,而未必可改善肠道微循环。因此必须找到导致这些差异的原因并尽可能去除,如控制腹腔内局部炎症和升高的腹内压[7]。此外,液体管理对微循环的影响因复苏阶段不同而不同,在容量降阶梯阶段,液体管理也可能影响微循环,需避免过快的液体排出速度导致的微血管灌注恶化。
同时,液体类型也可能发挥一定作用。在实验环境中,胶体(尤其是白蛋白)可比晶体更好地维护糖萼,改善微循环[8]。但在临床中,这些差异还有待于进一步证实。高渗乳酸钠在实验性脓毒症中显示出很好的效果,但仍缺乏临床数据支撑。
缩血管药物对微循环的影响也存在差异,这种差异可能取决于目标血压以及药物本身的剂量和类型。例如,虽然纠正严重低血压与微血管灌注改善有关,但当平均动脉压升至65 mm Hg(1 mm Hg=0.133 kPa)以上时,血压则与微血管灌注的基础改变成反比;
在接受大剂量去甲肾上腺素治疗的脓毒症休克患者中,血管加压素与去甲肾上腺素的结合改善了微血管灌注,而在小剂量去甲肾上腺素治疗的患者中,微血管灌注并未改善[9]。
休克时组织灌注受损可能与大循环血管舒张,而微循环部分前毛细血管强烈收缩或塌陷导致微循环灌流障碍有关。因此,通过使用血管活性物药增加动脉灌注压并不一定能克服前毛血细管的临界闭合压,但通过使用β受体阻滞剂或血管扩张剂等靶向血流动力学治疗,可改善部分患者的微循环血流灌注[10]。
2.1 氧流的定义
血流具有龙头效应,是“第一性”目的性指标,而氧流是血流的重要组成成分,接近目的性指标。氧流的恶化,是血流动力学恶化之始。重症患者血流所有组成成分中氧流最重要,其无处不在,从循环内到组织间、细胞内及线粒体,氧流在机体内供细胞即时性使用,且不可长期储备。
氧流指氧在机体内流动,氧气分子以结合或溶解态随血流流动,并以对流或弥散的形式从循环内到达组织细胞内,参与机体氧代谢化学反应以及能量代谢,对维持生命至关重要。
机体通过肺通气与肺换气,使得氧气从大气进入肺循环,开启了氧气分子在机体内流动之旅。氧流在机体的流动为氧气分子在体循环内运输的过程,包括从血管进入组织细胞的多个步骤,涵盖体循环与肺循环系统,大循环与微循环系统以及循环内携氧红细胞、血浆、间质组织、组织细胞、细胞内线粒体等多个位点,并受到微血流、毛细血管密度、血红蛋白浓度、氧气对血红蛋白的亲和力等多种生理及病理因素的影响。
2.2 氧流影响血流、血流决定氧流
复苏的临床思维是通过调节血流以改变氧流。然而机体可通过组织氧代谢及组织氧需求的自我调节过程改变血管张力,即氧流有调节血流的作用。
血管内皮通过自我调节以适应氧需求,而从大动脉到静脉,内皮细胞无处不在,其具有调节血管张力、炎症、凝血以及控制渗透性等多种作用。在微血管水平,内皮层是通过激活局部扩张或收缩控制局部灌注的关键因素。此外,内皮细胞也参与了从外周到近端血管的信息传递,从而使灌注与代谢需求精确匹配。
有研究显示,高氧会诱导血管收缩导致心脏后负荷增加,其潜在机制可能与持续的氧化应激导致的NO生物利用度降低有关[11]。另有研究显示,高氧可改变微循环毛细血管灌注比例,提高微循环的临界闭合压[12]。
脑组织局部电活动增加会导致组织和血浆氧张力下降,而血浆氧张力下降可改变红细胞的力学性能,导致红细胞流速增加。氧张力的短暂下降能够驱动毛细血管快速充血,而局部组织氧分压下降又可持续驱动毛细血管充血及小动脉血管扩张[13]。因此可以说,人体内氧流调节血流无处不在,氧流影响血流、血流决定氧流。
2.3 从血流到氧流的系列功能障碍
心血管功能障碍:休克时,当大循环血流带来的全身氧输送不能满足组织灌注氧需求时,被称为心血管功能障碍。
微循环功能障碍:休克时,由小动脉、毛细血管和小静脉等小血管(<100 mmol/L)组成的微循环血流异质性影响到微血流的氧输送时,被称为微循环功能障碍。
内皮功能障碍:微循环血管内皮由一种被称为内皮糖萼的分子网络构成,其丰富的碳水化合物层排列在血管内皮的管腔表面。由于携带负电荷,血管内皮糖萼可阻止带负电荷的蛋白质进入血管外,并作为白细胞粘附内皮细胞的屏障,是血管通透性的重要决定因素。脓毒症状态下,金属蛋白酶、肝素酶和透明质酸酶等各种酶被白细胞介素- 1β、肿瘤坏死因子-α、活性氧等细胞因子激活,破坏了内皮细胞糖萼结构。休克时,随着内皮糖萼结构破坏及功能丧失,血管通透性增加,微循环易受局部血流变化的影响,介导微血管舒张的诱导型一氧化氮合酶也呈异质性表达,可导致病理动静脉分流的形成以及内皮功能障碍的发生。通过认识血管内皮糖萼、监测血管内皮糖萼的降解产物可更好地识别血管内皮损伤。在休克患者中,血管内皮功能障碍会导致局部血流灌注分布的改变,脓毒症时内皮细胞的激活导致促凝血和促炎状态,以及粘附分子的分泌,这有利于微血栓的形成和循环细胞对内皮的粘附[14]。
线粒体功能障碍:除红细胞外,线粒体存在于人体的所有细胞中。来自较高能量需求的肝脏和肌肉组织通常比其他组织细胞含有更多的线粒体。线粒体的主要功能是产生三磷酸腺苷(adenosine triphosphatase,ATP),这是大多数细胞活动(如细胞分裂、细胞信号传导和肌肉收缩等)所必需的主要能量载体。ATP产生过程涉及电子从三羧酸循环转移至线粒体内膜上的一系列酶复合物(复合体Ⅰ~Ⅳ)组成的电子传递链。随着电子沿电子传递链向下游移动形成质子梯度,该梯度为ATP酶复合物(复合体V)提供能量以将二磷酸腺苷磷酸化为ATP,该过程的氧消耗占全身氧消耗的90%以上。除产生能量外,细胞中线粒体的其他作用还包括产热、细胞内钙调节、细胞凋亡和细胞内信号传导,使线粒体成为维持正常细胞功能的重要细胞器。休克患者中观察到的组织氧张力增加,可通过细胞病理性缺氧或线粒体功能障碍来解释,即尽管细胞内有正常或超常的氧可用性,但ATP的产生和氧消耗仍可能减少,导致线粒体发生功能障碍。已有研究证明,线粒体功能障碍与脓毒症患者的疾病严重程度及转归有关[15]。
众所周知,脓毒症是由宿主对感染的免疫应答失调引起的,其特征在于早期免疫激活炎症反应阶段和随后的免疫抑制阶段,且氧化应激已被证明是导致线粒体功能障碍的重要因素之一。因此,通过恢复线粒体内氧化剂和抗氧化剂之间的平衡,甚至通过增强其生物合成以恢复线粒体功能,可能是脓毒症患者管理的关键。当血流与氧流不能满足组织氧需求,最终将导致线粒体功能障碍及能量障碍。
2.4 系统氧流的监测与导向复苏
氧流是血流的天然标记物,可指导血流动力学滴定化治疗。同时,通过调整血流的合理化目标,可实现优化组织灌注氧代谢的目的。
动脉血氧饱和度、氧分压及血红蛋白是系统氧流的重要指标,上腔静脉氧饱和度作为全身氧供/氧耗平衡后的结果指标已经是休克复苏的重要目标性指标。
乳酸水平的升高通常是由于相对氧供应和组织需求之间不匹配所导致。然而,乳酸代谢是复杂的,乳酸产生可能对糖酵解和糖异生都是必需的,特别是在休克状态下。乳酸的升高也可继发于普通药物,如肾上腺素、β-受体激动剂和二甲双胍。此外,由于乳酸被肝脏(60%~70%)和肾脏(30%)清除,在有器官功能障碍的患者中,乳酸清除受阻,可能难以解释。因此,在解释乳酸水平升高时,临床医生必须考虑A型(供氧不足)和B型(无供氧不足迹象)乳酸酸中毒。乳酸清除率和乳酸正常化是脓毒症患者生存率强有力的预测因子。6 h时的乳酸清除率可作为复苏成功的标志。然而,需特别注意肝和/或肾功能不全的患者,此类患者在已有研究中的代表性不足。若乳酸清除率是唯一使用的指标,此类患者就有静脉输液过度复苏的风险,因此需进一步的研究以评价乳酸清除率在该类患者中的应用价值。
2.5 微氧流的监测与优化
理论上讲,基于氧流的复苏,红细胞输注可能是很有前景的,但研究结果令人失望。在脓毒症患者中,Scheuzger等[16]报道了红细胞输注对舌下微循环的影响,发现微循环改变较大的患者,输血后微血管灌注改善;
而微循环改变较小的患者,输血后微血管灌注恶化。分析相关原因,游离血红蛋白含量和/或输注红细胞的质量可能起到一定作用,因为微循环的变化被证明与游离血红蛋白的变化呈负相关。有趣的是,基线水平的血红蛋白值并不影响对输血的反应。因此,输血应仅限于微血管灌注严重改变的患者,而不应仅基于血红蛋白阈值。
灌注毛细血管密度降低的直接后果是毛细血管间距增加,进而导致氧气扩散距离增加。大鼠心肌细胞内毒素给药后,氧扩散距离增加了50%[17]。腹膜炎实验模型中,微血管血流异质性与肠系膜氧摄取率密切相关,表明在脓毒症休克的发展和复苏过程中微血管血流分布对氧摄取具有关键作用[18]。此外,在微血管灌注不良区域,氧化还原电位增加,提示组织缺氧。人类局部组织缺氧的演化更加复杂,目前只有间接证据表明微血管距离的改变导致局部组织缺氧。
器官局部组织氧分压如脑组织氧分压(tissue oxygen partial pressure,PtiO2)越来越被当作一个动态变量,代表了脑氧输送与局部氧需求之间的相互作用以及组织氧扩散梯度。脑和全身因素均可影响PtiO2值,而PtiO2被认为是脑细胞功能的生物标志物,这使得其成为合适的治疗目标[19]。
有动物实验依据皮肤线粒体氧张力来指导失血性休克的输血复苏,而皮肤线粒体氧张力变化先于全身耗氧量和乳酸水平显著改变,这提示线粒体氧张力导向性复苏的时代已经到来[20]。
50年前,Weil医生将休克分为低血容量休克、心源性休克、分布性休克和梗阻性休克。从血流动力学特点入手,上述分型推进了对休克机制的理解,改变了休克的临床诊疗思路。随着血流动力学治疗的器官化,血流和氧流已步入细节化、滴定化治疗时代,因此,基于血流动力学治疗重点的休克分型极为重要。
依据大血流是否充足,微血流异质性是否存在,系统氧流包括携氧物质能否支撑机体氧需求、微氧流能否充分跨越氧弥散距离而进入组织细胞及线粒体等,我们将休克分成4个新的亚型(图1)。该4个亚型最终复苏目的是保证线粒体有充足的氧供及避免线粒体损伤,并分别导向不同的血流动力学治疗重点。分型Ⅰ以大血流受累为主,比如低血容量状态、心功能障碍等,复苏重点在于充分的系统血流复苏,包括静脉回流与心功能的合理化调整,心室-动脉耦合的调节等。分型Ⅱ以脓毒症微循环异质性为典型代表,微血流复苏的重点在于如何尽快评估及改善微血流分布的异质性,应第一时间启动病因学治疗,同时选择合适的复苏液体、活性药物等。分型Ⅲ以系统氧流受累为主,以低氧血症、贫血为典型代表,复苏重点在于肺循环血流动力学保护、优化输血治疗等。分型Ⅳ以微氧流受累为主,复苏重点在于减少氧弥散距离、血管内皮损伤保护、减少毛细血管渗漏、精准化液体治疗等。同一位患者可能在休克的不同时间有不同的休克分型,希望该基于血流与氧流的休克分型能给临床带来更多治疗获益。
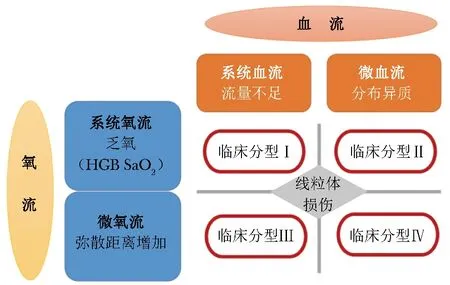
图1 血流-氧流导向血流动力学治疗的休克分型
本文在血流动力学“血流至上”的原则下,进一步提出了“氧流至优”的理念。基于此理念,我们认为,不论患者是否存在器官功能障碍,只要无明确血流及氧流受累紊乱,均不应纳入重症患者之列。相信在“血流联合氧流”这一目标导向下,未来血流动力学的分型及治疗之路将走向更加精准化!
作者贡献:杜微负责选题设计并撰写论文初稿;
王小亭负责论文修订;
刘大为终审定稿。
利益冲突:所有作者均声明不存在利益冲突
猜你喜欢 微血管脓毒症休克 休克指数指导在外伤性肝脾破裂大出血患者救护中的应用承德医学院学报(2022年2期)2022-05-23乙型肝炎病毒与肝细胞癌微血管侵犯的相关性昆明医科大学学报(2021年3期)2021-07-22缺血修饰白蛋白对微血管心绞痛的鉴别诊断价值研究世界最新医学信息文摘(2021年12期)2021-06-09车祸创伤致失血性休克的急救干预措施分析世界最新医学信息文摘(2021年12期)2021-06-09血清IL-6、APC、CRP在脓毒症患者中的表达及临床意义中华养生保健(2020年4期)2020-11-16碘克沙醇注射液致过敏性休克一例云南医药(2019年3期)2019-07-25脓毒症的病因病机及中医治疗进展中国中医急症(2019年10期)2019-05-21脓毒症早期诊断标志物的回顾及研究进展中华老年多器官疾病杂志(2016年9期)2016-04-28IMP3在不同宫颈组织中的表达及其与微血管密度的相关性中国医药导报(2015年26期)2015-02-28上皮性卵巢癌组织中miR-126、EGFL7的表达与微血管密度的检测郑州大学学报(医学版)(2015年2期)2015-02-27本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0904/649595.html




