【www.zhangdahai.com--其他范文】
张宗峰,买热排提·哈力木拉提,苏米亚·艾合买提江,王若愚,叶 晨,黄晓婕,张 敏,张召锋
(北京大学公共卫生学院营养与食品卫生学系/北京市食品安全毒理学研究与评价实验室,北京 100191)
流行病学数据显示,我国2型糖尿病患病率上升至11.2%[1],其中42%的中国2型糖尿病患者合并有血脂异常[2-3],血脂异常可进一步增加糖尿病大血管和微血管并发症的风险[4],是糖尿病并发症(特别是心血管并发症)发生发展的重要危险因素[5]。临床上,除了药物治疗以外,糖脂代谢紊乱的综合管理应以生活方式干预为基础,贯穿于2型糖尿病的治疗全过程[1]。近年来,随着人们对饮食健康的日益关注,燕麦因其膳食纤维含量高、营养丰富成为热点,被认为是21世纪适合现代人经常食用的高营养价值谷物。燕麦麸皮是燕麦加工过程中的副产物,是燕麦中主要功能成分β-葡聚糖(oat β-Glucan,OG)最为集中的部分,研究表明,燕麦β-葡聚糖具有降低血糖、调节肠道菌群的作用[6-10]。而燕麦麸皮廉价易得,因加工过程中只是进行粉碎、筛分等物理方式处理,不接触溶媒,安全性也更高,如能充分利用,不仅能改善2型糖尿病患者糖脂代谢紊乱等情况,也可以缓解中国人群膳食纤维摄入不足、种类单一的现状[11],本研究拟在动物水平对燕麦麸皮的降糖降脂功效进行验证。
1.1 实验动物
50只体重为180~220 g的SPF级雄性SD大鼠[生产许可证号:SCXK(京)20l6-00l3],购自北京大学医学部实验动物科学部,饲养于屏障环境内[使用许可证号:SYXK(京)2021-0064],相对湿度50%~60%,明暗每12 h交替,大鼠自由饮水、摄食,室温(25±1)℃。动物喂养及实验按照《北京市实验动物管理条例》执行,并经北京大学生物医学伦理委员会审核通过。
1.2 主要试剂及仪器
链脲佐菌素,购自西格玛·奥德里奇(上海)贸易有限公司;
柠檬酸-柠檬酸钠缓冲液,购自宝如亿(北京)生物技术有限公司;
盐酸二甲双胍片,购自中美上海施贵宝制药有限公司。血糖试纸及血糖仪,购自三诺生物传感股份有限公司;
AU480全自动生化仪,购自美国贝克曼库尔特有限公司。
1.3 糖脂代谢紊乱大鼠模型建立
大鼠适应性喂养3 d,以高脂饲料喂养30 d后,分2次腹腔注射30 mg/kg BW链脲佐菌素(STZ)(0.01 mol/L pH 4.5柠檬酸钠-柠檬酸缓冲液配制)诱导糖脂代谢紊乱模型,对大鼠进行尾静脉采血以检测血糖水平,待7 d后空腹血糖达到11.1 mmol/L以上并稳定3 d,确定为模型合理。实验期间动物自由进食及饮水,必要时腹腔注射长效胰岛素,以使血糖稳定在25 mmol/L以下,维持实验大鼠的生存。
1.4 动物分组与饲养
建模成功的大鼠按血糖水平随机分为4组,分别为模型对照组、二甲双胍对照组、高、低剂量燕麦麸皮干预组,每组10只,另外10只正常大鼠作为空白对照组。空白组对照组大鼠喂食基础饲料AIN-93M,模型对照组喂食高脂饲料HD001,二甲双胍及高、低剂量燕麦麸皮干预组分别喂食MET和OB添加饲料。连续喂饲6周。动物基础饲料参考美国营养学会推荐的AIN-93M配方。燕麦麸皮购自内蒙古燕谷坊全谷物产业发展有限责任公司,将燕麦麸皮添加入饲料中进行干预 ,确定燕麦麸皮干预剂量分别为15%、30%。保证单位饲料热量不变,燕麦麸皮按相应比例添加到基础饲料中,饲料各组热量分配比如表1。分别于第0、2、4、6周采集大鼠尾静脉血进行血糖测定。实验末大鼠空腹过夜,经CO2麻醉后,股动脉采血后处死全部大鼠,分离大鼠血清并于-20℃储存待血清学指标检测,同时迅速取出脏器,称重,速冻于液氮中,冻透后转入-70℃冰箱中待测。
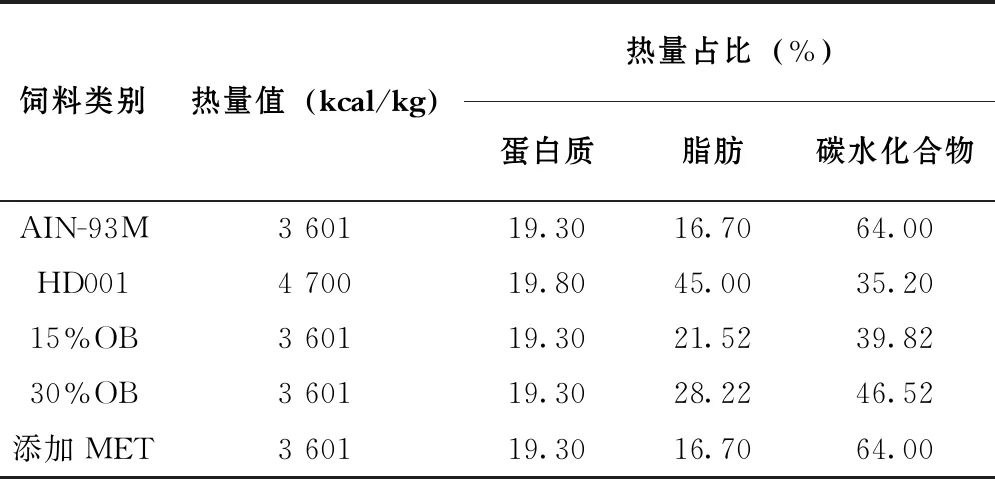
表1 饲料配方
1.5 指标
1.5.1 一般情况观察 实验期间每周观察各组大鼠的一般情况,包括精神状态、毛色、饮水量、尿量、进食量、排便量、体重及日常活动情况等。
1.5.2 血糖指标检测 空腹血糖(FBG):大鼠禁食6 h,尾静脉采血,使用血糖仪测定FBG。血糖曲线下面积(GAUC):血糖仪测定0 h血糖值后,经口给予2.0 g/kg葡萄糖(浓度50%)后,测定0.5、1、2 h血糖值并计算GAUC,计算 GAUC,GAUC=(0 h血糖+0.5 h血糖×2+1 h血糖×3+2 h血糖×2)/4,每2周1次。
1.5.3 血脂指标检测 采用全自动生化分析仪测定血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
1.5.4 脂肪、脏器体重比 称重,计算肾脏/体重、肝脏/体重、内脏脂肪(肾周睾周脂肪)/体重、棕色脂肪/体重。
1.6 统计学分析
使用SPSS 23.0软件进行统计分析,采用均数±标准差描述正态分布数据,通过t检验比较模型对照组与空白对照组的组间差异,采用单因素方差分析ANOVA比较模型对照组与各干预组的差异,以P<0.05表示差异有统计学意义。
2.1 一般状况
实验过程中,空白对照组大鼠精神状态良好,毛发顺滑有光泽,反应敏捷,进食及活动情况未见异常;
模型对照组大鼠精神状态稍差,反应相对迟钝,毛发脏乱,光泽度差,进食未见异常,但活动减少;
二甲双胍干预组大鼠精神状态,反应灵敏度,毛发光泽介于空白和模型对照组之间;
干预组大鼠在干预后上述状况稍有缓解。
2.2 OB对糖脂代谢紊乱大鼠体重的影响
如图1所示,实验开始第0周,空白对照组体重(413.29±9.94)g显著低于模型对照组(451.23±34.84)g(P<0.05),模型对照组与二甲双胍、高、低剂量燕麦麸皮干预组相比,体重没有显著差异(P>0.05);
实验第6周,空白对照组体重(602.18±35.29)g显著高于模型对照组(528.58±41.59)g(P<0.05);
与模型对照组(528.58±41.59)g相比,二甲双胍(375.67±105.91)g、高(434.11±91.33)g、低(371.68±88.44)g剂量燕麦麸皮干预组大鼠体重下降明显(P<0.05)。实验第6周与第0周相比,空白对照组体重明显增加(P<0.05),高、低剂量燕麦麸皮干预组相比,体重明显下降(P<0.05)。
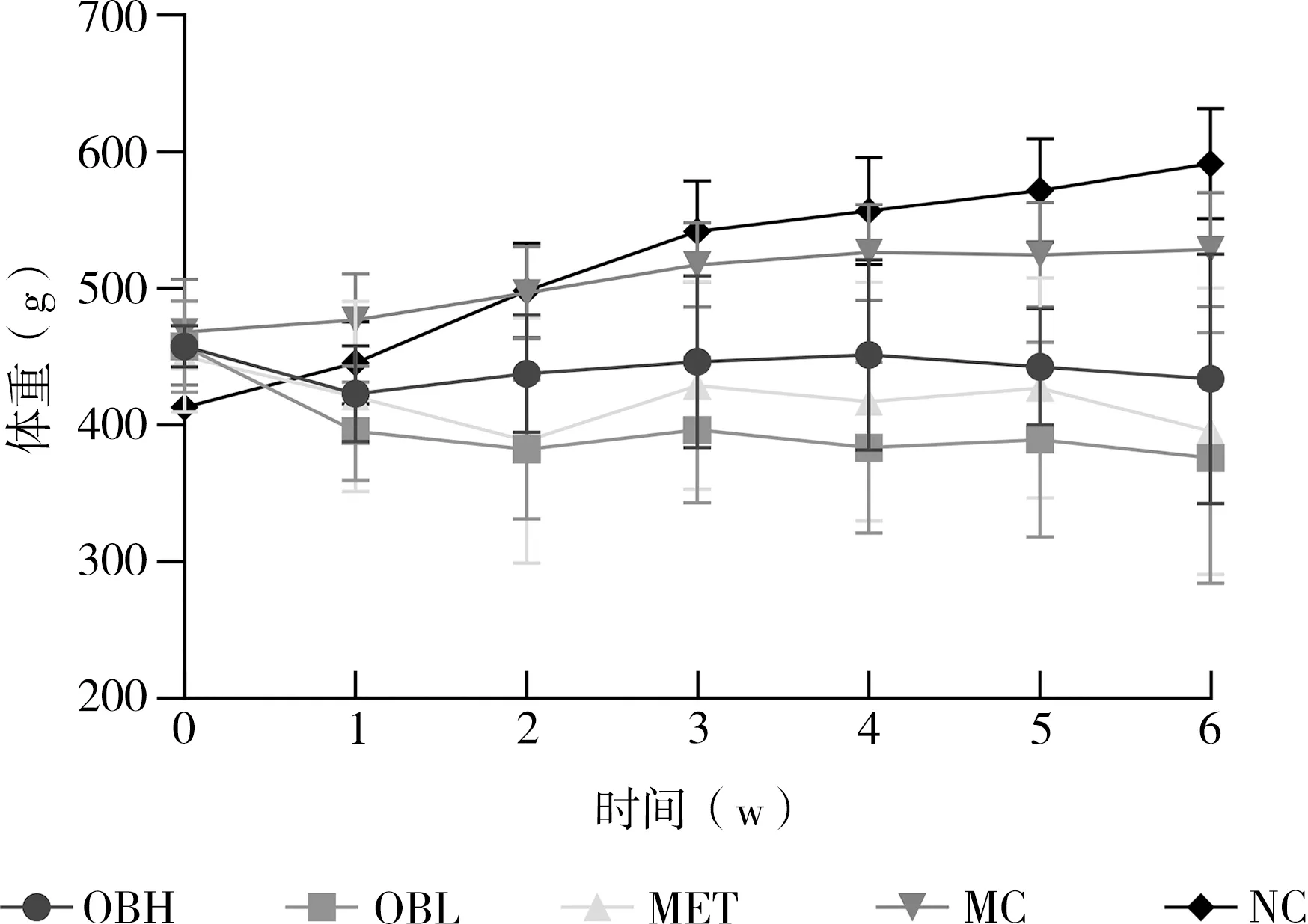
图1 各组大鼠进体重随时间变化
2.3 OB对糖脂代谢紊乱大鼠单位体重进食量的影响
如图2所示,干预第0周,模型对照组的大鼠单位体重每周进食量[(0.488±0.08)g/(kg·kg·w)]显著高于空白对照组[(0.391±0.05)g/(kg·kg·w)](P<0.05),与模型对照组相比,二甲双胍、高、低燕麦麸皮干预组无明显差异(P>0.05)。
第6周,模型对照组[(0.531±0.18)g/(kg·kg·w)]依然显著高于空白对照组[(0.352±0.07)g/(kg·kg·w)](P<0.05)。低剂量燕麦麸皮干预组[(0.488±0.08)g/(kg·kg·w)]显著低于模型对照组(P<0.05)。

图2 各组大鼠进食量随时间变化
2.4 OB对糖脂代谢紊乱大鼠脏器系数和内脏脂肪体重比的影响
实验结束后,与空白对照组相比,模型对照组的内脏体重比显著升高(P<0.05),内脏脂肪、棕色脂肪体重比显著下降(P<0.05)。与模型对照组相比,二甲双胍、高、低剂量燕麦麸皮干预组的肾脏体重比显著升高(P<0.05);
高、低剂量燕麦麸皮干预组的肝脏体重比显著降低(P<0.05);
二甲双胍、高、低剂量燕麦麸皮干预组的内脏脂肪体重比显著降低(P<0.05);
二甲双胍干预组的棕色脂肪体重比显著降低(P<0.05)。与二甲双胍干预组相比较,高、低剂量燕麦麸皮干预组的肝脏体重比、肾周睾周脂肪体重比明显下降(P<0.05);高、低剂量燕麦麸皮干预组的棕色脂肪体重比明显升高(P<0.05)(表2)。
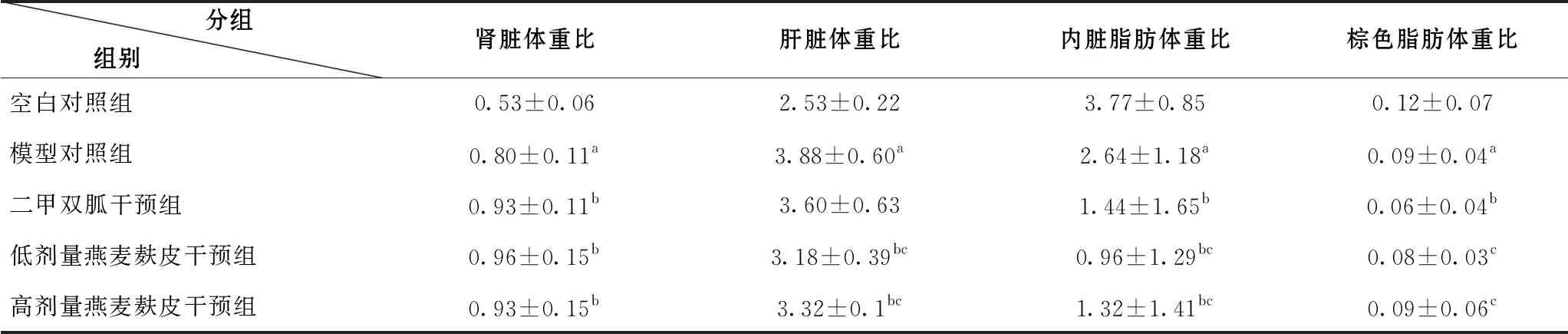
表2 脏器、脂肪体重比(%)
2.5 OB对糖脂代谢紊乱大鼠空腹血糖(FBG)的影响
各组大鼠空腹血糖的变化见图3。实验第0周,空白对照组大鼠空腹血糖(5.28±1.48)mmol/L明显低于模型对照组(18.43±5.40)mmol/L(P<0.05)。与模型对照组大鼠相比,二甲双胍和高、低剂量燕麦麸皮干预组空腹血糖没有显著差异(P>0.05);
实验第6周,与模型对照组大鼠相比,二甲双胍干预组(6.37±1.05)mmol/L显著下降(P<0.05);
而高、低剂量燕麦麸皮干预组差异不显著(P>0.05)。

图3 各组大鼠空腹血糖随时间变化
2.6 OB对糖脂代谢紊乱大鼠GAUC值的影响
如图4所示 ,实验第0周至第6周 ,模型对照组大鼠的GAUC值均显著高于空白对照组(P<0.05);
第6周,二甲双胍GAUC[(36.37±7.41)mmol/(L·h)]值 、低剂量燕麦麸皮干预组大鼠GAUC[(42.48±10.38)mmol/(L·h)]值均具有显著低于模型对照组GAUC[(53.65±8.32)mmol/(L·h)]值(P<0.05);
低剂量燕麦麸皮干预组GAUC值由第0周的[(55.38±6.72)mmol/(L·h)]显著下降到第6周的[(47.21±9.85)mmol/(L·h)](P<0.05)。

图4 各组大鼠GAUC随时间变化
2.7 OB对糖脂代谢紊乱大鼠血脂的影响
与空白对照组相比,模型对照组的甘油三酯和低密度脂蛋白胆固醇显著升高(P<0.05)。
与模型对照组相比,二甲双胍、高、低剂量燕麦干预组的血清总胆固醇显著降低(P<0.05);
二甲双胍、高、低剂量燕麦麸皮干预组的甘油三酯显著降低(P<0.05);
高、低剂量燕麦麸皮干预组的高密度脂蛋白胆固醇显著升高(P<0.05);
二甲双胍、高、低剂量燕麦干预组的低密度脂蛋白胆固醇显著降低(P<0.05)。与二甲双胍干预组相比,高、低剂量燕麦麸皮干预组血清总胆固醇明显下降(P<0.05);
低剂量燕麦麸皮干预组甘油三酯明显下降(P<0.05);
低剂量燕麦麸皮干预组血清低密度脂蛋白胆固醇明显下降(P<0.05)(表3)。

表3 血脂生化指标
糖脂代谢紊乱的患者,因血脂、血糖互相影响从而加重病情的进展,因而相比于单纯的血糖异常和血脂异常发病机理和干预手段更加复杂[12]。本研究利用高脂饮食和链脲佐菌素注射联合手段构建的大鼠模型,链脲佐菌素的作用为诱导DNA分裂和甲基化来抑制DNA合成,导致胰岛β细胞死亡,胰岛素释放的减少,血糖水平升高。本研究中OB显著降低了大鼠的GAUC,但却没有降低大鼠的空腹血糖(FBG),由此推断OB对于模型大鼠的降糖作用主要体现在延缓食物的消化及葡萄糖转运吸收方面。既往有研究显示,燕麦麸皮中的主要功能成分之一的β-葡聚糖是减重作用的主要物质基础,其能使胃排空速率减慢,减少胃肠道消化酶对碳水化合物的水解作用,并且维持饱腹感;
其粘度特性对葡萄糖在小肠上皮细胞的吸收和扩散起到抑制作用,通过下调小肠上皮细胞中的葡萄糖转运蛋白的转运效率,抑制葡萄糖转运过程[13],使得胰岛素释放延迟、平稳[14]。此外,燕麦麸皮中富含的膳食纤维被肠道菌群发酵产生的短链脂肪酸(SCFA)通过与相应的G蛋白偶联受体的偶联作用,促进小肠上皮细胞分泌胰高血糖素样肽(GLP-1)。GLP-1增强了β细胞胰岛素释放,抑制胰高血糖素分泌,保护β细胞免于凋亡的同时促进β细胞增殖并延长肠转运时间[15],从而整体上减少了经由肠道的能量摄入。燕麦麸皮中含有的燕麦生物碱(AVAs)通过调节肠道菌群来减轻氧化应激和炎症从而改变体重[16-17]。本实验所得数据显示,燕麦麸皮能显著降低血浆总胆固醇、甘油三酯、低密度脂蛋白胆固醇的含量,可以升高血浆高密度脂蛋白胆固醇;
实验观察到相比于模型对照组大鼠,OB干预的大鼠整体体重是降低的,单位体重进食量也是降低的,说明OB对于大鼠整体能量摄入水平有抑制作用;
实验也观察到OB干预组大鼠内脏脂肪的含量更低。燕麦麸皮中富含的膳食纤维可以附着到肠道上皮细胞上,增加了肠粘膜的粘性和厚度,延缓了胆固醇和甘油三酯的吸收[18];
也有研究显示,燕麦麸皮中的β-葡聚糖通过上调胆固醇7-α羟化酶,激活胆汁酸合成途径,最终降低血液中的低密度脂蛋白胆固醇水平[19],并能结合肠道内胆汁酸随着粪便排出体外,从而起到降低胆固醇的功效。燕麦麸皮中残存的酚类物质也能够抑制α-淀粉酶、α-葡萄糖苷酶活性,残存的极性脂质也能降低餐后甘油三酯和游离脂肪酸的生成[20]。
OB没有燕麦片的高热量,却聚集了它的各种营养成分。其中含有丰富的钙、磷、铁、锌、锰、铬等矿物质和微量元素,丰富的维生素B1、B2、维生素E及叶酸、多酚类物质等;
富含燕麦β-葡聚糖等水溶性膳食纤维和不溶性膳食纤维,其血糖生成指数为55,属于低GI食物[21]。作为燕麦食品加工中的副产品,OB产量巨大,但目前绝大部分仅用于饲料加工。本实验在动物实验的基础上证明了其控制体重、能量摄入,降糖、降脂方面的功效,加之其安全性和性价比高等特点,具有良好的进一步开发价值。





