【www.zhangdahai.com--其他范文】
王园,王晶,李淑霞
(宁夏大学农学院,宁夏 银川 750021)
紫花苜蓿(Medicago sativa)是豆科苜蓿属多年生牧草,其产量高、营养价值丰富、适口性好,再生能力强,因优异的饲用价值而在世界各地广泛栽培,享有“牧草之王”的美誉[1]。而我国紫花苜蓿的生产和种植多受到土壤盐渍化的影响,造成单位面积产量低和干草品质差等问题,同时苜蓿进口量也呈逐年上升趋势,严重制约了我国苜蓿的产业化发展[2]。因此,利用生物学技术研究抗逆基因对紫花苜蓿的调控作用,对加快紫花苜蓿抗逆育种的进程具有重大意义。
BBX(B-box)是锌指结构蛋白家族的一个亚族,含有一个或多个由Zn2+结合的三级结构域,根据结构域不同可划分为5 个亚家族,其结构稳定,氨基酸序列中包含1 或2 个参与蛋白质-蛋白质互作的B-box 基序[3]。含Bbox 结构域的蛋白广泛存在于真核生物中,并在多种细胞过程如泛素化、蛋白运输以及转录调控等方面发挥着重要作用,研究报道,BBX 蛋白可与启动子顺式作用元件T/G-box 结合,从而激活基因的转录[4-5]。BBX 在调控植物的生长发育如光形态建成、花发育和避荫响应中已有较多的研究。在植物中,拟南芥(Arabidopsis thaliana)含有32 个B-box 蛋白,水稻(Oryza sativa)含有30 个BBX 蛋白[6]。转录因子广泛参与生物的生长、发育、代谢以及环境响应的调控过程,是重要的调控因子。最近的研究表明,BBX 作为转录因子参与调节各种细胞和生理过程,包括植物的生长发育及多种非生物胁迫等[7-8]。大豆(Glycine max)BBX 家族多数基因参与干旱和盐胁迫响应,同时发现GmBBXs启动子上含有逆境响应元件TC-rich 和干旱诱导MYB 转录因子结合位点MBS,从而能够调控逆境胁迫[9];
在菊花(Chrysanthemum morifolium)中发现过表达CmBBX19基因会降低植株的抗旱能力,而抑制该基因的表达能够提高植物抗旱性[10];
茶树(Camellia sinensis)CsBBX少数基因在干旱和盐胁迫条件下可被诱导表达,提高植物耐胁迫能力[11];
香蕉(Musa nana)MaBBX基因可能参与低温响应过程,大部分成员都能响应低温胁迫,在不同低温下表达量上调,进而提高植物抗寒性[12]。BBX 在调控植物非生物胁迫响应中的研究相对较少,关于其成员参与紫花苜蓿抗逆性的研究也尚未见报道,因此有必要充分利用现有的信息,对紫花苜蓿BBX 家族基因进行克隆和抗逆性研究。
本研究以紫花苜蓿为试验材料,从转录组数据中筛选到显著响应盐胁迫的MsBBX24基因,通过对MsBBX24基因克隆、生物信息学分析、基因表达模式分析、过表达载体构建以及转基因拟南芥的获得,对其耐盐性进行初步评估。本试验旨在为后续深入研究MsBBX24基因的功能提供帮助,为紫花苜蓿抗逆分子育种提供理论依据和基因资源参考。
1.1 试验材料
本试验于2020年10 月-2021年10 月进行。试验所用的植物材料紫花苜蓿和拟南芥(Col-0)由实验室保存。植物材料种植于植物培养间,培养条件为:温度25 ℃,湿度60%~70%,光照/黑暗周期16 h/8 h,光照强度160 μmol·m-2·s-1。RNA 提 取试剂盒(MiniBEST Plant RNA Extraction Kit)、反 转录试剂 盒(PrimeScript™Ⅱ1st Strand cDNA Synthesis Kit)、大肠杆菌DH5α 感受态细胞、StellarTM 感受态细胞、pMD19-T vector、限制性内切酶EcoR I、T4 DNA 连接酶、高保真酶PrimeSTAR®HS DNA Polymerase 试剂盒等均购自大连宝生物工程有限公司(TaKaRa);
荧光定量试剂盒(ChamQ SYBR qPCR Master Mix)和重组酶试剂盒(ClonExpress II One Step Cloning Kit)均购自南京诺唯赞生物公司;
质粒提取试剂盒和DNA 凝胶回收试剂盒均购自生工生物工程(上海)股份有限公司。
1.2 试验方法
1.2.1 紫花苜蓿MsBBX24基因的克隆及生物信息学分析 根据实验室之前紫花苜蓿耐盐转录组数据,筛选出显著响应盐胁迫的MsBBX24基因,利用Primer Premier 5 软件设计MsBBX24基因全长扩增引物MsBBX24-F/R(表1)。根据RNA 试剂盒操作说明提取紫花苜蓿总RNA,并反转录成cDNA。以cDNA 为模板进行MsBBX24基因的CDS 序列扩增,反应体系:20 μL,cDNA 1 μL、引物各1 μL、2×Taq Master Mix 10 μL、双蒸水7 μL;
反应程序:95 ℃5 min,95 ℃15 s,58 ℃15 s,72 ℃1 min(35 个循环),72 ℃5 min。将扩增产物进行电泳检测后克隆到pMD-19T 载体上,通过菌液PCR 检测,将阳性克隆送至上海生工生物公司进行测序。

表1 本试验所用引物Table 1 Primers used in this experiment
利用NCBI(https://www.ncbi.nlm.nih.gov)对MsBBX24基因的核酸序列、氨基酸序列以及对应蛋白质的理化性质进行预测分析。使用在线软件SOPMA(https://npsa-prabi. ibcp. fr/cgi-bin/npsa_automat. pl?page=npsa_sopma. html)对氨基酸的二级结构和亲水性/疏水性进行预测分析。使用TMHMM Server 2.0 软件(http://www. cbs. dtu. dk/services/TMHMM)对蛋白质的跨膜结构域进行预测分析。通过DNAMAN 软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对紫花苜蓿MsBBX24 的氨基酸序列进行比对。使用MEGA 6 软件(https://www.megasoftware.net/)进行MsBBX24 蛋白进化树的构建。
1.2.2MsBBX24基因在紫花苜蓿中的表达分析 将保定苜蓿种子用5%的次氯酸钠溶液消毒5 min,用蒸馏水冲洗数次后置于铺有两层湿滤纸的培养皿中,放于培养间发芽。萌发4~5 d 后将幼苗移至水培盆中,用改良后的霍格兰营养液培养。培养至一个月左右时,挑选生长状况良好、大小一致的植株进行150 mmol·L-1NaCl 处理,分别于0、2、4、8 和12 h 采取根部和叶片样品,并将采集的样品放入-80 ℃冰箱保存备用。根据RNA 试剂盒操作说明提取各样品总RNA,并反转录成cDNA,方法同1.2.1。利用Primer Premier 5 软件设计MsBBX24基因定量引物qMsBBX24-F/R,以紫花苜蓿MsActin-F/R 为内参基因引物,进行实时荧光定量PCR(qRT-PCR)。反应体系为:20 μL,2×ChamQ SYBR qPCR Master Mix 10 μL、引物各0.4 μL、cDNA 3 μL,双蒸水6.2 μL。反应程序:第1 步:95 ℃预变性30 s;
第2 步:95 ℃循环10 s、60 ℃循环30 s;
第3 步:熔解:95 ℃15 s、60 ℃60 s、95 ℃15 s。根据得到的Ct 循环阈值,用2-△△CT方法[13]计算MsBBX24基因的组织特异性表达;
再分别以根和叶在0 h 表达量为对照,2、4、8 和12 h 为处理,计算NaCl 处理条件下根和叶的相对表达量,计算方法如下:ΔΔCT=(CT目的基因-CT内参基因)NaCl处理-(CT目的基因-CT内参基因)对照,试验设置3 个生物学重复和3 个技术重复。
1.2.3MsBBX24基因过表达载体构建及转基因拟南芥获得 以紫花苜蓿cDNA 为模板,以含有EcoR I 酶切位点和部分载体接头序列的cMsBBX24-F/R 为引物,用高保真酶扩增MsBBX24基因全长。用限制性内切酶EcoR I 酶切pCAMBIA1300 载体,用T4 DNA 连接酶将MsBBX24基因片段和酶切好的pCAMBIA1300 载体连接,并转化至大肠杆菌DH5α 中,测序正确后提取质粒,即为pCAMBIA1300-MsBBX24 重组质粒。将重组质粒通过电转化法转入至农杆菌菌株GV3101 中,通过蘸花法[14]将其转入野生型拟南芥。
收获侵染后的拟南芥T0代种子,播种于蛭石中并用50 mmol·L-1的Basta 喷洒筛选,经过连续两代的阳性苗筛选获得纯合的T2代种子,将该种子用作后续试验。培养纯合植株提取RNA 并反转录为cDNA,以MsBBX24-F/R 为特异性引物,以AtActinF/R 为内参基因引物,通过半定量RT-PCR 技术检测转基因拟南芥中MsBBX24的表达情况。
1.2.4MsBBX24转基因拟南芥耐盐性分析 将野生型拟南芥Col-0 和收获的T2代转基因种子用75%的酒精消毒5 min,然后在超净工作台中用无菌水冲洗4~5 遍,均匀地点播于1/2 MS 固体培养基(MS 粉2.37 g·L-1,蔗糖10 g·L-1,琼脂粉9 g·L-1,pH=5.8)上,置于4 ℃冰箱中春化,2 d 后将其移至正常生长条件下进行培养。生长4~5 d 后,挑选长势一致的幼苗将其转移至含有0、100 和150 mmol·L-1NaCl 的1/2 MS 固体培养基上。在移苗时将野生型(对照)和转基因幼苗移至同一种处理的培养基上以避免不同平板之间的差异,然后将平板竖直放在培养架上,培养7 d 后拍照并统计根长、侧根数和子叶绿化率,每个重复5 株。
为了进一步确定MsBBX24基因对拟南芥成苗耐盐性的影响,本试验对生长3 周的拟南芥植株进行150 mmol·L-1NaCl 溶液处理,并于10 d 后测定如下指标:参照Dahro 等[15]的方法测定相对电导率(ion leakage,IL),采用硫代巴比妥酸比色法[16]测定丙二醛(malondialdehyde,MDA)含量,95% 无水乙醇浸提法[17]测定叶绿素(chlorophyll,Chl)含量,对Jiang 等[18]的方法做修改测定过氧化氢(hydrogen peroxide,H2O2)含量,分光光度计法[19]测定脯氨酸(proline,Pro)含量,愈创木酚法[20]测定过氧化物酶(peroxidase,POD)活性,氮蓝四唑光还原法[21]测定超氧化物歧化酶(superoxide dismutase,SOD)活性。
1.3 数据统计与分析
使用Excel 2016 和SPSS 25.0 进行数据统计与分析,采用T检验,*表示P<0.05,**表示P<0.01。使用Origin 2021 作图。所有试验均设置3 个生物学重复和3 个技术重复,试验数据为3 次生物学重复的平均值。
2.1 紫花苜蓿MsBBX24 基因的克隆及生物信息学分析
通过PCR 扩增从紫花苜蓿中克隆得到了MsBBX24基因,编码区序列长723 bp,编码240 个氨基酸(图1)。基因编码的蛋白质理化性质预测分析发现,MsBBX24 蛋白的相对分子质量为30.58 kDa,理论等电点(theoretical isoelectric point,pI)为7.74,预测的不稳定系数为47.91,稳定系数大于40,属于不稳定蛋白。MsBBX24 蛋白的亲水性预测值为-0.301,因此属于亲水性蛋白(图2A)。跨膜结构域预测结果显示该蛋白没有跨膜结构域(图2B)。二级结构预测结果显示MsBBX24 蛋白包含22.5%的α-螺旋、16.25%的延伸链、2.08%的β-转角和59.17%的不规则卷曲(图2C)。

图1 MsBBX24 基因的核苷酸序列及其编码的氨基酸序列Fig.1 Nucleotide and predicted amino acid sequences of MsBBX24 geneATG:起始密码子;
*:终止密码子;
横线标记:保守区域。ATG:Initiation codon;
*:Temination codon;
Horizontal line mark:Conserved domains.

图2 MsBBX24 蛋白生物信息学分析Fig.2 Bioinformatics analysis of MsBBX24 proteinA:MsBBX24 蛋白质亲水性分析;
B:MsBBX24 蛋白跨膜结构域预测;
C:MsBBX24 蛋白二级结构预测(图中线条由高到低依次表示:α-螺旋、延伸链、β-转角、不规则卷曲)。A:Hydrophilicity analysis of MsBBX24 protein;
B:Transmembrane structure prediction of MsBBX24 protein;
C:Secondary structure prediction of MsBBX24 protein(The lines in the figure were alpha helix,extended strand,beta turn and random coil in descending order).
蛋白质多序列比对分析发现MsBBX24 蛋白包含两个B-box 保守结构域(5~47 和53~98),与其他植物的BBXs(B-box zinc finger genes)蛋白具有高度的同源性,其中与蒺藜苜蓿(Medicago truncatula)、刺毛黧豆(Mucuna pruriens)、大豆和红豆(Abrus precatorius)的相似性分别达到了97%、82%、81%和80%(图3)。进化树结果分析表明MsBBX24 与鹰嘴豆(Cicer arietinum)和蒺藜苜蓿的亲缘关系较近,与其他豆科植物的亲缘关系较远(图4)。

图3 MsBBX24 氨基酸多序列比对Fig.3 Multiple sequence alignment of MsBBX24 amino acids
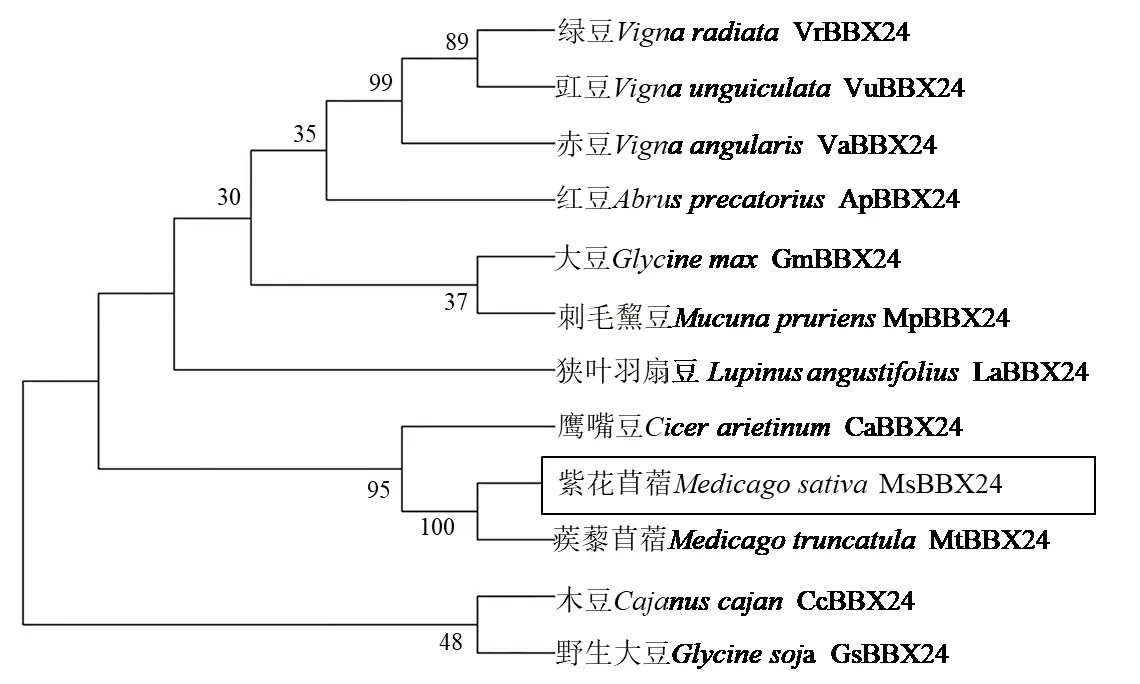
图4 MsBBX24 蛋白进化树构建Fig.4 Phylogenetic tree analysis of MsBBX24 protein
2.2 MsBBX24 基因的表达模式分析
以紫花苜蓿根和叶组织的cDNA 为模板,利用qRT-PCR 技术分析MsBBX24基因在正常条件和盐(150 mmol·L-1NaCl)胁迫条件下的相对表达量变化,150 mmol·L-1NaCl 胁迫下MsBBX24基因的表达量分别以正常条件下根和叶的表达量为一个单位作对照进行统计。结果显示,正常条件下,MsBBX24基因在叶中的表达量显著高于根的(P<0.01),为根的24.56 倍(图5A);
在12 h 的胁迫时间内,随着胁迫时间的延长,MsBBX24基因在根和叶的表达量均呈先上升再下降的趋势,在4 h 时根和叶片组织中的表达量都达到最大值,其中根中的表达量为对照的17.65 倍,叶中为对照的4.33 倍,根的表达量显著高于叶的表达量(P<0.05 或P<0.01);
在12 h 时,叶片中的表达量下降为对照的1.73 倍,根中下降为0.69 倍(图5B)。

图5 MsBBX24 基因的表达量分析Fig.5 Analysis of MsBBX24 gene relative expression levelA:组织特异性表达,**表示根和叶表达量差异极显著(P<0.01);
B:150 mmol·L-1 NaCl 处理下根和叶的表达量,*和**分别表示同一组织中不同处理时间的表达量与0 h 相比差异显著(P<0.05)和差异极显著(P<0.01)。A:Tissue-specific expression,** indicated that significant differences in root and leaf expression(P<0.01);
B:Relative expression level of roots and leaves under 150 mmol·L-1 NaCl treatment;
* and ** respectively indicated the difference between different time in same organization and 0 h is significant(P<0.05)and extremely significant(P<0.01).
2.3 MsBBX24 转基因拟南芥阳性苗鉴定
通过拟南芥蘸花法将含有MsBBX24基因的农杆菌(GV3101)转入野生型拟南芥(WT)中,通过Basta(50 mg·L-1)逐代筛选得到T2代纯合种子,共筛选得到25 个纯合株系。从中随机挑选2 个转基因株系(L8,L13)进行阳性鉴定。通过半定量RT-PCR 技术检测转基因拟南芥中MsBBX24的表达情况(图6),在WT中没有MsBBX24基因的表达,转基因株L8和L13中都有目的基因表达的条带,说明MsBBX24基因在拟南芥中成功过表达,可用作后续试验。

图6 转基因拟南芥阳性苗验证Fig.6 Validation of transgenic Arabidopsis positive seedlings
2.4 MsBBX24 转基因拟南芥耐盐性分析
2.4.1MsBBX24转基因拟南芥幼苗耐盐性分析 为了检测MsBBX24基因对拟南芥幼苗的影响,将在1/2 MS 培养基上生长了5 d 的幼苗转移至含有0、100 和150 mmol·L-1NaCl 的1/2 MS 固体培养基上进行处理,每天观察不同株系之间的表型差异。如图7 所示,在0 mmol·L-1NaCl 条件下,转基因株系L8和L13和WT 幼苗植株之间没有差异,而在100 和150 mmol·L-1NaCl 处理条件下,L8和L13的幼苗根长显著长于WT(P<0.05 或P<0.01)(图7A,B),侧根数也显著多于WT(P<0.05 或P<0.01)(图7C),说明MsBBX24基因受盐胁迫诱导表达。同时在150 mmol·L-1NaCl 处理条件下,L8和L13的子叶绿化率显著高于WT(P<0.05 或P<0.01)(图7D)。以上结果表明:MsBBX24基因的过表达能够提高拟南芥的耐盐性。

图7 WT 和转MsBBX24 基因拟南芥的幼苗耐盐性分析Fig.7 Salt tolerance analysis of WT and MsBBX24 transgenic Arabidopsis seedlings*和**分别表示转基因拟南芥植株与野生型相比差异显著(P<0.05)和差异极显著(P<0.01),下同。* and ** respectively indicated the transgenic Arabidopsis plants showed significant difference(P<0.05)and extremely significant difference(P<0.01)compared with wild type,the same below.
2.4.2MsBBX24转基因拟南芥耐盐生理指标分析 为了进一步确定MsBBX24基因对拟南芥成苗耐盐性的影响,本研究将生长3 周的WT 和转基因植株用150 mmol·L-1NaCl 溶液处理,10 d 后对IL、MDA、H2O2、Chl 和Pro 含量以及POD 和SOD 活性等生理指标进行测定。结果表明,在正常生长条件下,WT 和MsBBX24转基因植物的IL 无显著差异,经盐胁迫处理后,两种植物中的IL 都明显升高,但转基因植物的显著低于WT(P<0.05 或P<0.01)(图8A),表明在盐胁迫下,转基因拟南芥能减少植物质膜受损程度。类似地,在盐胁迫处理条件下,MsBBX24转基因植物中的MDA 和H2O2含量显著低于WT(P<0.05 或P<0.01)(图8B,C)。同时通过测定Chl、Pro 含量和抗氧化酶活性发现,在正常生长条件下,转基因植物和WT 的各指标间均无显著差异,但在盐胁迫条件下,转基因株系的Chl 和Pro 含量、POD 和SOD 活性都显著高于WT(P<0.05 或P<0.01)(图8D~G)。以上结果说明转基因株系植株的细胞质膜受损程度更低,光合作用和渗透调节能力更强,同时抗氧化能力高于WT。

图8 150 mmol·L-1 NaCl 胁迫下WT 和MsBBX24 转基因拟南芥生理响应Fig.8 Physiological response of WT and MsBBX24 transgenic Arabidopsis under 150 mmol·L-1 NaCl stress
Box 蛋白家族广泛存在于真核生物中,家族成员数量庞大,在植物色素积累、光形态发生、种子发育及逆境胁迫反应等过程中具有重要的调节作用。盐胁迫对植物生长、发育、产量和品质均有影响,表现为抑制植物组织和器官的生长和分化,导致发育迟缓[22]。
本研究克隆得到的MsBBX24基因,其编码区序列长723 bp,编码240 个氨基酸,包含两个B-box 保守结构域。预测其属于不稳定亲水性蛋白,无跨膜结构域,二级结构的主要构成元件是α-螺旋。氨基酸序列比对和系统进化树中MsBBX24 与鹰嘴豆和蒺藜苜蓿的同源性较高,表明该蛋白在进化上的保守性。
本研究发现,在盐(150 mmol·L-1NaCl)胁迫条件下的12 h 内,MsBBX24基因在紫花苜蓿根和叶的表达量呈现先增加后减少的趋势,与之前窦锦青等[23]报道的光皮桦(Betula luminifera)的BBX 类基因BlCOL13表达情况一致,同时刘欣[24]发现苹果(Malus domestica)MdBBX10基因在盐胁迫下表达量上调,本研究结果与此一致。此外,杨宁等[25]发现EgrBBX 家族不同基因具有不同的组织表达特异性,其中巨桉(Eucalyptus grandis)EgrBBX7基因叶的表达量也是大于根的,本研究结果与此一致。MsBBX24基因受盐胁迫的显著诱导表达,且在根和叶不同组织具有表达特异性,推测该基因在响应盐胁迫时在不同组织发挥的功能也可能存在差异。此外,本研究发现MsBBX24基因的过表达显著提高了转基因拟南芥幼苗在盐胁迫下的根长、侧根数和子叶绿化率。结合本研究中MsBBX24的蛋白结构、被盐胁迫诱导表达及对盐胁迫下转基因拟南芥表型的改善,推测MsBBX24可能具有提高植物耐盐性的功能。
IL 是逆境伤害的一个生理指标,植物遭受逆境伤害时细胞膜会受损,表现为选择透性丧失、膜透性增加和细胞内部分电解质外渗[26]。MDA 是一种脂质过氧化产物,研究表明其在植物中的积累量与细胞膜的透性变化呈正相关,作为细胞膜的受损程度的指标[27-28]。研究结果显示,MsBBX24基因的过表达能够降低盐胁迫下拟南芥的IL 和MDA,说明MsBBX24转基因植株受到的膜脂过氧化损伤程度更低,该结果表明MsBBX24可以通过降低细胞膜损伤和膜脂过氧化来缓解盐胁迫。Chl 是一类与光合作用有关的重要色素,常作为评价植物光合作用能力的一个重要指标[29],其含量的多少反映了植物光合能力的强弱。研究表明,盐胁迫能够损伤植物细胞内的叶绿体,进而降低植物光合作用能力[30]。本研究结果表明盐胁迫下转基因拟南芥Chl 含量高于WT,说明转基因拟南芥的光合能力更强,推测转基因植株可能是通过提高光合作用能力来改善耐盐性。逆境胁迫时的Pro 是公认的渗透调节剂[31]。逆境时,植物体内的游离氨基酸含量会明显增加,通过平衡细胞代谢以维持细胞内环境的相对稳定[32]。本研究发现,在盐胁迫下MsBBX24转基因拟南芥中Pro 积累量明显高于WT,说明MsBBX24过表达增强了拟南芥转基因植株的渗透调节能力,维持了渗透平衡,提高了耐盐性。植物处于逆境时产生的活性氧(reactive oxygen species,ROS)伤害会被SOD、POD 和过氧化氢酶(catalase,CAT)组成的抗氧化酶系统消除和抵御,减少膜脂过氧化,在一定范围内维持膜稳定,增强其清除超氧阴离子自由基(O2·-)和H2O2的能力,能够保护膜结构从而维持细胞正常的生理功能[33-34]。Liu 等[35]研究发现拟南芥MdBBX10的过表达可以增强植物在盐胁迫下清除ROS 的能力,在本研究中,盐胁迫下MsBBX24转基因植株中H2O2的含量明显降低,对应地,SOD 和POD 的活性显著升高,由此猜测可能是转基因植株通过增强抗氧化酶系统来清除盐胁迫下植物体内增加的ROS,减轻盐胁迫对植株造成的伤害,从而使转基因植株具有更高的耐盐性。
本研究克隆了保定苜蓿的MsBBX24基因,发现其与蒺藜苜蓿的亲缘关系最近,是不稳定亲水性蛋白,属于BBXs 家族的成员。该基因能够显著响应盐胁迫,并具有组织表达特异性。MsBBX24基因的过表达显著提高了转基因拟南芥幼苗的根长、侧根数和子叶绿化率,同时降低了转基因拟南芥的IL、MDA 和H2O2含量,提高了Chl和Pro 含量以及POD 和SOD 活性,表明MsBBX24基因具有调控植物耐盐性的功能。因此,MsBBX24可作为紫花苜蓿耐盐育种的候选基因,为苜蓿耐盐品种的选育奠定了基础。
猜你喜欢耐盐性拟南芥结构域富天冬酰胺蛋白增强拟南芥辐射抗性的研究国际放射医学核医学杂志(2020年4期)2020-07-27郁金香耐盐性鉴定方法研究河南农业科学(2020年2期)2020-03-11蛋白质结构域划分方法及在线服务综述广州大学学报(自然科学版)(2019年1期)2019-05-07尿黑酸对拟南芥酪氨酸降解缺陷突变体sscd1的影响生命科学研究(2018年1期)2018-05-29两种LED光源作为拟南芥生长光源的应用探究上海农业学报(2017年3期)2017-04-10源于大麦小孢子突变体的苗期耐盐性研究上海农业学报(2016年2期)2016-10-27三个大豆品种萌发期和苗期的耐盐性比较浙江农业学报(2016年7期)2016-06-15重组绿豆BBI(6-33)结构域的抗肿瘤作用分析天津科技大学学报(2016年1期)2016-02-28组蛋白甲基化酶Set2片段调控SET结构域催化活性的探讨湖北师范大学学报(自然科学版)(2015年2期)2016-01-10泛素结合结构域与泛素化信号的识别现代检验医学杂志(2015年2期)2015-02-06本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0917/655599.html




