【www.zhangdahai.com--其他范文】
周慧敏,陈 静,王御林,欧诒丹,钟纯正
海南医学院附属儋州市人民医院神经内科,海南儋州 571700
阿尔茨海默病(AD)是以精神行为异常、认知功能障碍、社会生活功能减退等为主要临床特征的神经退行性疾病,是老年人群失能的重要原因之一[1]。目前AD的致病机制尚未阐明,近年来越来越多证据表明,异常血管生成和抗血管生成过程的破坏参与了AD的发生、发展过程[2-3]。血管抑制素(Ang)是一种血管抑制因子,能通过抑制内皮细胞增殖发挥抗血管生成作用[4]。近期的一项大规模血浆蛋白质组学分析显示,Ang与痴呆风险相关[5]。组织金属蛋白酶抑制剂3(TIMP3)是一种基质金属蛋白酶(MMP)抑制剂,能通过与血管内皮生长因子受体(VEGF)相互作用参与血管生成过程[6]。有研究报道,VEGF1、VEGF2参与AD患者血管生成过程[7]。目前关于Ang、TIMP3与AD生物标志物间的关系和对AD的诊断价值研究较少,本研究对此进行了研究,以期为临床防治AD提供参考依据。
1.1一般资料 将2020年1月至2022年5月本院收治的143例AD患者纳入研究作为AD组,男78例、女65例,年龄51~86岁、平均(67.56±6.87)岁,体质量指数19.3~28.6、平均(23.87±1.88)kg/m2,文化程度:高中及以上68例、初中及以下75例。纳入标准:(1)符合《阿尔茨海默病诊治指南》诊断标准[8];
(2)初诊,入院前未接受AD相关治疗;
(3)患者或家属知情并签署同意书。排除标准:(1)合并帕金森病、精神分裂症、人格障碍等其他精神疾病;
(2)年龄<18岁;
(3)有严重躯体疾病;
(4)有颅脑外伤、脑血管疾病等脑部损伤导致的认知功能损害;
(5)合并心、肝、肾等重要器官损害或免疫、造血系统损害;
(6)有攻击行为或自杀倾向;
(7)近3个月内有急慢性感染。另外,选取同期55例体检健康者作为对照组,男30例、女25例;
年龄42~87岁、平均(65.74±5.36)岁;
体质量指数20.6~27.4 kg/m2、平均(23.18±1.75)kg/m2,文化程度:高中及以上28例、初中及以下27例。两组一般资料比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准。
1.2方法
1.2.1血清指标检测 收集受试者就诊或体检时空腹静脉血6 mL,3 000 r/min离心15 min(半径10 cm),取上层血清作为检测标本,采用酶联免疫吸附法(ELISA)检测β-淀粉样蛋白(Aβ)1-40、Aβ1-42、总Tau(t-Tau)、磷酸化Tau181(p-Tau181)、Ang、TIMP3水平,检测步骤严格按照试剂盒说明书进行操作。检测试剂盒均购自上海酶研生物科技有限公司。
1.2.2认知功能评估 对纳入研究者采用FOLSTEIN等[9]编制的简易精神状态检查表(MMSE)评估认知功能,包括6个维度共30个条目,分值为0~30分,得分越高认知功能越好。
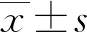
2.1两组血清Aβ1-40、Aβ1-42、t-Tau、p-Tau181、Ang、TIMP3水平及MMSE评分比较 AD组血清Aβ1-40、t-Tau、p-Tau181水平及MMSE评分均高于对照组(P<0.05),血清Aβ1-42、Ang、TIMP3水平均低于对照组(P<0.05)。见表1。

表1 两组血清Aβ1-40、Aβ1-42、t-Tau、p-Tau181、Ang、TIMP3水平及MMSE评分比较
2.2AD患者血清Ang、TIMP3水平与Aβ1-40、Aβ1-42、t-Tau、p-Tau181水平及MMSE评分的相关性 Pearson/Spearman相关分析显示:AD患者血清Ang、TIMP3水平与Aβ1-40水平(r=-0.446、-0.465,P<0.05)及MMSE评分(r=-0.558、-0.607,P<0.05)均呈负相关,与Aβ1-42水平呈正相关(r=0.443、0.437,P<0.05);
血清Ang、TIMP3水平与t-Tau、p-Tau181水平无明显相关性(P>0.05)。见表2。

表2 AD患者血清Ang、TIMP3水平与Aβ1-40、Aβ1-42、t-Tau、p-Tau181水平和MMSE评分的相关性
2.3血清Ang、TIMP3水平对AD的诊断价值分析 ROC曲线分析显示:血清Ang、TIMP3水平单项及联合用于AD诊断的AUC分别为0.798、0.793、0.901,血清Ang、TIMP3水平联合用于AD诊断的AUC大于二者单项用于AD诊断(Z=3.715、3.757,均P<0.05)。见表3、图1。

图1 血清Ang、TIMP3水平单项及联合用于AD诊断的ROC曲线

表3 血清Ang、TIMP3水平单项及联合用于AD诊断的价值
AD是痴呆最常见的病因,2015—2018年的统计数据显示,我国≥60岁人群中痴呆患者约有1 500万例,其中AD患者983万例[10],预计到2050年我国AD患者将增加至2100万例,每年治疗费用将增加至3 320亿元人民币,将给社会和经济带来压力[11]。随着石杉碱甲、多奈哌齐等胆碱酯酶抑制剂单药或联合美金刚等谷氨酸受体拮抗剂的应用,AD患者临床症状得以改善,但由于AD发病机制尚未阐明,现有的药物临床获益有限,尚不能有效阻止或延缓AD的药物[12]。因此,探讨AD的发生、发展机制是目前研究的热点。
目前的研究认为,Aβ错误折叠于大脑中沉积形成的淀粉样蛋白斑块(老年斑)和过度磷酸化Tau蛋白导致的神经纤维纠缠是AD的两大病理特点[2]。Aβ1-40、Aβ1-42是人体内Aβ最常见的两个亚型,AD患者Aβ1-40降低和Aβ1-42升高反映脑内淀粉样蛋白沉积[13]。p-Tau181是Tau蛋白的磷酸化形式之一,t-Tau反映血液中Tau蛋白聚集情况,AD患者血清t-Tau、p-Tau181水平升高反映Tau蛋白过度磷酸化[14]。本研究中,AD组血清Aβ1-40、t-Tau、p-Tau181水平高于对照组,Aβ1-42水平低于对照组,符合AD患者的病理特征。有研究发现,血管生成障碍可能是AD发生的重要环节,脑血管生成对大脑功能至关重要,异常血管生成和抗血管生成过程的破坏会降低大脑血管对老年斑等有毒物质的清除能力,并使更多有毒物质积累,导致大脑血管持续破坏,促进AD发生、发展[2-3]。Ang是一种从纤溶酶原裂解而来的内源性血管生成抑制剂,可通过负反馈稳态过程阻断新血管的生长,因此Ang被认为是限制血管生成的稳态机制[15]。在大鼠AD模型中,注射Ang能减少小胶质细胞增多症和增加神经元活力[16],体育锻炼能通过调节Ang水平改善AD大鼠模型的认知障碍[17],但血液中Ang与AD的关系尚不明确。本研究结果显示,AD患者血清Ang水平明显降低,并与Aβ1-40水平呈负相关,与Aβ1-42水平呈正相关,这提示AD患者血清Ang水平降低可能与脑内Aβ沉积有关。分析原因:Ang作为抑制血管生成的重要因子,其表达降低可导致AD患者脑内血管生成和血管抑制间平衡破坏,导致对Aβ沉积等有毒物质清除能力减弱,进而参与AD发生。最近一项研究也表明,抗血管生成的抗癌药物阿西替尼能靶向促血管生成途径,抑制AD小鼠脑血管生成并维持血脑屏障完整性,改善AD小鼠脑内Aβ沉积[18]。Tau蛋白过度磷酸化导致的AD患者神经纤维纠缠发生于微管系统[14]。而Ang直接作用于脑血管,这也解释了AD患者血清Ang水平与t-Tau、p-Tau181水平无明显相关性的原因。
MMP是一组含有Zn2+的蛋白水解酶,几乎能降解细胞外基质中的各种成分,在组织生长、创伤修复、免疫应答等过程中发挥作用[19]。有研究认为,MMP可能在神经系统中发挥重要作用,MMP2、MMP3、MMP9、MMP13可能参与AD病理生理过程[20]。TIMP3作为MMP的天然抑制剂,能与单个MMP形成阻断MMP活性位点的复合物,抑制MMP介导的蛋白水解,但其否能通过抑制MMP活性参与AD的发生、发展过程还有待探讨。VEGF是血管内皮细胞的特异性有丝分裂原,能结合血管内皮生长因子启动信号级联,刺激血管生成[21]。TIMP3与VEGF和VEGF2相互作用时能抑制二者介导的促血管生成效应[22]。既往研究表明,VEGF2参与AD患者血管生成过程[7]。上述研究均提示TIMP3可能与AD有关。然而血液中TIMP3与AD的关系尚不明确。本研究结果显示,AD患者血清TIMP3水平明显降低,与Aβ1-40水平呈负相关,与Aβ1-42水平呈正相关,这提示AD患者血清TIMP3水平降低可能与脑内Aβ沉积有关。分析原因:TIMP3作为MMP的抑制剂,可能通过抑制MMP参与AD病理过程。研究发现,MMP2、MMP9能降解Aβ,导致脑内Aβ沉积增加[23]。近期研究也发现,Aβ沉积引起的脑淀粉样血管病中,脑动脉中MMP9与TIMP3表达失衡[24-25]。同时,TIMP3可抑制VEGF和VEGF2介导的促血管生成效应[22]。因此TIMP3还可能通过抑制血管生成参与AD过程,但还有待更多的研究来证实。TIMP3作用于脑血管,因此本研究中AD患者血清TIMP3水平与t-Tau、p-Tau181水平无明显相关性。MMSE评分是临床常用的AD患者认知功能评估方式,本研究中AD患者MMSE评分明显降低,提示AD患者存在明显的认知功能损害,这也与AD患者临床表现相符[1]。本研究发现,AD患者血清Ang、TIMP3水平与MMSE评分呈正相关,这提示血清Ang、TIMP3水平降低与AD患者认知功能下降有关。最后本研究通过绘制ROC曲线评价血清Ang、TIMP3对AD的诊断价值,结果发现:血清Ang、TIMP3水平单项及联合用于AD诊断的AUC分别为0.798、0.793、0.901,二者联合的AUC高于二者单项用于AD诊断,说明血清Ang、TIMP3水平均能作为AD诊断的辅助指标,且二者联合能提升AD诊断效能。
综上所述,Ang、TIMP3在AD患者血清中水平降低,与AD患者认知功能下降和Aβ沉积有关,可作为AD辅助诊断指标,二者联合能提升AD诊断效能。本研究为单中心研究,还需进一步增加样本量进行多中心研究,同时,关于Ang、TIMP3参与AD的机制还有待进一步地研究。
猜你喜欢 脑血管沉积血清 全脑血管造影术后并发症的预见性护理中国典型病例大全(2022年13期)2022-05-10脑血管造影中实施改良规范化住院医师培训的临床意义现代临床医学(2021年6期)2021-11-20血清免疫球蛋白测定的临床意义中老年保健(2021年3期)2021-08-22Meigs综合征伴血清CA-125水平升高1例天津医科大学学报(2021年2期)2021-03-29慢性鼻-鼻窦炎患者血清IgE、IL-5及HMGB1的表达及其临床意义现代临床医学(2021年1期)2021-01-26《沉积与特提斯地质》征稿简则沉积与特提斯地质(2019年1期)2019-07-16秋南方文学(2016年4期)2016-06-12欠电位沉积研究现状——I.欠电位沉积理论物理化学学报(2015年7期)2015-12-30化学浴沉积制备防污自洁型PVDF/PMMA共混膜研究中国塑料(2015年11期)2015-10-14纳洛酮治疗脑血管疾病的临床效果中国当代医药(2015年33期)2015-03-01本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0903/648809.html




