【www.zhangdahai.com--其他范文】
常明,金银浩,于倩倩,马淑敏,刘桂清
齐齐哈尔医学院附属第一医院心血管内科二病区,黑龙江齐齐哈尔 161041
急性心肌梗死是全球范围内致死致残的主要病因。早期冠状动脉介入治疗(percutaneous coronary intervention, PCI)是减小梗死面积、改善心肌及全身血灌注的有效方法,但再灌注造成心肌损伤进一步加重,降低PCI治疗的临床效果净获益,即被称之为心肌缺血/再灌注(ischemia/reperfution, I/R)损伤[1-3]。I/R损伤是一个复杂的病理过程,包括多个细胞信号通路地激活,效应基因表达水平地变化,多种不同蛋白质分子地分泌,最终引起心肌细胞代谢过程紊乱、超微结构地改变,引起心功能异常[4]。研究文献表明,早期梗死血管开通后,大约1/3的患者出现I/R损伤,使心肌细胞凋亡进一步加重,并导致不可逆的梗死区扩张,还可引起左心室重构,使远期预后恶化[5]。减轻I/R损伤仍然是缺血心肌获得最佳治疗效果的主要问题。细胞微囊泡(microvesicles, MVs)是机体细胞在激活或凋亡过程中释放至细胞外的一种膜性囊泡样物质。研究发现,大鼠经历慢性缺氧损伤后,循环血中的MVs可以通过降低体内NO水平诱发大鼠主动脉和肺动脉的内皮功能紊乱[6]。也有报道显示,MVs对心肌具有保护作用[5]。本研究以35只Wistar大鼠为研究样本,建立大鼠I/R模型,观察MVs对其影响作用。现报道如下。
1.1 材料
Wistar大鼠35只,3~6个月龄,体质量240~260 g。其中5只用于提取MVs,另外30只用于进行体I/R损伤实验,随机分为3组,每组10只。
1.2 方法
1.2.1 Mvs的提取与检测 在大鼠腹腔注射25%乌拉坦(国药准字H37022259,规格:1 g/kg),麻醉后行颈动脉插管,开胸连接呼吸机,暴露心脏,结扎冠状动脉左前降支造成心肌缺血,操作完成后再松开结扎丝线5 min实现再灌注,按上述方法循环操作3次,建立I/R模型。采集大鼠腹主动脉,2 600×g离心15 min提取上清,再进行10 000×g离心5 min提取无血小板血清,采用多聚甲醛(CAS:30525-89-4)固定后,其中一部分采用流式细胞仪检测MVs。另一部分超速离心后取沉淀物,蛋白质浓度测定方法(bicinchoninic acid, BCA)进行蛋白定量,-80℃保存备用。
1.2.2 分组与处理 将30只大鼠随机分为3组,A组为假手术组,在冠状动脉左前降支下穿一丝线后旷置150 min;
B组为I/R组,采用结扎冠脉左前降支的方法造成缺血30 min,再灌注120 min;
C组为MVs组,与B组相同方法造成I/R损伤,在缺血25 min时,从股静脉注射MVs7 mg/kg。
1.3 观察指标
1.3.1 心肌梗死面积 再灌注120 min后,对冠脉左前降支进行结扎,选择股静脉注射台盼蓝进行细胞染色。取心脏经低温处理后切成约1 mm薄片,置入1%TIC溶液中,于常温下避光孵育10 min,使用福尔马林溶液固定。将呈现为灰白色的部位(梗死区)和砖红色区域(危险区)分别从心肌组织中分离,用电子天平精确称重,计算其梗死区/危险区比值,作为梗死面积的指标。
1.3.2 心肌细胞凋亡检测 将心脏切片进行石蜡包埋、荧光染色。使用光学显微镜高功率放大(×400),随机选取10个高倍视野,观察凋亡阳性心肌细胞数量,取其与心肌细胞总数的比值作为心肌细胞凋亡指数。
1.3.3 血清乳酸脱氢酶(lactate dehydrogenase, LDH)活性 于3个时间点(麻醉后、缺血30 min、再灌注120 min)分别采集实验大鼠股静脉血0.2 mL。离心处理后采用比色法检测LDH水平。
1.3.4 心肌组织caspase 3活性 取大鼠左室前壁心肌匀浆,于4℃条件下进行18 000×g高速离心,将组织蛋白提取出来,采用Bradford法定量测定。使用微量酶标仪检测caspase 3活性。
1.3.5 Bcl-2及Bax表达水平 心肌组织加入Western及IP细胞裂解液,使其完全裂解后匀浆,提取蛋白,BCA法进行蛋白定量。采用Western blot法检测B淋巴细胞瘤-2基因(B-cell lymphoma-2, Bcl-2)及Bcl-2关联X蛋白(Bcl-2-associated X protein, Bax)表达。条带的灰度值通过Quantity One软件分析。
1.4 统计方法
采用SPSS 19.0统计学软件处理数据,符合正态分布的计量资料以(±s)表示,采用t检验,P<0.05为差异有统计学意义。
2.1 Mvs的流式检测结果
流式检测显示,Mvs浓度为(4 284±738)cells/μl。
2.2 3组心肌梗死面积比较
B组梗死区面积明显高于C组,差异有统计学意义(t=3.167,P=0.005);
B组与C组危险区面积比较,差异无统计学意义(t=0.552,P=0.588);
B组梗死区/危险区比值高于C组,差异有统计学意义(t=6.094,P<0.001)。见表1。
表1 3组心肌梗死面积对比(±s)

表1 3组心肌梗死面积对比(±s)
注:与B组比较,*P<0.05
组别A组(n=10)B组(n=10)C组(n=10)梗死区(mg)84.72±13.28(67.21±11.37)*危险区(mg)213.44±32.71 205.87±28.46梗死区/危险区(%)38.79±4.22(26.86±4.53)*
2.3 3组心肌细胞凋亡情况比较
B组心肌细胞凋亡指数高于C组,C组高于A组,差异有统计学意义(P<0.05),见表2。

表2 3组心肌细胞凋亡情况对比[(xˉ±s),%]
2.4 3组LDH活性水平比较
麻醉后,3组LDH活性比较,差异无统计学意义(P>0.05);
缺血30 min,B组、C组LDH高于A组,差异有统计学意义(P<0.05),B组与C组比较,差异无统计学意义(P>0.05);
再灌注120 min,B组LDH活性高于C组,C组高于A组,差异有统计学意义(P<0.05)。见表3。
表3 3组LDH水平对比[(±s),U/mL]

表3 3组LDH水平对比[(±s),U/mL]
注:与A组比较,*P<0.05;
与B组比较,#P<0.05
组别A组(n=10)B组(n=10)C组(n=10)麻醉后2.42±0.53 2.58±0.65 2.51±0.74缺血30 min 4.53±1.04(6.84±1.28)*(6.53±1.17)*再灌注120 min 7.68±1.38(13.45±2.15)*(10.38±2.21)*#
2.5 3组caspase 3活性、Bcl-2及Bax表达水平比较
C组caspase 3活性、Bax表达水平低于B组,Bcl-2表达水平高于B组,差异有统计学意义(t=13.889、3.357、3.988,P<0.05),见表4。
表4 3组caspase 3活性、Bcl-2及Bax表达水平对比(±s)
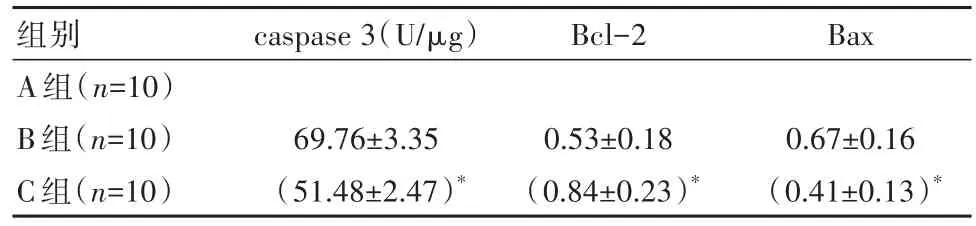
表4 3组caspase 3活性、Bcl-2及Bax表达水平对比(±s)
注:与B组比较,*P<0.05
组别A组(n=10)B组(n=10)C组(n=10)caspase 3(U/μg)69.76±3.35(51.48±2.47)*Bcl-2 0.53±0.18(0.84±0.23)*Bax 0.67±0.16(0.41±0.13)*
从目前的研究文献来看,心肌缺血预适应是获得认可的一种效果最佳的心肌自我保护机制,对防止I/R损伤心肌有着积极的保护作用,其具体作用过程与机制涉及机体代谢的复杂生物活性物质,目前尚未完全清楚[7]。本研究以实验大鼠为观察对象,建立心肌缺血预适应模型,提取MVs,注射给心肌缺血在体处理大鼠,结果发现,MVs对大鼠心肌I/R损伤具有保护作用,能够提高心肌组织中Bcl-2的表达水平,降低Bax表达水平,且下调caspase 3活性,从而起到心肌保护作用。
已有研究报道,以实验大鼠为观察对象,制作心脏I/R模型,采用灌流液中的MVs,对离体心脏进行处理,结果证实MVs具有保护心脏功能的作用[8]。本研究采用股静脉注射MVs的方法,对心肌I/R模型大鼠进行处理,观察血循环中MVs对在体大鼠I/R损伤的影响。心肌梗死面积是反映心脏组织受损严重程度最直观的指标,也是评估治疗I/R损伤是否有效的量化指标。本研究结果显示,注射MVs能够有效缩小I/R实验大鼠的心肌梗死面积,未注射MVs的B组梗死区面积为(84.72±13.28)mg,高于经过注射MVs处理的C组的梗死区面积(67.21±11.37)mg(P<0.05)。本研究中还同时检测血清LDH,结果显示,其变化趋势与上述心梗面积的变化结果具有一致性。以上指标均表明,循环血中的MVs水平对I/R模型大鼠心肌损伤可起到积极保护作用。
心肌I/R损伤的整个过程中均可出现不同程度的细胞凋亡。有研究指出,MVs能够发挥有抗凋亡作用[9]。王艺璐等[10]研究将大鼠随机分为假手术组,I/R损伤组及I/R+MVs处理组,结果发现,I/R+MVs处理组的心肌细胞凋亡比例为28.73%,低于未经MVs处理的I/R损伤组心肌细胞凋亡比例(40.68%)(P<0.01)。本研究在发现循环血中的MVs可显著降低I/R大鼠心肌损伤严重程度的基础上,进一步观察MVs对于心肌细胞凋亡的影响作用及具体机制。本研究采用TUNEL染色法,分别定性、定量进行心肌细胞凋亡检测,结果显示,注射MVs可有效减轻I/R实验大鼠心肌细胞凋亡率[(32.94±1.48)% vs (18.68±1.53)%],与王艺璐等[10]报道基本一致。这进一步证实,MVs可通过抑制心肌细胞凋亡,从而发挥心肌保护功能。
Caspase 3是caspase级联反应过程中的重要一环,在影响细胞凋亡中扮演关键角色[11]。已有研究报道,从多能干细胞中提取MVs,可有效抑制小鼠I/R心肌组织中的Caspase 3水平,从而起到抑制细胞凋亡的作用[12]。本研究中检测了心肌组织caspase 3,实验大鼠在遭受心肌I/R损伤后,caspase3活性水平明显升高,通过注射MVs进行处理,可降低caspase升高幅度,这一结果提示,抑制caspase3的表达水平可能是Mvs抑制心肌细胞凋亡的重要机制之一。
已有研究证实,Bel家族蛋白的表达水平与心肌细胞凋亡程度存在密切相关。Bcl家族包括两种具有拮抗功能的蛋白质,分别起着加速与抑制细胞凋亡的作用。此两种蛋白的表达水平和功能状态之间保持平衡是机体调控细胞凋亡的关键机制。有研究发现,大鼠发生心肌I/R损伤过程中,Bcl-2蛋白活性下调,Bax蛋白活性升高,Bcl-2/Bax比值呈现显著下降趋势[13]。对I/R大鼠进行心肌缺血预处理,能够显著上调Bcl-2蛋白水平,从而起到抑制细胞凋亡作用[14]。另有研究指出,从人T淋巴细胞中提取的Mvs能够使Bcl-2活性升高、Bax表达水平降低,这对于由放射菌素D造成的内皮细胞凋亡具有拮抗作用[15]。本研究着重观察MVs对I/R大鼠Bcl-2/Bax表达的影响情况。采用Western blot法检测结果显示,心肌I/R损伤发生后,实验大鼠Bcl-2蛋白表达明显降低,Bax表达显著升高,经过MVs处理后,Bcl-2蛋白表达升高,I/R诱导的Bax蛋白降低。这可能是MVs抑制心肌细胞凋亡的另一重要机制。
综上所述,对I/R大鼠注射MVs,可有效发挥心肌保护作用,其作用机制可能与上调Bcl-2蛋白表达,抑制Bax的蛋白水平,从而提高Bcl-2/Bax比值,以及降低caspase 3活性等有关。是否存在其他保护机制还需以后继续深入探讨。随着对MVs研究的的重视,将为缺血性心脏病(ischemic heart disease, IHD)的治疗方案的选择提供新的参考依据。
猜你喜欢 心肌细胞心肌活性 Co3O4纳米酶的制备及其类过氧化物酶活性河北科技师范学院学报(2022年2期)2022-08-26左归降糖舒心方对糖尿病心肌病MKR鼠心肌细胞损伤和凋亡的影响世界科学技术-中医药现代化(2022年2期)2022-05-25骨碎补化学成分和生物活性研究进展世界科学技术-中医药现代化(2021年8期)2021-12-21活血解毒方对缺氧/复氧所致心肌细胞凋亡的影响世界科学技术-中医药现代化(2021年7期)2021-11-04高盐肥胖心肌重构防治有新策略中国生殖健康(2020年7期)2020-12-10简述活性包装的分类及应用(一)上海包装(2019年2期)2019-05-20伴有心肌MRI延迟强化的应激性心肌病1例中国临床医学影像杂志(2019年1期)2019-04-25金丝草化学成分及其体外抗HBV 活性中成药(2018年2期)2018-05-09冠心舒通胶囊对心肌细胞Ca2+ -CaM-CaMPK Ⅱ δ信号系统的影响中成药(2017年8期)2017-11-22干细胞心肌修复的研究进展中西医结合心脑血管病杂志(2016年20期)2016-03-01本文来源:http://www.zhangdahai.com/shiyongfanwen/qitafanwen/2023/0809/637283.html




